
- •1.Предмет физики.
- •2. Кинематика материального пункта.
- •3.Силы в природе.
- •5.Механика цвердага цела.
- •6. Вагальны рух.
- •7. Рух у інэрцыяльных сістэмах адліку.
- •8. Механіка вадкасцей і газау.
- •9.Асновы мкт ідэалльнага газу.
- •10. Размеркаванне малекул па хуткасцях
- •11. Вызначэнне пастаяннай Авагадра
- •12. Першы пачатак тэрмадынамікі
- •18. Патэнцыял поля пунктавага зараду, дыполя, сістэмы зарадаў. Сувязь патэнцыялу і напружнасці поля
- •20. Энергія сістэмы пунктавых зарадаў. Энергія зараджаных праваднікоў. Энергія зараджанага кандэнсатара. Энергія і шчыльнасць энергіі электрастатычнага поля
- •22. Электраправоднасць цвёрдых цел.
- •23. Несамастойныя і самастойныя газавыя разрады
- •24.Электраліты. З-н Ома для электралитаў Электроліз.
- •25.Магнітнае поле току. Індукцыя магнітнага поля. Магн. Паток.
- •26.Сіла Ампера, Лорэнца. Эффект Холла.
- •27.Магнітныя ўласцівасці рэчыва
- •28. Электрамагнітная індукцыя
- •29. Электрычны вагальны контур
- •30. Квазістацыянарныя токі. Атрыманне пераменнай эдс.
- •31.Эл. Маг. Поле, эл.Маг. Хвалі.
- •32.Фотаметрыя. Крыніцы и прыемнікі святла. Асноўныя фотометрычныя веліч. І адз. Іх вым.
- •33. Асноўныя паняцці геаметрычнай оптыкі. Праламленне святла на плоскай мяжы падзелу двух асяроддзяў. Сферычныя люстры і тонкія лінзы. Цэнтраваныя аптычныя сістэмы
- •34.Інтерф. Св. Метады назірання інтерф. Ў оптыцы. Двухпрамен. Інтерф. Многапрамен. Інтер. Інтерферометры. Прыменненне інтерференцыі.
- •35. Дыфракцыя святла. Дыфракцыя Фрэнеля на розных перашкодах. Дыфракцыя Фраўнгофера. Дыфракцыйная рашотка. Дыфракцыя святла на прасторавых рашотках.
- •36. Натур. І паляр. Святло. Віды палярызацыі. Паляр. Св. Пры адбіцці і праламленні на мяжы дзвюх дыэлектрыкаў. Падвойнае праменепраламленне. Штучная апт. Анізатрапія. Паляр. Прыборы.
- •37. Дысперсія святла. Нармальная і анамальная дысперсія святла. Метады вымярэння дысперсіі. Асновы электроннай тэорыі дысперсіі. Прызменныя спектральныя прыборы
- •40. Цеплавое выпраменьванне. Выпраменьвальная і паглынальная здольнасці цела. Закон Кірхгофа і яго вынікі. Выпраменьванне абсалютна чорнага цела. Законы Стэфана-Больцмана і Віна.
- •41. Аптычная піраметрыя. Размеркаванне энергіі ў спектры выпраменьвання абсалютна чорнага цела. Фатоны. Формула Планка.
- •42. Квантавыя ўласцівасці выпраменьвання. Фотаэлектрычны эфект. Законы фотаэфекту. Раўнанне Эйнштэйна. Прымяненне фотаэфекту.
- •43. Ціск святла. Доследы Лебедзева. Досдеды Вавілава. Дослед Ботэ. Эфект Комптана.
- •44. Асновы квантавай механікі. Хвалі дэ Бройля. Доследы па дыфракцыі электронаў.
- •45. Прынцып невызначальнасцей Гейзенберга. Хвалевая функцыя і яе фізічны сэнс. Раўнанне Шродзінгера
- •46. Доследы Резерфорда. Планетарная мадэль атама. Доследы Франка і Герца. Доследы Штэрна і Герлаха.
- •47. Мадэль атама вадароду па Бору. Спектральныя серыі выпраменьвання атамнага вадароду.
- •49.Тармазное і характарыстычнае рэнтгенаўскія вьшраменьванні і іх спектры
- •51.Састаў ядра. Нуклоны.
47. Мадэль атама вадароду па Бору. Спектральныя серыі выпраменьвання атамнага вадароду.
Самым
прасц.
атамам з’яўл. атам вадароду. У гэтага
атама вакол ядра толькі адзін заряд
![]() ,
а само ядро прынята лічыць элем. часц.,
якую наз. пратонам. Зарад пратона
,
а само ядро прынята лічыць элем. часц.,
якую наз. пратонам. Зарад пратона
![]() ,
а маса пратона больше масы электрона ~
1837
разоў.
,
а маса пратона больше масы электрона ~
1837
разоў.
![]() —
выраз
для арбіт па якіх рух-ца электрод у атаме
вадароду.
—
выраз
для арбіт па якіх рух-ца электрод у атаме
вадароду.
![]() ,
,
![]() —у
атаме вад. пат. энергія роўна падвоен.
кін энерг.
—у
атаме вад. пат. энергія роўна падвоен.
кін энерг.
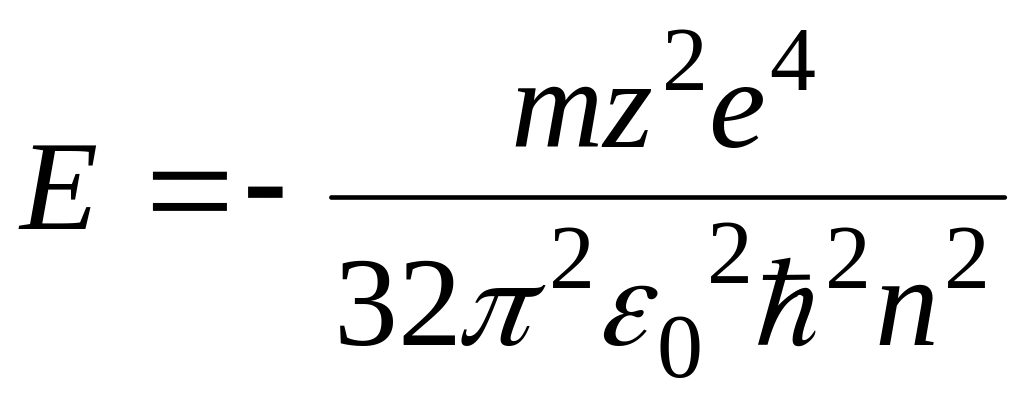 — поўная
энергія электр. у атаме вадарода.
— поўная
энергія электр. у атаме вадарода.
Швейцарскі
фізік Бальмер выявіў, што даўжыні хваль
вядомых у той час спектр. ліній атама
вад. можна вызначыць паводле формулы
![]() ,
наз-ць формулай Бальмера.,дзе
,
наз-ць формулай Бальмера.,дзе
![]() = 364,6 нм; п
— цэлы лік, які прымае значэнні 3,4 і г.д.
= 364,6 нм; п
— цэлы лік, які прымае значэнні 3,4 і г.д.
![]() дазваляе
вызначыць частату шэрага спектральных
ліній атама вадароду, калі надаваць п
= 3, 4, 5, 6,... Усе гэтыя лініі ўтвараюць
групу ліній, якую наз-ць
серыяй
Бальмера. 3
павелічэннем п
лініі гэтай серыі набліжаюцца адна да
адной. Значэнне п
=
дазваляе
вызначыць частату шэрага спектральных
ліній атама вадароду, калі надаваць п
= 3, 4, 5, 6,... Усе гэтыя лініі ўтвараюць
групу ліній, якую наз-ць
серыяй
Бальмера. 3
павелічэннем п
лініі гэтай серыі набліжаюцца адна да
адной. Значэнне п
=
![]() вызначае мяжу серыі Бальмера
вызначае мяжу серыі Бальмера
![]() .
.
У спектры атама вадароду, акрамя серыі Бальмера, павінны назірацца іншыя спектр. серыі, частату ліній якіх можна атрымаць шляхам камбінацыі тэрмаў ліній серыі Бальмера
Часта ўнугры серыі Бальмера выдзяляюць асобныя лініі:
![]() ,
для якой
,
для якой
![]() ;
;
![]() ,
для якой
,
для якой
![]() ;
;
![]() ,
для якой
,
для якой
![]()
Выкарыстоўваючы
тэрмы гэтых ліній, можна атрымаць
![]()
Дакладнае даследаванне спектра атама вадароду паказала, што ў ім назіраюцца наступныя спектр. серыі:
серыя
Лаймана ![]() ,
к
= 2, 3, 4,...;
,
к
= 2, 3, 4,...;
серыя
Бальмера ![]() ,
к
= 3, 4, 5,...;
,
к
= 3, 4, 5,...;
серыя
Пашэна ![]() ,
к
= 4, 5, 6,...;
,
к
= 4, 5, 6,...;
серыя
Брэкета ![]() ,
к
= 5, 6, 7,...;
,
к
= 5, 6, 7,...;
серыя
Пфунда ![]() ,
к
= 6,
7,
8,…;
,
к
= 6,
7,
8,…;
серыя
Хэмфры ![]() ,
к
= 7, 8, 9, ...
,
к
= 7, 8, 9, ...
Усе
вядомыя спектральныя серыі атама
вадароду можна апісаць агульнай формулай
![]() .
.
Серыя Лаймана размешчана ва ўльтрафіялетавай вобласці спектра, серыя Бальмера — у бачнай і блізкай да ўльтрафіялетавай, усе астатнія серыі — у інфрачырвонай вобласці спектра.
Пры
![]() усе
частоты серый імкнуцца да адпаведных
межаў серый:
усе
частоты серый імкнуцца да адпаведных
межаў серый:![]()
48.
Квантаванне энергіі, моманту імпульсу
і праекцыі моманту імпульсу. Згодна
з тэорыяй Бора, электрон рухаецца па
кругавых арбітах і яго стан характарызуецца
галоўным квантавым лікам n,
які вызначае энергію атама ў гэтым
стане. Далейшае развіццё тэорыя Бора
атрымала ў працах нямецкага фізіка
А.3омерфельда, які паказаў, што пры
характарыстыцы станаў атама патрэбна
ўлічваць не толькі кругавыя, але і
эліптычныя арбіты. Згодна з тэорыяй
Бора-Зомерфельда,
не толькі энергія, але і момант імпульсу
прымае квантаваныя значэнні. Рух
электрона ў атаме вакол ядра характарызуецца
арбітальным момантам імпульсу Мl,
велічыня якога вызначаецца наступным
чынам:
![]() (48.1). Лік l
называюць арбітальным або азімутальным
квантавым лікам. Арбітальны квантавы
лік пры дадзеным n
прымае наступныя значэнні: l=
0,1,2,..., (n-1).
Такім чынам, электрон, што валодае пэўнай
энергіяй, можа рухацца па розных арбітах,
якія вызначаюцца лікам l.
Магчымыя значэнні малых паўвосей b
эліптычных арбіт залежаць ад галоўнага
і арбітальнага квантавых лікаў:
(48.1). Лік l
называюць арбітальным або азімутальным
квантавым лікам. Арбітальны квантавы
лік пры дадзеным n
прымае наступныя значэнні: l=
0,1,2,..., (n-1).
Такім чынам, электрон, што валодае пэўнай
энергіяй, можа рухацца па розных арбітах,
якія вызначаюцца лікам l.
Магчымыя значэнні малых паўвосей b
эліптычных арбіт залежаць ад галоўнага
і арбітальнага квантавых лікаў:
![]() (48.2).
3 роўнасці (48.2) відаць, што пры l=n-1
(48.2).
3 роўнасці (48.2) відаць, што пры l=n-1
![]() ,
г.зн. электрон рухаецца па кругавой
арбіце. Астатнія арбіты для гэтага стану
эліптьгчныя. Электрон у вадародападобным
іоне на n-м
энергетычным узроўні можа рухацца па
адной кругавой арбіце і (n-1)
эліптычных арбітах. Формула
(48.1) для моманту
імпульсу Ml
была ўдакладнена і прыняла выгляд
,
г.зн. электрон рухаецца па кругавой
арбіце. Астатнія арбіты для гэтага стану
эліптьгчныя. Электрон у вадародападобным
іоне на n-м
энергетычным узроўні можа рухацца па
адной кругавой арбіце і (n-1)
эліптычных арбітах. Формула
(48.1) для моманту
імпульсу Ml
была ўдакладнена і прыняла выгляд
![]() .
Пад уплывам кулонаўскага поля ядра
электрон рухаецца па плоскай элілтычнай
арбіце. Аднак магчымы такія адхіленні
арбіты, пры якіх арбіта не будзе плоскай.
Пры дзеянні вонкавага магнітнага поля
на атам могуць ажыццяўляцца толькі
такія арыентацыі арбіт, пры якіх праекцыя
вектара моманту імпульсу Ml
на вось Z (вось Z супадае з напрамкам
магнітнага поля) будзе роўная
.
Пад уплывам кулонаўскага поля ядра
электрон рухаецца па плоскай элілтычнай
арбіце. Аднак магчымы такія адхіленні
арбіты, пры якіх арбіта не будзе плоскай.
Пры дзеянні вонкавага магнітнага поля
на атам могуць ажыццяўляцца толькі
такія арыентацыі арбіт, пры якіх праекцыя
вектара моманту імпульсу Ml
на вось Z (вось Z супадае з напрамкам
магнітнага поля) будзе роўная
![]() ,
дзе
,
дзе
![]() .
Лік
.
Лік
![]() называюць
магпітным квантавым лікам.
называюць
магпітным квантавым лікам.
Спін
і магнітны момант электрона. Даследаванне
спектраў выпраменьвання шчолачных
металаў пры дапамозе спектральных
прыбораў з вялікай адрознівальнай
здольнасцю паказала, што лініі асноўных
спектральных серый гэтых атамаў маюць
складаную структуру. Спектральную
лінію, якая складаецца з некалькіх
блізка размешчаных кампанент, называюць
мультыплетам.
Тонкая структура ліній назіраецца не
толькі ў атамаў шчолачных металаў. Лік
кампанент у мультыплеце бывае розным:
дзве (душтет), тры (трыплет), чатыры
(квартэт) і г.д. Адзіночныя спектральныя
лініі называюць сінглетам.
У 1925г. амерыканскія фізікі Дж.Уленбек
і С.Гаўдсміт для тлумачэння мультыплетнасці
спектраў выказалі гіпотэзу аб тым, што
электрон валодае ўласным момантам
імпульсу Мσ
і звязаным з ім магнітным момантам μ.
Уласны момант імпульсу называюць спінам.
Згодна з законамі нерэлятыўнай квантавай
механікі, заснаванай на раўнанні
Шродзінгера, спін лічаць унутранай
неад'емнай ўласцівасцю электрона, як
яго масу і зарад. Праекцыя спіна электрона
на зададзены напрамак у прасторы (OZ)
можа прымаць наступныя значэнні:
![]() ,
дзе
,
дзе
![]() –
спінавы
квантавы лік,
роўны ±1/2. Стасунак магнітнага і
механічнага момантаў часціцы называюць
гірамагітным
стасункам.
Для ўласнага моманту электрона ён роўны
–
спінавы
квантавы лік,
роўны ±1/2. Стасунак магнітнага і
механічнага момантаў часціцы называюць
гірамагітным
стасункам.
Для ўласнага моманту электрона ён роўны
![]() ,
адкуль
,
адкуль
![]() .
.
Праекцыя
ўласнага магнітнага моманту электрона
на вось можа прымаць значэнні
![]() ,
або
,
або
![]() .
Велічыню
.
Велічыню
![]() называюць
магнетонам Бора. Паколькі
mσ=
±1/2,
то можам запісаць
называюць
магнетонам Бора. Паколькі
mσ=
±1/2,
то можам запісаць
![]() .
.
Прынцып
Паўлі. У
1925 г. швейцарскі фізік В.Паўлі (1900-1958)
сфармуляваў наступны закон: у атаме не
можа быць двух электронаў, у якіх усе
чатыры квантавыя лікі аднолькавыя. Гэты
закон часта называюць прынцыпам
Паўлі або прынцыпам выключэння.
Гэты прынцып першапачаткова быў
сфармуляваны на падставе дакладнага
аналізу спектраскапічных даных і толькі
пазней абгрунтаваны на падставе квантавых
законаў. Сутнасць прынцыпу Паўлі можна
выразіць пры дапамозе наступнай роўнасці:
Z(n,l,ml,mσ)
= 0 або 1, дзе Z(n,l,ml,mσ)
– колькасць электронаў, што знаходзяццаў
стане, які характарызуецца наборам
квангавых лікаў (n,l,ml,mσ).
Карыстаючыся прынцыпам Паўлі, можна
вызначыць максімальную колькасць
электронаў у атаме, якія маюць зададзеныя
значэнні трох (n,l,ml),
двух (n,l)
і аднаго (n)
квантавых лікаў. Паколькі лік mσ
можа прымаць толькі два значэнні: +1/2 і
-1/2, то магчымыя станы электрона з
квантавымі лікамі (n,l,ml,+1/2)
i Z(n,l,ml,-1/2),
а г.зн. Z(n,l,ml)=2.
Магнітны квантавы лік ml
прымае (2l
+1) значэнняў, таму Z(n,l)=2(2l
+1). Пры зададзеным n
лік l
прымае значэнні ад 0 да (n-1),
таму, каб атрымаць Z(n), неабходна знайсці
суму Z(n)=![]() .
.
Перыядычны закон Мендзелеева. У 1869г. Дз.І. Мендзялееў адкрыў закон змянення хімічных і фізічных уласцівасцей элемента ў залежнасці ад іх атамных мас. Перыядычны закон Мендзялеева складае аснову сучаснай хіміі, атамнай і ядзернай фізікі. Фізічны сэнс парадкавага нумару Z элемента ў Перыядычнай сістэме элементаў Мендзялеева быў высветлены Рэзерфордам у выніку доследаў па рассеянні α-часціц. Ён роўны колькасці элементарных дадатных зарадаў у ядры атама, якая адпавядае колькасці пратонаў. Хімічныя ўласцівасці элементаў і шэраг іх фізічных уласцівасцей тлумачацца паводзінамі вонкавых, так званых валентных, электронаў у атаме. Перыядычная сістэма элементаў Мендзялеева грунтуецца на наступных палажэннях: 1) парадкавы нумар хімічнага элемента роўны агульнай колькасці электронаў у атаме дадзенага элемента; 2) стан электронаў у атаме вызначаецца наборам іх квантавых лікаў n,l,ml,mσ. Размеркаванне электронаў у атаме па энергетычных станах павінна задавальняць прынцыпу мінімума патэнцыяльнай энергіі: з узрастаннем колькасці электронаў кожны наступны электрон займае магчымы энергетычны стан з найменшай энергіяй; 3) запаўненне электронамі энергетычных станаў у атаме павінна адбывацца ў адпаведнасці з прынцыпам Паўлі.
Электроны ў атаме, якія займаюць сукупнасць станаў з аднолькавым значэннем галоўнага квантавага ліку n, утвараюць электронную абалонку або электронны слой. Максімальную колькасць электронаў на абалонках можна вызначыць па формуле: Z(n)=2n2. Унутры кожнай абалонкі электроны размяркоўваюцца па падгрупах (падабалонках), кожная з якіх адпавядае пэўнаму значэнню арбітальнага квантавага ліку l. Максімальная колькасць электронаў на пэўнай падабалонцы можа быць вызначана паводле формулы: N(n,l) = 2(21 +1). Электронны стан атама ўмоўна абазначаюць пры дапамозе двух квантавых лікаў n і l.Паказчык уверсе паказвае колькасць электронаў, якія знаходзяцца ў гэтым стане: напрыклад, Зр4. Электроны, што знаходзяцца ў станах, якія характарызуюцца аднолькавымі квантавымі лікамі n i l, называюць эквівалентнымі.
