
- •Неорганическая химия способы выражения состава растворов
- •Задачи для самостоятельного решения
- •1 Следствие
- •2 Следствие
- •Задачи для самостоятельного решения
- •Растворы сильных электролитов
- •Задачи для самостоятельного решения
- •Растворы слабых электролитов
- •Задачи для самостоятельного решения
- •Буферные растворы
- •Кривые титрования
- •Произведение растворимости
- •Задачи для самостоятельного решения
- •Окислительно-восстановительные реакции
- •Окислители и восстановители
- •Окислители.
- •Окислительно-восстановительные свойства сложных веществ
- •Влияние среды реакции.
- •Влияние среды на состав продуктов реакции
- •Влияние концентрации на состав продуктов реакции
- •Водород в реакциях с азотной кислотой практически не выделяется! Реакции серной кислоты
- •Реакции самоокисления-самовосстановления
- •Химическая связь.
- •Ковалентная связь
- •Метод валентных связей
- •Валентность
- •Гибридизация атомных орбиталей и геометрия молекул
- •Метод молекулярных орбиталей
- •Энергия связи
- •При переходе от одинарной связи двойной и тройной (между одними и теми же атомами) энергия связи возрастает, однако связь укрепляется непропорцианально увеличению её кратности.
- •Б)что длина связи уменьшается с возрастанием порядка или кратности связи, а прочность увеличивается с уменьшением длины связи.
- •Окислительно-восстановительные процессы.
- •Комплексные соединения
- •Задачи для самостоятельного решения
- •Вопросы и задачи для самостоятельного решения
- •4. Изобразите геометрическую форму ионов: ClO-, ClO3-, ClO4-.
1 Следствие
Тепловой эффект химической реакции при стандартных условиях равен сумме стандартных энтальпий образования продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ.
Например:
СН4(г) + 2О2(г) = СО2(г) + 2Н2О(ж)
∆Нореакции = [∆Ноf ,298(СО2) + 2 ∆Ноf ,298(Н2О)] - [ ∆Ноf ,298(СН4) + 2 ∆Ноf ,298(О2)] =
[-393,5 + 2(-241,8)] - [(-74,8) + 2∙ 0] = -802,3 кДж.
2 Следствие
Тепловой эффект химической реакции при стандартных условиях равен сумме стандартных энтальпий сгорания исходных веществ за вычетом суммы стандартных энтальпий сгорания продуктов реакции.
Например:
С2Н2 (г) + СО(г) + Н2О(ж) = СН2 = СН—СООН(ж)
∆Нореакции = [∆Носг ,298(С2Н2) + ∆Носг ,298(СО) + ∆Носг ,298(Н2О) – [ ∆Носг ,298(С2Н3СООН)] =
[-1299,6 - 282,5 + O] - [-1370,0] = -211,13 кДж
Первое начало термодинамики не даёт ответа на вопрос о направлении самопроизвольно протекающих процессов при данных условиях. Самопроизвольные процессы—это процессы, происходящие вокруг нас, которые, исходя из опыта, мы считаем наиболее вероятными.
Например: энтальпия реакции 12С( т) + 11Н2О(ж) = С12Н22О11(т), рассчитанная по закону
Гесса ∆Н<O, хотя она реально неосуществима.
А у реакции N2(г) + O2(г) = 2NO(г) ∆Н>O , но она протекает при высокой температуре.
Таким образом, изменение энтальпии нельзя считать единственной причиной самопроизвольного протекания реакций. Существует ещё функция состояния системы, изменение которой оказывает влияние на направление процесса — энтропия S.Энтропия – функция состояния системы, величина которой показывает меру неупорядоченности хаотичности системы.
Одна из формулировок второго начала термодинамики— в изолированных системах самопроизвольно протекающие процессы сопровождаются увеличением энтропии.
Для необратимых процессов в изолированных системах изменение энтропии ∆S>O,
для обратимых процессов ∆S = O. Все реальные процессы необратимы, лишь небольшое число из них можно приближённо рассматривать как обратимые. Следовательно, в результате реальных процессов энтропия изолированной системы всегда увеличивается.
Чем ближе термодинамическое равновесие тем больше хаотичность расположения молекул в теле или в системе. Следовательно самопроизвольные процессы в изолированных системах протекают только в направлении возрастания энтропии S.
∆S = S2 - S1 >O идёт процесс 1→ 2
∆S = S2 - S1 <O идёт процесс 2 ← 1
∆S = O термодинамическое равновесие
В неизолированной системе самопроизвольно протекают реакции, в результате которых химическая система достигает состояния, характеризующегося не только меньшей энтальпией, но и большей энтропией.
Учесть одновременно оба фактора для систем находящихся при постоянном давлении и температуре позволяет функция состояния — свободная энергия Гиббса: G = H —TS.
Абсолютные значения энергии Гиббса, так же как и абсолютные значения энтальпии, невозможно определить, поэтому используют уравнение ∆G =∆ H —T∆S
Условием самопроизвольного протекания изобарно-изотермических процессов является неравенство ∆G<O. Реакция продолжается до достижения минимального значения энергии Гиббса. В обратимых реакциях минимальная энергия системы достигается в состоянии химического равновесия. После установления химического равновесия ∆G = O.
Величина энергии Гиббса складывается из энтальпийного вклада ∆H и энтропийного вклада T∆S.
Рассмотрим различные варианты:
1. ∆H<O , ∆S >O ∆G <O процесс протекает в прямом направлении независимо от величин ∆H,∆S,T
2 ∆H <O, ∆S <O ∆G <O , если |∆H|>|T∆S| , такие реакции возможны при низких температурах
3. ∆H >O, ∆S <O ∆G >O, процесс может протекать только в обратном направлении
4. ∆H >O, ∆S >O ∆G<O, если |T∆S|> |∆H|, процесс может протекать при высокой температуре
Равновесное состояние— термодинамическое состояние сиcтемы, которое при постоянных внешних условиях не изменяется во времени, причём стабильность характеристик системы (состав, давление и др.) не обусловлена протеканием какого-либо внешнего процесса.
Признаки истинного равновесия системы:
1. Неизменность равновесного состояния системы при сохранении внешних условий.
2. Подвижность равновесия —самопроизвольное восстановление равновесие после прекращения внешнего воздействия.
3. Динамический характер равновесия— скорость прямого процесса равна скорости обратного процесса.
4. Состояние системы будет одинаковым независимо от того, с какой стороны она подходит к равновесию.
5. Энергия Гиббса в состоянии истинного термодинамического равновесия минимальна Gmin,
a изменение энергии Гиббса равно нулю ∆G=0.
Концентрации реагентов и продуктов реакции в состоянии химического равновесия называются равновесными.
Состояние равновесной химической системы характеризуется по закону действующих масс константой равновесия.
Для обратимой химической реакцией, которую в общем виде можно изобразить уравнением:
aA + bB = dD + qQ константа равновесия имеет вид:
![]()
где Кс — константа равновесия; [A], [B] — равновесные концентрации исходных веществ;
[D], [Q] — равновесные концентрации продуктов реакции; a,b,d,q — стехиометрические коэффициенты.
Выражение константы равновесия показывает: для идеальных систем в состоянии химического равновесия отношение произведений концентраций продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению концентраций исходных веществ в степенях, равных стехиометрическим коэффициентам, есть величина постоянная при данных температуре давлении и в данном растворителе.
В общем случае формулировка закона действующих масс гласит: в состоянии химического равновесия отношении произведений активностей продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению активностей исходных веществ в степенях, равных стехиометрическим коэффициентам, есть величина постоянная при данных температуре давлении и в данном растворителе.
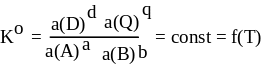
Факторы, влияющие на величину константы химического равновесия:
1.Природа реагирующих веществ 2.Температура.
Факторы не влияющие на величину константы равновесия:
Концентрации реагирующих веществ
Давление в реакционной системе
Наличие примесей
Смещение химического равновесия
Переход равновесной химической системы из одного состояния равновесия( с одними равновесными концентрациями) в другое( с другими равновесными концентрациями). называется смещением химического равновесия, которое происходит в результате изменения температуры, концентрации, давления.
Направление смещения химического равновесия определяется принципом Ле Шателье:
Если на систему в состоянии истинного равновесия воздействовать извне, изменяя термодинамические параметры, то равновесие сместится в таком направлении, которое ослабит эффект внешнего воздействия.
При смещении равновесия, вызванного изменением концентраций и давления, константа равновесия остаётся постоянной, при изменении температуры константа равновесия меняется.
При увеличении концентрации хотя бы одного из исходных веществ равновесие смещается в сторону продуктов реакции, а при добавлении продуктов — в сторону исходных веществ.
Изменение давления вызывает смещение равновесия только в реакциях с участием газообразных веществ и притом лишь в тех случаях где сумма стехиометрических коэффициентов в левой и правой части реакции не равны.
Повышение давления равновесие смещается в сторону той реакции, которая идёт с уменьшением числа молекул.
Повышение температуры смещает равновесие в сторону эндотермической реакции, понижение—экзотермической.
Пример 1.Рассчитайте стандартную энтальпию реакции
2SO2(г) + O2(г) = 2SO3(г)
ΔHfo (кДж/моль) -297 0 -396
Решение: Δ Нор-ции = Σ ΔНопрод - Σ ΔНоисх = 2(-396) - [2(-297) + 1(0)] = -198 кДж
Пример 2. Рассчитайте стандартную энтальпию образования этанола, если стандартные энтальпии сгорания углерода, водорода и этанола соответственно равны (в кДж/моль): -393,5; -285,8; -1366,9.
Решение: Уравнение реакции, соответствующей энтальпии образования этанола-
2С + 3Н2 + 0,5О2 = С2Н5ОН
Δ Нор-ции = Σ ΔНосг.исх - Σ ΔНосг.эт. = 2(-393,5) + 3(-285,8)- (-1366,9) = -277,6 кДж/моль
По определению Δ Нор-ции = ΔHfo(С2Н5ОН).
Пример 3. Рассчитайте стандартную энтропию ΔSo реакции: SO2(г) + 0,5O2(г) = SO3(г)
Если стандартные энтропии образования SO2(г),SO2(г),SO3(г) равны соответственно(в Дж/К моль):
248, 205, 257.
Решение: ΔSo = Σ S fo прод. - Σ Sf oисх. = 2·257 -(2· 248 1· 205) = -187 Дж/К
Пример 4. Пользуясь значениями ΔGof отдельных соединений, вычислите ΔGo реакции
SO2(г) + NO2(г) = SO3(г) + NO(г) и определите её направление в стандартных условиях.
Решение: ΔGo р-ции = [ΔGof(SO3) + ΔGof(NO)] - [ΔGof(SO2) + ΔGof(NO2)] =
(-370,4 + 86,6) - (-300,4 + 51,8) = -35,2 кДж Величина ΔGo р-ции < О, значит реакция протекает в сторону образования SO3 и NO.
Пример 5. Константа равновесия системы H2(г) + I2(г) = 2HI(г) при некоторой температуре равна 40. Определите равновесные концентрации реагирующих веществ, если исходные концентрации этих веществ составляют (в моль/л): [I2] = 0,01; [H2] = 0,03.
Решение: Пусть уменьшение концентрации водорода и иода к моменту равновесия будет x. Тогда равновесные концентрации составят( в моль/л): [I2] =(0,01 - x); [H2] = (0,03 – x); [HI] = 2x.
Решение этого уравнения даёт два корня:x1= 0,0349 моль/л и x2= 0,0096моль/л
Так как исходная концентрация иода равна 0,01 моль/л, уменьшение концентрации не может превышать эту величину и, следовательно, решением задачи будет x2= 0,0096моль/л.Тогда равновесные концентрации реагирующих веществ будут равны(в моль/л):
[[H2]р = 0,01 – 0,0096 = 0,0004; [I2]р = 0,03 – 0,0096 = 0,0204; [HI]р = 2 0,0096 = 0,0192.
Пример 6.Химическое равновесие реакции СО2(г) + Н2(г) = СО(г)+Н2О(г)
Установилось при следующих концентрациях реагирующих веществ(моль/л):
[CO2] = 7,0; [H2] = 5,0; [CO] = 10; [H2O] = 14. Равновесие системы было нарушено вследствие уменьшения концентрации Н2О до 11 моль/л Рассчитайте равновесные концентрации реагирующих веществ после сдвига равновесия.
Решение. Уменьшение концентрации Н2О показывает, что равновесие сместилось в сторону прямой реакции. Таким образом, концентрация СО2 и Н2 уменьшилась, а концентрация СО и Н2О увеличилась. Пусть изменение концентрации реагирующих веществ будет х моль/л.Тогда новые равновесные концентрации после смещения равновесия будут равны (в моль/л):
[CO2] = (7-x); [H2] = (5-x); [CO] = (10 + x); [H2O] = (11 + x).
Константа равновесия данной реакции равна:
Кс = [CO] [H2O] / [CO2][H2] = 10 · 14 / 7 · 5 = 4,0.
4 = (10 +x) (11 +x) / (7 – x)(5 – x) = (110 + 21x + x2) / (35 – 12x + x2).
x2 – 23x +10 = 0; x1 = 22,56; x2 = 0,44.
Реальное значение имеет второй корень. Следовательно, х = 0,44моль/л.
Новые равновесные концентрации:
[CO2] = 7,0 – 0,44 = 6,56 моль/л; [H2] = 5,0 – 0,44 = 4,56 моль/л;
[CO] = 10,0 + 0,44 = 10,44 моль/л; [H2O] = 11,0 + 0,44 = 11,44 моль/л.
