
- •Содержание
- •Уважаемый студент!
- •Образовательный маршрут по дисциплине естествознание
- •Желаем Вам удачи! содержание дисциплины
- •Раздел 1 химия
- •Тема 5.1 Периодический закон и периодическая система химических элементов д.И.Менделеева и строение атома
- •Тема 5.2 Строение вещества. Химическая связь.
- •Тема 5.3 Условия протекания химической реакции
- •Тема 5.4 Неорганические соединения. Классификация
- •Тема 5.5 Металлы и неметаллы
- •Раздел 2 Органическая химия
- •Тема 5.7. Органические соединения. Многообразие
- •Тема 5.8 Предельные углеводороды и непредельные углеводороды
- •Тема 5.9 Кислородсодержащие органические соединения.
- •Тема 5.10 Азотсодержащие органические соединения. Полимеры.
- •Раздел 6 Биология
- •Тема 6.1 Клетка – элементарная живая система. Химическая организация клетки.
- •Тема 6.2 Молекулярная основа наследственной информации
- •Тема 6.3 Вирусы как внеклеточные формы жизни.
- •Тема 6.4 Размножение организмов
- •Тема 6.6 Биотехнология
- •Тема 6.4 Многообразие и эволюция органического мира
- •Тема 6.5 Гипотезы происхождения жизни. Надорганизменные системы
- •Тема 6.6 Биосфера- оболочка живых организмов на Земле. Структура.
- •Текущий контроль
- •Итоговый контроль по дисциплине глоссарий
- •Информационное обеспечение дисциплины Основные источники (для студентов)
- •Дополнительные источники (для студентов)
Тема 5.2 Строение вещества. Химическая связь.
Основные понятия и термины по теме: Ковалентная полярная и неполярные связи. Механизм образования ковалентной связи(обменный и донорно-акцепторный).Электроотрицательность. Ионная связь. Металлическая связь. Водородная связь. Типы кристаллических решеток(молекулярная, атомная, ионная, металлическая). План изучения темы:
1. Виды химической связи.
2. Типы кристаллических решеток. Свойства веществ
Краткое изложение теоретических вопросов:
1. Виды химической связи. Ковалентная связь - это связь возникающая между атомами за счет образования общих электронных пар. Электроотрицательность - это способность атомов химических элементов смещать к себе общие электронные пары H->C->S->Br->Cl->N->O->F. Ковалентная неполярная связь образуется между атомами с одинаковыми электроотрицательностями (H2, O2, S, C).ковалентная полярная связь образуется между атомами с разной электроотрицательностью(H2O,H2SO4). Ковалентная связь возникающая между двумя атомами за счет неподеленной пары электронов одного атома (донора) и свободной орбитали другого(акцептора), называется донорно-акцепторный(NH3+,BF4-). Ионная связь- это связь за счет электростатического притяжения между катионами и анионами , в которые превращаются атомы в результате отдачи и присоединения электронов(NaCl, KOH, Li2O).Металлическая связь - это связь в кристаллах металлов и сплавов, которую осуществляют свободные электроны между ионами металлов(Al,Fe,Na). Водородная связь-это связь между атомами водорода одной молекулы и сильноотрицательными элементами(O,N,F) другой молекулы.
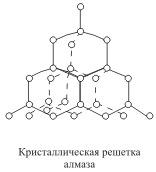
2. Типы кристаллических решеток. Твердые вещества, как правило, имеют кристаллическое строение. Оно характеризуется правильным расположением частиц в строго определенных точках пространства. При мысленном соединении этих точек пересекающимися прямыми линиями образуется пространственный каркас, который называют кристаллической решеткой.
Точки, в которых размещены частицы, называются узлами кристаллической решетки. В узлах воображаемой решетки могут находиться ионы, атомы или молекулы. Они совершают колебательные движения. В зависимости от вида частиц и характера связи между ними различают четыре типа решеток : ионная, молекулярная, атомная, металлическая. Кристаллические решетки, состоящие из ионов, называются ионными. Их образуют вещества с ионной связью. Связи между ионами в таком кристалле весьма прочны. Поэтому вещества с ионной решеткой обладают сравнительно высокой твердостью. Они тугоплавки и малолетучи. Плавление ионных кристаллов приводит к нарушению геометрически правильной ориентации ионов относительно друг друга и уменьшению прочности связи между ними. Поэтому расплавы их проводят электрический ток. Ионные соединения, как правило, легко растворяются в жидкостях, состоящих из полярных молекул, например в воде. Кристаллические решетки, в узлах которых находятся отдельные атомы, называются атомными. Атомы в таких решетках соединены между собой прочными ковалентными связями. Атомная кристаллическая решетка характерна для твердого бора, кремния, германия и соединений некоторых элементов с углеродом и кремнием. Кристаллические решетки, состоящие из молекул (полярных и неполярных), называются молекулярными. Молекулы в таких решетках соединены между собой сравнительно слабыми межмолекулярными силами. Поэтому вещества с молекулярной решеткой имеют малую твердость и низкие температуры плавления, нерастворимы или малорастворимы в воде, их растворы почти не проводят электрический ток. Число неорганических веществ с молекулярной решеткой невелико. Примерами их являются лед, твердый оксид углерода (IV) ("сухой лед"), твердые галогеноводороды, твердые простые вещества, образованные одно- (благородные газы), двух- (F2, Сl2, Br2, I2, Н2, О2, N2), трех- (О3), четырех- (Р4), восьми- (S8) атомными молекулами. рис . Большинство кристаллических органических соединений имеют молекулярную решетку.

Металлическая кристаллическая решетка - это решетка в узлах которой расположены положительнозаряженные ионы (ковкость, электропроводность, теплопроводность, металлический блеск, способность к образованию сплавов).
Лабораторные работы- «не предусмотрено».
Вопросы для самоконтроля по теме:
1. Определить тип связи и кристаллической решетки: LiF, Cl2, Fe, H2S, NaOH, K2O, S, Na2SO4.
2. Составить схемы образования связи: KBr, O2, NH3, H3O+.
3. Вычислить объем кислорода необходимого для сжигания : а) 2 моль угля(С). б) 24 килограммов угля.
4. Вычислить массу железа которое получится при восстановлении 160 граммов Fe2O3 углем.
