
- •Двойственная природа электрона
- •Характеристика энергетического состояния электрона с использованием квантовых чисел.
- •Ковалентная связь.
- •Классификация титриметрического анализа:
- •Расчет рН гидролизующихся солей:
- •2 Тип: это протолитические системы, состоящие из раствора слабого основания и избытка сопряженной с ним кислоты или соли сильной кислоты.
- •Координационная теория Вернера.
- •Номенклатура.
- •Классификация:
- •Химические свойства ia группы.
- •Химические свойства iia группы.
- •Биологическая роль s – элементов, применение в медицине.
- •Общая характеристика viib группы.
- •Биологическая роль viib группы.
- •Общая характеристика iiв группы.
- •Биологическая роль iib группы.
- •Роль галогенов и их соединений.
- •Адсорбция из растворов (молекулярная).
№1, 16 Современные представления о природе электрона. Характеристика энергетического состояния электрона с использованием квантовых чисел. Квантово-механическая модель атома. Электронные и графические формулы для атомов и ионов Типы химических связей. Принцип образования ковалентной химической связи. Метод валентных связей. Природа σ- и π-связей. Понятие о гибридизации атомных орбиталей. Взаимосвязь типа гибридизации и структуры молекул. Межмолекулярные взаимодействия.
Двойственная природа электрона
Подтвержденная экспериментально в 1927 г. двойственная природа электрона, обладающего свойствами не только частицы, но и волны, побудила ученых к созданию новой теории строения атома, учитывающей оба этих свойства. Современная теория строения атома опирается на квантовую механику.
Двойственность свойств электрона проявляется в том, что он, с одной стороны, обладает свойствами частицы (имеет определенную массу покоя), а с другой - его движение напоминает волну и может быть описано определенной амплитудой, длиной волны, частотой колебаний и др. Поэтому нельзя говорить о какой-либо определенной траектории движения электрона - можно лишь судить о той или иной степени вероятности его нахождения в данной точке пространства.
Следовательно, под электронной орбитой следует понимать не определенную линию перемещения электрона, а некоторую часть пространства вокруг ядра, в пределах которого вероятность пребывания электрона наибольшая. Иными словами электронная орбита не характеризует последовательность перемещения электрона от точки к точке, а определяется вероятностью нахождения электрона на определенном расстоянии от ядра.
Характеристика энергетического состояния электрона с использованием квантовых чисел.
Характер движения электрона в атоме определяется четырьмя числами – n, l, m, s, получивших название квантовых.
Главное квантовое число n- это число может принимать любые целочисленные значения: n=1,2,3… Определяет орбитальный радиус и соответствующий главный энергетический уровень.
Орбитальное квантовое число l - это число, которое может принимать целочисленные значения l = n-1.орбитальное квантовое число определяет форму атомной орбитали и орбитальный подуровень энергии главного энергетического уровня атома при данном n.
При l=0, форма орбитали сферическаяи называется s-орбиталью. При l=1 форма орбитали имеет вид песочных часов и называется p-орбиталью.
Магнитное квантовое число m – принимает целочисленные значения ±l. Эти значения определяют ориентацию орбиталей в пространстве, их число на данном орбитальном подуровне и магнитный энергетический подуровень.
Спиновое квантовое число s – принимает два значения: ±1/2. Характеризует собственное вращательное движение.
Орбиталь и соответствующий энергетический уровень, определяемый четырьмя квантовыми числами, называют квантовым состоянием электрона в атоме.
Конфигурацию электронной оболочки атома можно определить путем заполнения квантовых состояний иона на основе принципов или правил заполнения(Паули). При построениии электронной конфигурации удобно любую орбиталь и соответствующий ей уровень изображать с помощью квадрата. Это квантовая ячейка. Принцип минимума энергии: электроны в возбужденном атоме распространяются по квантовым состояниям таким образом, чтобы суммарная энергия атома была минимальна. Принцип Паули: на одной атомной орбитали (в одной квантовой ячейке) не может быть более двух электронов.
П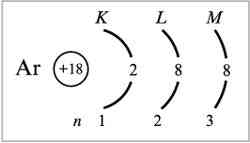
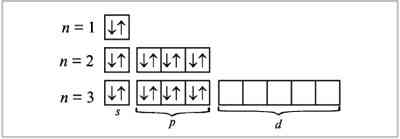 равило
Гунда: при наличии нескольких пустых
или на половину заполненных ячеек
данного подуровня электроны занимают
максимально возможное число пустых
ячеек.
равило
Гунда: при наличии нескольких пустых
или на половину заполненных ячеек
данного подуровня электроны занимают
максимально возможное число пустых
ячеек.
Распределение электронов
по квантовым уровням и подуровням
х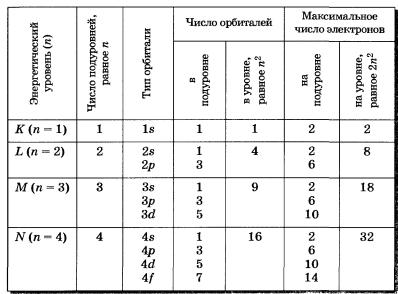 имической
связью называют совокупность
взаимодействий между электронами и
ядрами, приводящих к соединению атомов
в молекулу.
имической
связью называют совокупность
взаимодействий между электронами и
ядрами, приводящих к соединению атомов
в молекулу.
Ионная связь — прочная химическая связь, образующаяся между атомами с большой разностью (>1,7 по шкале Полинга) электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью.Это притяжение ионов как разноименно заряженных тел. Примером может служить соединение CsF. Между ионами Na+ и Cl- возникают силы электростатического притяжения, в результате чего образуется соединение. Ионная связь — крайний случай поляризации ковалентной полярной связи. Образуется между типичными металлом и неметаллом. При этом электроны у металла полностью переходят к неметаллу. Образуются ионы.
![]()
