
- •1.1 Атомно-молекулярное учение химии. Понятия – атом, молекула, относительная молекулярная масса, относительная атомная масса, молярная масса. Моль – мера количества вещества.
- •1.2 Эквивалент. Молярная масса эквивалента. Закон эквивалентных отношений. Закон кратных отношений.
- •1.4 Законы термохимии. Закон Гесса – как частный случай закона сохранения энергии. Следствие из закона Гесса (энтальпия сгорания, образования). Стандартные условия.
- •1.6 Скорость химических реакций. Основной закон химической кинетики – закон действующих масс. Порядок и молекулярность реакции. Правило Ван-Гоффа. Кинетические уравнения.
- •1.7 Зависимость скорости реакции от температуры. Энергия активации. Уравнение Аррениуса.
- •1.8 Катализ. Гомогенный, гетерогенный, ферментативный. Особенности отдельных типов катализа. Примеры.
- •1.9 Химическое равновесие. Константа равновесия. Влияние температуры, концентрации реагентов, давления и катализатора на смещение равновесия.
- •1.10 Химическое равновесие. Принцип Ле-Шателье-Брауна. Характер смещения равновесия в зависимости от типа реакции (экзо- , эндотермические); реакции идущие с изменением объема.
- •1.13 Идеальный раствор. Законы Рауля. Понижение давления насыщенного пара, понижение температуры замерзания, повышение температуры кипения растворов неэлектролитов.
- •1.14 Явление осмоса. Осмотическое давление. Закон Вант-Гоффа применительно к растворам неэлектролитов. Роль осмотического давления в биологических системах.
- •1.17 Слабые электролиты. Степень и константа диссоциации. Взаимосвязь константы и степени диссоциации (закон разбавления Освальда)
- •1.19 Диссоциация воды. Ионное произведение воды. Водородный показатель рН.
- •1.20 Гидролиз солей. Константа и степень гидролиза. Факторы смещения равновесия гидролиза. Необратимый гидродиз.
- •1.32 Комплексные соединения. Особенности структуры комплексных соединений. Номенклатура, координатное число, изомерия. Циклические комплексные соединения.
- •1.25 Строение атома и периодический закон. Периодичность изменения свойств s-, p- и d элементов.
- •1.26 Периодический закон. Свойства атомов: атомный радиус, ионизационный потенциал и сродство к электрону. Относительная электроотрицательность элементов. Металлы и неметаллы, их положение в таблице.
- •1.27 Метод валентных связей. Насыщаемость связи. Направленность связей. Определение валентности по методу валентных связей.
- •1.28 Метод молекулярных орбиталей. Связывающие, разрыхляющие, не связывающие молекулярные орбитали. Порядок связи.
- •1.29 Ковалентная связь. Полярность ковалентной связи. Дипольный момент. Одинарные, двойные и тройные связи.
- •1.30 Межмолекулярное взаимодействие. Ориентационное, индукционное и дисперсное взаимодействие. Водородная связь. Биологическая роль водородной связи и межмолекулярного взаимодействия.
- •1.31 Ионная связь. Степень ионности. Донорно-акцепторный механизм образования ковалентной связи. Металлическая связь.
- •1.3 Основные представления об энергетике химических процессов, функции состояния: внутренняя энергия, энтальпия, энтропия.
- •1.4 Свободная энергия Гиббса. Направление течения процесса. Анализ уравнения энергии Гиббса. Влияние энталальпийного и энтропийного факторов на направление протекания процессов.
- •1.11 Дисперсные системы. Растворы, растворимость. Факторы влияющие на растворимость. Способы выражения концентрации растворов (молярная и мольная концентрации эквивалента, молярная и массовая доли).
- •1.34 Сильные электролиты. Активность. Ионная сила растворов.
- •1.37 Окислительно-восстановительные реакции и окислительно-восстановительные потенциалы. Окислительно-восстановительные реакции, электрохимические явления в биологиических и технологических процессах.
- •2.4 Элементы подгруппы III.А. Электронная конфигурация. Изменение радиуса атома и энергии ионизации. Степени окисления. Аллюминий. Свойства. Характеристика оксидов, гидрооксидов, солей. Амфотерность.
- •2.11 Элементы подгруппы V.А. Электронная конфигурация. Изменение радиуса атома и энергии ионизации. Степени окисления. Фосфор. Свойства. Фосфин. Применение в с/х, биологическая роль.
- •2.19 Элементы подгруппы VI.А. Электронная конфигурация. Изменение радиуса атома и энергии ионизации. Степени окисления. Сера. Свойства. Оксиды серы. Свойства. Применение в с/х.
1.1 Атомно-молекулярное учение химии. Понятия – атом, молекула, относительная молекулярная масса, относительная атомная масса, молярная масса. Моль – мера количества вещества.
Основные
положения сформулированы Ломоносовым
в виде капсулярной теории строения
вещества, согласно которой все вещества
состоят из мельчайших частиц капсул
(молекул) имеющих тот же состав, что и
все вещество, и находящиеся в непрерывном
движении. Химические элементы – химически
неделимые составные части простых и
сложных веществ. Химический
элемент
– это вид атомов с одинаковым положительным
зарядом ядра. Атом
– наименьшая частица химического
элемента, являющаяся носителем его
свойств. Атом электронейтральная
микросистема, подчиняющаяся законам
квантовой физики и состоящая из
положительно заряженного ядра и
отрицательно заряженных электронов.
Молекула
– наименьшая частица вещества,
определяющая его свойства и способная
к самостоятельному существованию. Атомы
объединяются в молекулу с помощью
химических связей, в образовании которых
принимают участие в основном внешние
(валентные) электроны. Относительная
атомная масcа (Ar)
– безразмерная величина, равная отношению
средней массы атомов к 1/12 массы изотопа
атома углерода 12С.
Относительная
молекулярная масса (Mr)
- безразмерная величина, равная отношению
средней массы молекулы вещества к 1/12
массы изотопа атома углерода 12С.
Моль
(![]() )
– масса одного моля вещества. Моль =
количеству вещества, содержащего столько
же структурных единиц, сколько содержится
в 12г изотопа атома углевода 12С.
Моль любого вещества содержит одинаковае
число частиц 6,02*1023.
Молярная
масса –
масса одного моля вещества Молярная
масса – отношение массы (m) к количеству
вещества (
)
– масса одного моля вещества. Моль =
количеству вещества, содержащего столько
же структурных единиц, сколько содержится
в 12г изотопа атома углевода 12С.
Моль любого вещества содержит одинаковае
число частиц 6,02*1023.
Молярная
масса –
масса одного моля вещества Молярная
масса – отношение массы (m) к количеству
вещества (![]() )
)
![]()
1.2 Эквивалент. Молярная масса эквивалента. Закон эквивалентных отношений. Закон кратных отношений.
Эквивалент
– реальная или условная частица, которая
может присоединять, высвобождать или
быть каким-либо другим образом эквивалентна
одному иону водорода в кислотно-основных
реакциях или одному электрону в
окислительно-восстановительных реакциях.
Фактор
эквивалентности
![]() ,
где
z валентность в простых соединениях и
степень окисления в сложных. Молярная
масса эквивалента
– масса одного моля эквивалента вещества.
,
где
z валентность в простых соединениях и
степень окисления в сложных. Молярная
масса эквивалента
– масса одного моля эквивалента вещества.
![]() ,
где
,
где
![]() молярная
масса эквивалента,
молярная
масса эквивалента,
![]() фактор
эквивалентности, М – молярная масса
атома элемента.
фактор
эквивалентности, М – молярная масса
атома элемента.
Закон
эквивалентных отношений.
Массы веществ, реагирующих без остатка,
относятся друг к другу как молярные
массы их эквивалентов.
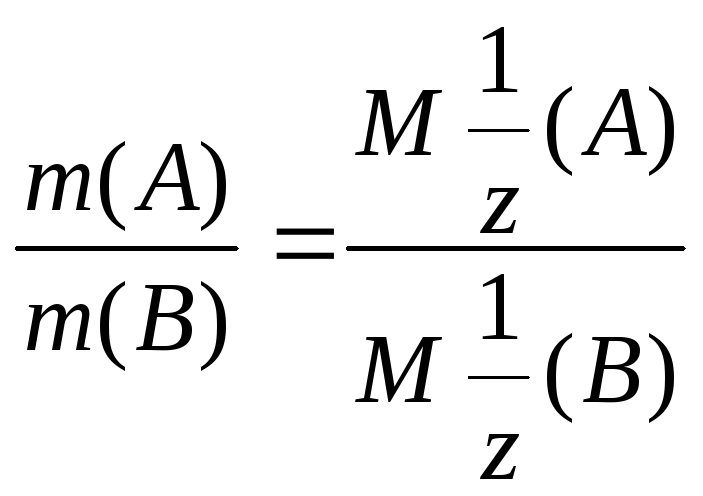 ,
где
,
где
![]() молярные
массы эквивалентов, m – массы
взаимодействующих веществ.
молярные
массы эквивалентов, m – массы
взаимодействующих веществ.
Закон кратных отношений. Если 2 вещества образуют друг с другом более одного соединения молекулярного состава, то массы одного вещества, приходящиеся на одну и ту же массу другого вещества в этих соединениях, относятся между собой как небольшие целые числа.
1.4 Законы термохимии. Закон Гесса – как частный случай закона сохранения энергии. Следствие из закона Гесса (энтальпия сгорания, образования). Стандартные условия.
К
основным законам термохимии относятся
законы Лувуазье-Лапласа и Гесса. Закон
Лавуазье-Лапласа. Тепло,
необходимое для разложения химического
соединения, = теплоте его образования.
Закон Гесса. Тепловой
эффект химической реакции, протекающей
при постоянном давлении или объеме, не
зависит от пути реакции, а определяется
лишь начальным и конечным состояниями
системы. 1 следствие.
Тепловой эффект образования 1 моль
соединения из данных исходных соединений
при заданных давлении и температуре не
зависит от способа его получения. Ст.
энтальпией образования веществ называется
кол-во теплоты, которое выделяется или
поглощается при образовании 1 моль
соединения из простых веществ при
стандартных условиях (Т=298К, р=101,325кПа).
2 следствие. Изменение
энтальпии хим. реакции = разности между
суммой энтальпий образования продуктов
реакции и суммой энтальпий образования
исходных веществ.
![]()
Энтропия. (S, дж./моль К) функция состояния системы, являющаяся термодинамической мерой ее неупорядоченности. В изолированной системе самопроизвольные процессы могут протекать только в направлении увеличения энтропии
![]()
энергия
Гиббса.
Функция состояния системы = макс. ее
работе в изобарном изотермическом
процессе. Для процессов при постоянных
температуре и давлении
![]()
Для
![]() ,
как функции состояния
,
как функции состояния
![]()
