
- •Ферменты
- •А. Ферментативная активность
- •Б. Реакционная и субстратная специфичность
- •В. Классы ферментов
- •Механизмы действия ферментов.
- •А. Типы ингибирования
- •Аллостерические эффекторы
- •Регуляция путем ассоциации-диссоциации субъединиц в олигомерном ферменте.
- •Активация ферментов путем частичного протеолиза.
Ферменты
Ферменты, или энзимы, представляют собой высокоспециализированный класс веществ белковой природы, используемый живыми организмами для осуществления взаимосвязанных химических реакций.
Ферменты являются биокатализаторами, т.е. веществами биологического происхождения, ускоряющими химические реакции. Организованная последовательность процессов обмена веществ возможна при условии, что каждая клетка обеспечена собственным генетически заданным набором ферментов. Только при этом условии осуществляется согласованная последовательность реакции (метаболический путь). Ферменты принимают участие также в регуляции многих метаболических процессов, обеспечивая тем самым соответствие обмена веществ измененным условиям. Почти все ферменты являются белками. Известны также каталитически активные нуклеиновые кислоты — «рибозимы».
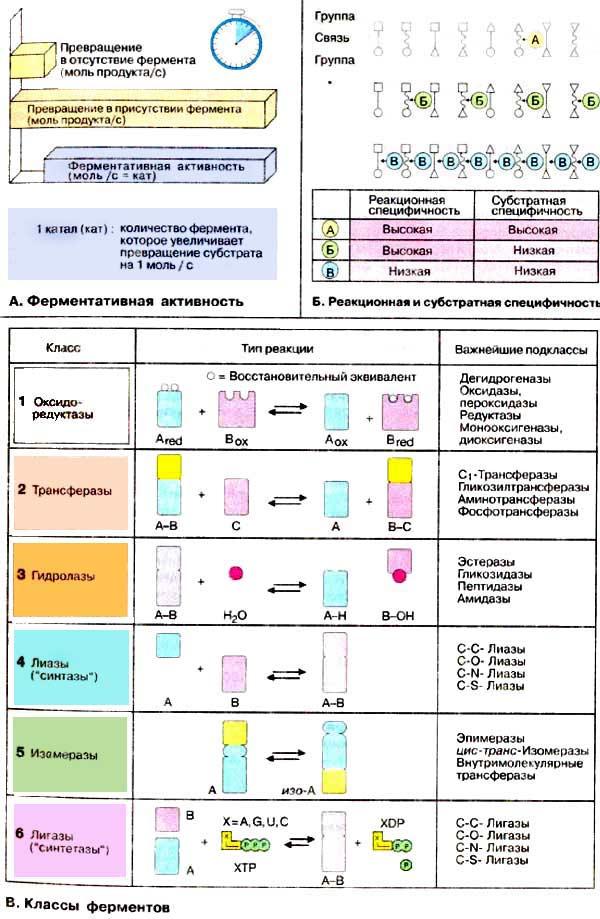
А. Ферментативная активность
Каталитическое действие фермента, т. е. его активность, определяют в стандартных условиях по увеличению скорости (фиолетовый цвет на схеме) каталитической реакции (оранжевый цвет) по сравнению с некаталитической (желтый цвет). Обычно скорость реакции указывают как изменение концентрации субстрата или продукта за единицу времени (моль/(л·с)). Так как каталитическая активность не зависит от объема раствора, в котором протекает реакция, активность фермента выражают в каталах; 1 кат — это количество фермента, которое превращает 1 моль субстрата за 1 с. Другой единицей активности является международная единица (E) — количество фермента, превращающего 1 мкмоль субстрата в 1 мин (1 E = 16,7 нкат).
Б. Реакционная и субстратная специфичность
Действие большинства ферментов высоко специфично. Понятие специфичности относится не только к типам каталитических реакций (реакционная специфичность), но и к природе соединений - субстратов (субстратная специфичность). В качестве примера на схеме приведены ферменты, расщепляющие химическую связь. Высокоспецифичные ферменты (тип А — верхняя строка таблицы) катализируют расщепление только одного типа связи в субстратах определенной структуры. Ферменты типа Б (средняя строка) обладают ограниченной реакционной специфичностью, но широкой субстратной специфичностью. Ферменты типа В (с низкой реакционной и низкой субстратной специфичностями; нижняя строка) встречаются редко.
В. Классы ферментов
На сегодняшний день известно примерно 2000 различных ферментов. Разработанная система классификации учитывает реакционную и субстратную специфичности ферментов. Все ферменты включены в «Каталог ферментов» под своим классификационным номером (КФ), состоящим из четырех цифр. Первая цифра указывает на принадлежность к одному из шести главных классов. Следующие две определяют подкласс и подподкласс, а последняя цифра — номер фермента в данном подподклассе. Например, лактатдегидрогеназа имеет номер КФ 1.1.1.27 (класс 1, оксидоредуктазы; подкласс 1.1, донор электрона — СН-ОН; подподкласс 1.1.1, акцептор — НАДФ+.)
В каждом из шести главных классов объединены ферменты, обладающие одинаковой реакционной специфичностью. Оксидоредуктазы (класс 1) катализируют окислительно-восстановительные реакции. Трансферазы (класс 2) переносят ту или иную функциональную группу от одного субстрата на другой. Для оксидоредуктаз и трансфераз необходим общий кофермент. Гидролазы (класс 3) также участвуют в переносе групп, однако акцептором здесь всегда является молекула воды. Лиазы (класс 4, называемые иногда «синтазами») катализируют расщепление или образование химических соединений, при этом образуются или исчезают двойные связи. Изомеразы (класс 5) перемещают группы в пределах молекулы без изменение общей формулы субстрата. Лигазы («синтазы», класс 6) катализируют энергозависимые реакции присоединения и поэтому их действие Сопряжено с гидролизом нуклеозидтрифосфата (чаще всего АТФ).
Как правило, кроме названия фермента принято указывать его классификационный номер. В списке ферментов, приведенном в конце книги, все ферменты приведены с классификационными номерами.
Функции ферментов сводятся к ускорению химических реакций, причем ферменты отличаются от других катализаторов тремя уникальными свойствами:
высокой эффективностью действия;
специфичностью действия;
способностью к регуляции;
|
Класс |
Тип катализируемой реакции |
|
Оксидоредуктазы |
ОВ реакции. |
|
Трансферазы |
Перенос отдельных групп атомов от донорной молекулы к акцепторной молекуле. |
|
Гидролазы |
Гидролитическое (с участием воды) расщепление связей. |
|
Лиазы |
Расщепление связей способом, отличным от гидролиза или окисления. |
|
Изомеразы |
Взаимопревращение различных изомеров. |
|
Лигазы (синтетазы) |
Образование связей в реакции конденсации двух различных соединений (используется энергия АТР). |
В живой клетке множество разнообразных соединений, но реакции между ними не беспорядочны, а образуют строго определенные метаболические пути, характерные для данной клетки. Индивидуальность клетки в большой степени определяется уникальным набором ферментов, который она генетически запрограммирована производить. Отсутствие даже одного фермента или какой-нибудь его дефект могут иметь очень серьезные отрицательные последствия для организма.
Все ферменты относятся к глобулярным белкам, причем каждый фермент выполняет специфическую функцию, связанную с присущей ему глобулярной структурой. Однако активность многих ферментов зависит от небелковых соединений, называемых кофакторами. Молекулярный комплекс белковой части (апофермента) и кофактора называется холоферментом. Роль кофактора могут выполнять ионы металлов (Zn2+, Mg2+, Mn2+, Fe2+, Cu2+, K+, Na+) или сложные органические соединения. Органические кофакторы обычно называют коферментами, некоторые из них являются производными витаминов. Тип связи между ферментом и коферментом может быть различным. Иногда они существуют отдельно и связываются друг с другом во время протекания реакции. В других случаях кофактор и фермент связаны постоянно и иногда прочными ковалентными связями. В последнем случае небелковая часть фермента называется простетической группой.
Роль кофактора в основном сводится к следующему:
изменение третичной структуры белка и создание комплементарности между ферментом и субстратом;
непосредственное участие в реакции в качестве еще одного субстрата.
В этой роли обычно выступают органические коферменты. Их участие в реакции иногда сводится к тому, что они выступают как доноры или акцепторы определенных химических групп.
