
Preparaty_-_proizvodnye_tsiklopentanpergidrofenantrena__1
.pdf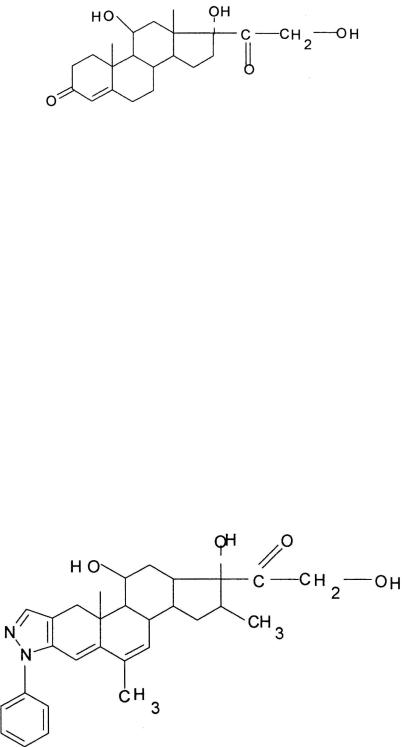
R - С2Н5, |
4 = норгестрел |
R - СН3, |
4, 3-дезоксо = линоэстренол |
|
3.3. Кортикостероиды |
Гидрокортизон
Для поизводных гидрокортизона характерно:
–для проявления глюкокортикоидной активности необходимо наличие в 17α- и 11β-положениях гидроксильных групп;
–у 11-эпипроизводных кортикостероидов резко снижена глюкокортикоидная активность;
–наличие в 9α-положении атома фтора увеличивает глюкокортикоидную активность в 10 раз;
–синтетические аналоги глюкокортикоидов, характеризующиеся высокой физиологической активностью, имеют дополнительную двойную
связь в C1,2-положении (преднизолон), атом фтора в 9α-, a иногда 6αположении и заместитель (метил-, гидроксил- и др.) в С16-положении (дексаметазон, бетаметазон, триамцинолон и др.);
–изменение субдоминантной группы гидрокортизона ацетата, а именно конденсация кольца А в положение 2,3 с фенил-пиразолом, приводит к получению высокоэффективного препарата – кортивазола или его деацилированного производного, обладающего мощным противовоспалительным действием и высоким сродством к специфическим рецепторам (в 40 раз выше чем у дексаметазона).
Структурная формула синтетического глюкокортикоида – кортивазола
11

–16α,17α-диоксикортикостероиды используют в форме циклических кеталей, образующихся в результате взаимодействия с ацетоном или другими кетонами (флюоцинолона ацетонид, триамцинолона ацетонид, будесонид); данная модификация приводит к снижению всасываемости препаратов, которые применяются местно в виде мазей или кремов;
–как природные, так и синтетические кортикостероиды часто применяют в виде сложных эфиров, в основном по С21-гидроксигруппе, а иногда
ипо С17- и С16-гидроксигруппам; особенно важны водорастворимые натриевые соли их 21-фосфатов (дексаметазона натрия фосфат) и 21-сукци- натов (преднизолона гемисукцинат);
–водорастворимые формы глюкокортикоидов можно получить замещением 21-гидроксигруппы на аминопроизводные, например N-метил-N’- пиперазинил-преднизолона гидрохлорид;
–для некоторых глюкокортикоидов (гидрокортизон, преднизолон, дексаметазон) исследуется возможность использования в форме водорастворимых полимерных производных с целью коррекции их фармакологических и токсических эффектов. Известны полимерные производные гидрокортизона и преднизолона на основе образования полиэфиров в результате реакции ацелирования с сополимером поливинилпирролидона и малеинового ангидрида;
–комплекс флюоцинолона ацетонида с Р-циклодекстрином является основой мази «Синафлан-ЦД», подобная модификация молекулы приводит
кповышению фармакологической активности в 1,5–2 раза по сравнению с прототипом.
3.4.Эстрогены
Эстрадиол
Для производных эстрадиола характерно:
12
–для проявления эстрогенной активности необходимо наличие ароматического кольца А и свободной 3β-гидроксигруппы;
–у эстрона (17-кетопроизводное) биологическая активность в 5–15 раз ниже эстрадиола;
–у 17-эпипроизводного эстрадиола (α-эстрадиол) эстрогенная активность снижена в 20 раз;
–наличие в 16α-положении эстрадиола гидроксильной группы снижает его эстрогенное действие, а введение 16β-гидроксигруппы приводит к полной потере биологической активности; 16-гидроксиэстрадиол («Овестин») применяется для лечения состояний и симптомов, связанных с дефицитом эстрогенов (хирургическая или естественная менопауза);
–введение в 17α-положение эстрадиола этинильного радикала приводит к усилению эстрогенной активности и устойчивости при пероральном применении (этинилэстрадиол); этинилэстрадиол и его 3-метоксипроиз- водное – местранол – являются эстрогенными составляющими всех пероральных контрацептивных препаратов;
–11-арилпроизводные этинилэстрадиола обладают антигестагенной активностью (абортирующие контрацептивные препараты – «Мефипристон», «Пенткрофтан»).
4.СПОСОБЫ ПОЛУЧЕНИЯ СТЕРОИДНЫХ ГОРМОНОВ
4.1. Химический синтез стероидных гормонов
Исследования в области полного химического синтеза стероидов начались в 1932 году после установления структуры холестерина. За короткий период так называемой «стероидной лихорадки» с 1932 по 1960 гг. были синтезированы практически все природные стероидные гормоны – эстрон (Мишер, 1948 г.), андростерон, холестерин, кортизол (группы Робинсона и Вудворда, 1951 г.). Полный синтез стероидов позволил полностью подтвердить их химическую структуру, а также явился мощным толчком развития органического синтеза вообще. С 60-х годов исследователи стали стремиться к разработке полного синтеза гормонов, пригодного для осуществления малостадийного, стереоспецифического промышленного синтеза. Впервые данная задача была решена для синтеза эстрона из дешевого сырья – перолина – за 8 химических стадий с выходом 27 %.
Основные трудности полного синтеза стероидов заключаются:
– в наличии 4 углеродных циклов, конденсированных в о-положе-
ниях;
13
–в обеспечении пространственного строения синтезируемой молеку-
лы (холестерин содержит 8 асимметрических атомов углерода, что делает возможным существование 28 = 256 стереоизомеров);
–в разработке стереонаправленных процессов, позволяющих на каждой стадии синтеза получать нужные стереоизомеры.
В настоящее время полный химический синтез стероидов, как правило, не имеет практического значения. Для получения лекарственных препаратов стероидных гормонов используют полусинтез из природных (растительных и животных) стеринов с применением методов химической и микробиологической трансформации молекулы.
Основные реакции, используемые в синтезе стероидных гормонов и их полусинтетических производных, будут рассмотрены на примере синтеза эстрогенных гормонов и кортикостероидов.
Промышленный синтез эстрона основан на гидрировании 2-метокси- нафталина до тетралина, окислением которого хромовой кислотой до тетралона и обработкой винилмагнийбромидом получают спирт.
2-Метилциклопентандион-1,3 как СН-кислота легко присоединяется по винильной группе спирта, образуя после дегидратации щелочью соединение, которое далее подвергают кислотнокатализируемой циклизации с отщеплением одной молекулы воды. В результате возникает конденсиро-
ванный четырехъядерный остов молекулы. Гидрированием (H2/Pd) олефиновой связи с последующим гидролизом метоксильной группы получают эстрон.
Из эстрона присоединением ацетилена синтезируют этинилэстрадиол
иместранол. Введение метальных и этинильных групп в 17α-положение может осуществляться другими методами:
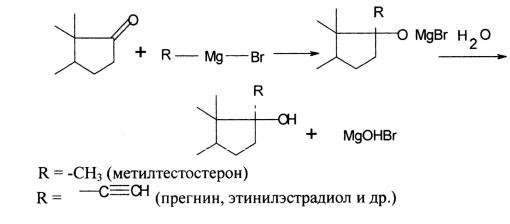
–с помощью магнийорганических реактивов Гриньяра по схеме:
14
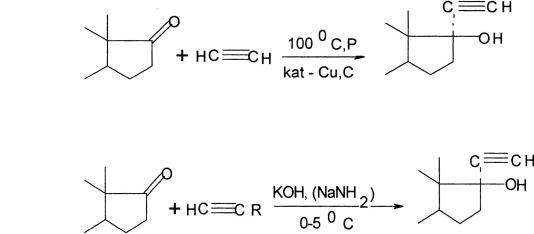
–синтез Реппе:
–синтез Фаворского:
Кортикостероидные гормоны – гидрокортизон, кортизона ацетат и др. – получают из природных соединений – холестерина или стероидных сапонинов (диосгенин, тигогенин) и стероидных алкалоидов (саласодин).
Сначала холестерин окислительным отщеплением боковой алкильной группы при С17 хромовым ангидридом (после предварительной защиты гидроксильных и -С=С- групп соответственно ацилированием и бромированием) переводят в дибромкетон. Этот кетон дебромируют действием цинка и получают ацетат дегидроэпиандростерона, в котором кольцо D химически модифицируют. После цианирования и дегидратации получают цианопроизводное, обработка которого метилмагнийбромидом дает промежуточный имин, легко гидролизуемый добавлением водой, что позволяет преобразовать цианогруппу в ацетильную и снять ацетильную защиту с ОН-группы
при С3.
Спиртовую группу в кольце А оксирана превращают в оксогруппу по Оппенауэру. Реакция идет в присутствии изопропилата алюминия и циклогексанона (акцептор водорода) и сопровождается изомеризацией двойной связи из кольца В в кольцо А, что приводит к сопряженному енону.
Трансформацию 5-3β-окси-стероидов в 4-3-кетоны можно осуществить и другими методами:
– в реакции Веттштайна, разновидности реакции Оппенауэра, вместо циклогексанона используется бензохинон, что приводит к образованию 4,6- 3-кетопроизводных;
–реакция Пфицнера – Маффета проводится в более мягких условиях
вприсутствии дициклокарбодиимида в растворе ДМСО при температуре
20 °С.
На следующей стадии оксирановое кольцо в соединении расщепляют действием НВr. Полученное производное дебромируют до третичного спирта, который окисляют до кетодиола – кортексолона.
15
Решающей стадией синтеза кортикостероидных гормонов является селективное биогидроксилирование кортексолона по С11 с использованием культуры бактерий Rhizopus nigricans. Полученный триол окисляют до гидрокортизона, который ацетилируют с образованием эфира.
Введение ацилированных α-кетольных групп в 17β-положение глюкокортикоидов может осуществляться и в условиях реакции Арндта – Айстерта разложением диазокетонов:
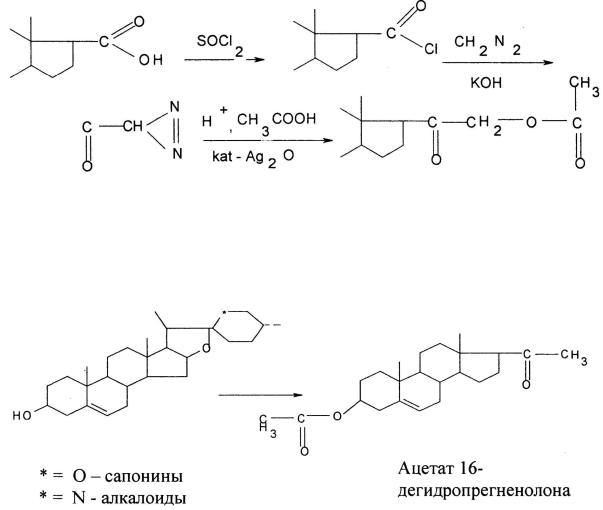
Химическая трансформация основных сырьевых полупродуктов в синтезе кортикостероидов и гестагенов – стероидных сапонинов и стероидных алкалоидов – проводится в три стадии с получением ацетата 16-деги- дропрегненолона, который является основой для синтеза всех кортикостероидов.
Схема получения ацетата 16-дегидропрегненолона
4.2. Микробиологическая трансформация стероидов
Первые сообщения о трансформации стероидов микроорганизмами появились задолго до того, как было выяснено строение стероидов. Еще в конце прошлого столетия было установлено, что бактериальная флора кишечника млекопитающих способна превращать холестерин в копростерин, а холевую кислоту – в дезоксихолевую.
16
В1908 году была обнаружена способность бактерий Escherichia coli окислять гидроксильные группы холевой кислоты. В 1937 году было открыто восстановление дрожжами 17-кетогрупп и осуществлено превращение эстрона в эстрадиол. В 1952 году получено 11α-оксипроизводное прогестерона при его ферментации с плесенью Rhizopus nigricans.
Врезультате исследований с 1934 по 1954 годы химия стероидов получила новый, чрезвычайно эффективный метод синтеза, отличающийся высокой специфичностью и приводящий во многих случаях к высоким выходам таких соединений, которые трудно получить химическим путем. За этот период открыто около 100 реакций трансформации стероидов с участием около 60 видов микроорганизмов. За последние годы исследований в этом направлении число реакций увеличилось в 60 раз, а число используемых для этих целей микроорганизмов – в 18 раз.
Сиспользованием микроорганизмов можно осуществлять следующие типы превращений:
–образование и расщепление углеродных связей;
–образование и восстановление двойных углеродных связей;
–изомеризация двойных углеродных связей;
–гидроксилирование и дегидратации;
–образование и раскрытие α-окисей;
–гидролиз и этерификация;
–образование и восстановление кетогрупп;
–образование и разрушение связей галоген-углерод;
–образование и разрушение связей азот-углерод;
–образование и разрушение связей сера-углерод;
–расщепление рацематов стероидов, полученных химическим синте-
зом.
Вкачестве сырья для промышленных процессов трансформации стероидов используются природные стерины, выделенные из растительных источников (стероидные сапонины и алкалоиды) и различных органов животных (ситостерины, холестерин и др.). Микробиологический синтез всегда сочетается с химическими превращениями молекулы стероидов.
Первоначально реакции микробиологической трансформации стероидов проводились с помощью неиммобилизованных клеток микроорганизмов в двухфазных водно-органических системах. Клетки при этом локализовались в водной фазе, а стероидные соединения – в органической. Кроме того, микроорганизмы подвергались губительному воздействию органического растворителя. Данный метод имел низкую эффективность и требовал постоянного возобновления трансформирующей культуры клеток микроорганизмов после каждого производственного цикла. Поэтому для трансформации стероидных гормонов в 1970 г. был впервые применен метод прове-
17
дения реакций с использованием иммобилизованных клеток микроорганизмов.
Иммобилизация клеток микроорганизмов осуществлялась путем включения их в различные гели (полиакриламидные гели, гели альгината, каррагинана, агара) или мембраны различных полимеров, а также адсорбции на целлюлозе, керамике, ионитах, силикагеле и др., а также путем ковалентного связывания с силикагелем. Иммобилизованные клетки микроорганизмов, находящиеся внутри гранул носителя в водной фазе, мало подвержены воздействию органических растворителей, не смешивающихся с водой. Например, в качестве катализатора реакции дегидрирования стероидов в среде бензола и гептана используются различные виды бактерий Nocardia sp., включенные в гидрофобные гели (уретановые полимеры). Они обладают высокой активностью и стабильностью, чем бактерии, находящиеся в гидрофильном окружении.
Использование иммобилизованных клеток микроорганизмов имеет множество преимуществ и перед иммобилизованными ферментами. Хорошо известно, что некоторые стероидтрансформирующие ферменты, особенно гидролазы и дегидрогеназы, являются весьма лабильными белками, их выделение и очистка затруднены, а закрепленные на нерастворимых материалах клетки микроорганизмов служат постоянным носителем активных стабильных полиферментных систем.
Основные реакции микробиологической трансформации стероидных соединений, используемые в промышленном синтезе стероидных гормонов, приведены в табл. 1.
Таблица 1
Микробиологическая трансформация стероидов, имеющая промышленное значение
Реакция |
Субстрат |
Продукт |
Микроорганизм |
|
11α- |
Прогестерон |
11α-гидроксипрогестерон |
Rhizopus |
|
гидроксилирование |
nigricans |
|||
|
|
|
|
|
11β- |
Вещества S |
Гидрокортизон |
Curvularia lunata |
|
гидроксилирование |
||||
16α- |
9α- |
9α-фтор-16α- |
Streptomyces |
|
гидроксилирование |
фторкортизол |
гидроксикортизон |
roseochromogenus |
|
|
|
|
|
|
1,2-дигидрирование |
Гидрокортизон |
Преднизолон |
Arthrobacter |
|
simplex |
||||
|
|
|
||
Расщепление |
β-Ситостерин |
Андростадиендиол |
Mycobacterium |
|
боковой цепи |
Андростендион |
sp. |
||
|
||||
|
|
|
|
Одной из важных реакций микробиологического синтеза стероидных гормонов является трансформация природных 5-3-оксисоединений (холе-
18
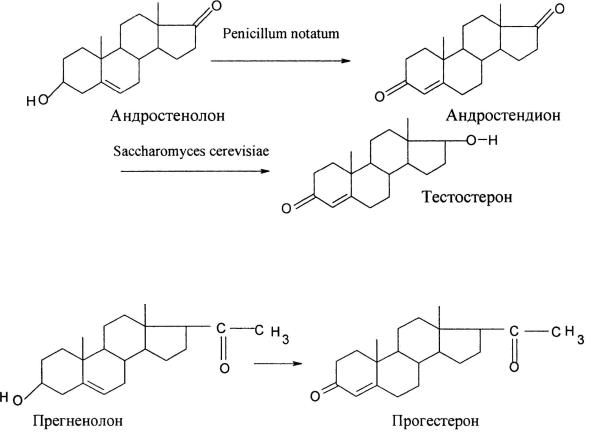
стерин, диосгенин, саласодин и др.) в 4-3-кетопроизводные, поскольку наличие 4-3-кетогруппы необходимо для проявления гормональной активности андрогенов, гестагенов и кортикостероидов. Так, например, тестостерон можно получить в две микробиологические стадии с выходом около 80 % по схеме:
Синтез гестагенов проводят путем превращения прегненолона в прогестерон в одну стадию со 100 % выходом основного продукта реакции, поэтому преимущество микробиологического процесса трансформации молекулы перед химическими методами (по Оппенауэру и др.) очевидно:
Молекулы кортикостероидов и их синтетических аналогов содержат несколько гидроксильных групп. Их введение химическими методами хорошо разработано лишь для гидроксигрупп, находящихся по соседству с -С=О или –С=С-группами. Но если вводимая гидроксигруппа не имеет такого окружения, то все химические методы становятся неэффективными. Это относится, прежде всего, к 11β- и 11α-гидроксигруппам. В современном производстве глюкокортикоидов введение данных групп проводят только с помощью микробиологической трансформации кортексолона, используя гидроксилирующие культуры – Rhizopus nigricans, Curvularia lunata, Tieghemella orchldis, Cunninghamella blakesleana, Trichothecium roseum и др.
19
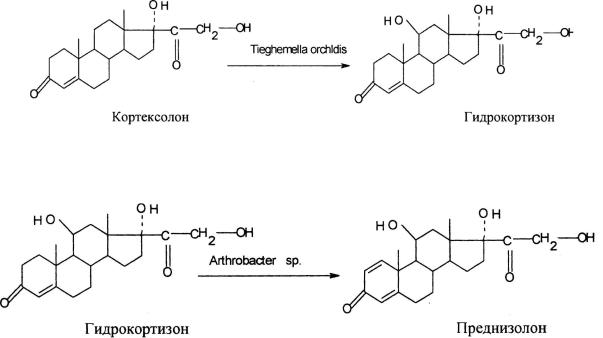
Другой важной реакцией в синтезе физиологически активных анаболиков (метандростенолон) и кортикостероидов (преднизолон, дексаметазон и др.) является реакция микробиологического 1-дегидрирования.
В настоящее время разработаны различные способы интенсификации микробиологической трансформации стероидных гормонов:
– предварительное индуцирование растущей культуры-трансформа- тора соответствующим субстратом или его аналогом;
–использование нерастворимых микрокристаллических стероидных субстратов, полученных путем диспергирования и измельчения субстрата, а также превращением его в водорастворимое состояние с помощью β- циклодекстринов.
5. КОНТРОЛЬ КАЧЕСТВА СТЕРОИДНЫХ ГОРМОНОВ
Основные тенденции в современном фармакопейном анализе препаратов стероидных гормонов и их синтетических аналогов заключаются в повышении требований к избирательности метода. Возможности использования для этого новых химических реакций, селективных с классической точки зрения, практически исчерпаны. Новые перспективы открываются с использованием спектральных и хроматографических методов. При разработке избирательных методов анализа стероидных гормонов, пригодных для фармацевтического анализа, во внимание принимаются их чувствительность и продолжительность. При контроле субстанций стероидных гормонов эти требования не очень высоки, поэтому чаще всего используются методы спектрофотометрии в УФ- и видимой области спектра. Но в некоторых случаях, например, при анализе эстрогенов и гестагенов в контрацептивных препаратах, фторкортикостероидов в мазях, а также следовых
20
