
Preparaty_-_proizvodnye_tsiklopentanpergidrofenantrena__1
.pdf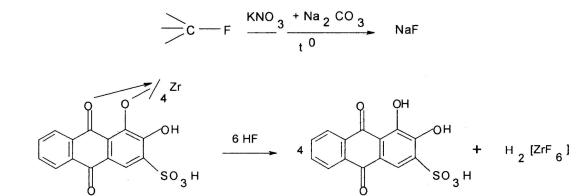
ализаринат циркония |
ализариновый красный |
красно-фиолетовый цвет |
желтый цвет |
Для идентификации флюоцинолона ацетонида ЕФ рекомендует использовать реакцию с хромовой смесью (раствор бихромата калия в концентрированной серной кислоте). При нагревании реакционной смеси на пламени горелки выделяются белые пары и стекло пробирки над жидкостью становится матовым. Реакция основана на образовании в результате минерализации препарата фтороводородной кислоты (HF), которая растворяет стекло.
17β-спиртовый гидроксил (метилтестостерон, метандриол) обнаруживают по реакции этерификации с уксусным ангидридом в присутствии безводного пиридина. Измеряют температуру плавления образующихся сложных эфиров (tпл метилтестостерона ацетата = 173–176 °С, tпл метандриола ацетата = 174–180 °С).
Лекарственные вещества, содержащие сложноэфирную группу (кортизона ацетат, дезоксикортона ацетат, эстрадиола дипропионат, тестостерона пропионат и др.), с гидроксиламином в щелочной среде образуют гидроксамовую кислоту, которая при добавлении раствора хлорида железа (III) окрашивается в вишнево-красный цвет.
Препараты, представляющие собой сложные эфиры, можно идентифицировать по продуктам щелочного гидролиза. Так, tпл тестостерона, полученного в результате гидролиза тестостерона пропионата, составляет 150–153 °С, a tпл эстрадиола, выделенного из эстрадиола дипропионата, – 173–179 °С.
ЕФ рекомендует использовать для идентификации лекарственных препаратов, представляющих собой эфиры уксусной кислоты (ципротерона ацетат, гидрокортизона ацетат, дезоксикортона ацетат и др.) реакцию с нитратом лантана и йодом. Субстанцию помещают в колбу, смешивают с 0,15 мл 85% раствора фосфорной кислоты, на колбу помещают предметное стекло, с которого свисает капля 5% раствора лантана нитрата и нагревают в течение 5 мин. Предметное стекло осторожно снимают, переворачивают и
41
после охлаждения последовательно добавляют по 1 капле 0,01 М раствора йода и раствора аммиака. Через 1–2 мин появляется синее окрашивание, обусловленное адсорбцией йода основным ацетатом лантана
([CH3COO]3La) 2J2 KJ.
Частные реакции препаратов стероидных гормонов
Стероидные гормоны вступают в следующие виды реакций:
–в ципротерона ацетате после сплавления карбонатом натрия обнаруживают хлорид-ион реакцией с нитратом серебра (ЕФ);
–к спиртовому раствору прогестерона добавляют щелочной раствор 1,3-динитробензола, появляется розовое окрашивание, постепенно переходящее в красно-коричневое (ГФ);
–2 мг этинилэстрадиола растворяют в 2 мл концентрированной серной кислоты, через 1–2 мин появляется оранжево-красное окрашивание с желто-зеленой флюоресценцией, добавляют 1 каплю раствора сульфата железа (III) аммония (квасцы железоаммониевые) и воды – раствор темнеет и через некоторое время образуется красновато-коричневый осадок (ГФ);
–тестостерона пропионат, этистерон (прегнин) и норэтистерон идентифицируют реакцией со спиртовым раствором бутилгидрокситолуола (2,6-ди-трет-бутил-n-крезол) в щелочной среде, при нагревании на водяной бане (t = 70–80 °С) в течение 30 мин. После охлаждения раствора до комнатной температуры тестостерона пропионат и этистерон (прегнин) образуют продукты реакции, окрашенные в интенсивный синий цвет, а норэтистерон – в желто-розовый (ЕФ).
5.2.Методы количественного анализа стероидных гормонов
всубстанциях и лекарственных формах
5.2.1. Титриметрические методы
Молекулы стероидных гормонов содержат ограниченное количество функциональных групп, которые можно было бы использовать для их титриметрического определения в субстанциях и лекарственных формах. Чаще всего количественный титриметрический анализ проводят по следующим группам:
– этинильной группе, используя ее способность образовывать двойные соли с нитратом серебра. Выделившееся эквивалентное количество азотной кислоты оттитровывают ОДМ раствором NaOH, точку эквивалентности определяют потенциометрически или с помощью индикатора бром крезолового синего (Мм эквивалента = Мм).
42

Данный метод включен в ЕФ для количественного определения этистерона, норэтистерона, левоноргестрела, этинилэстрадиола и местранола;
– 3-кетогруппе методом косвенной ацидиметрии, после реакции присоединения с гидроксиламина гидрохлоридом (Мм экв = Мм):
HCl + NaOH →NaCl + Н2O
– α-кетольной группе, используя ее способность к восстановлению. Тетрайодмеркуриат калия (реактив Несслера) взаимодействует с кортикостероидами в щелочной среде, при этом выделяется эквивалентное количество металлической ртути, которую окисляют избытком титрованного раствора йода в кислой среде в присутствии избытка калия йодида:
Избыток титранта оттитровывают раствором натрия тиосульфата (Мм экв = Мм/2);
–фторпроизводные глюкокортикоидов определяют после гидропиролитического отщепления фтора методом ториметрии, используя для установления точки эквивалентности индикатор метилтимоловый синий или потенциометрию;
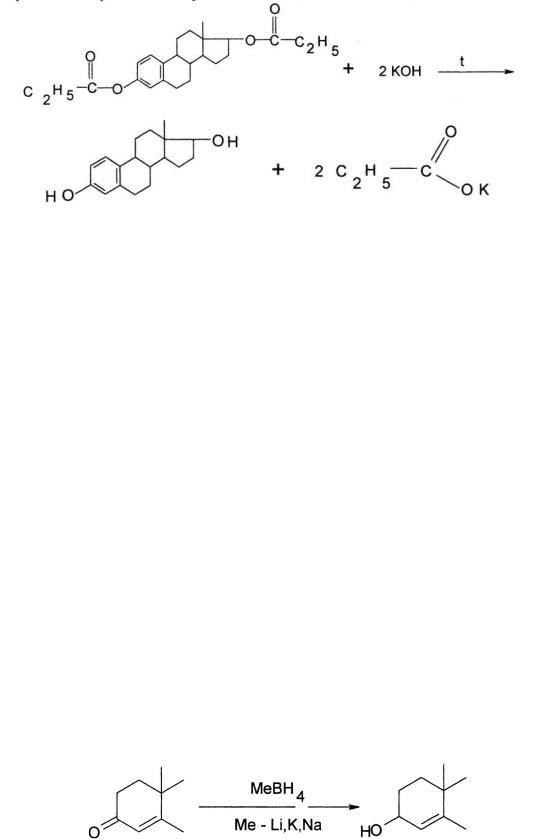
–в основе обратного алкалиметрического определения сложноэфирной группы эстрадиола дипропионата лежит реакция щелочного гидролиза, который проводят в присутствии избытка 0,1 М спиртового раствора КОН. Избыток щелочи оттитровывают кислотой (индикатор – фенолфталеин). Параллельно проводят контрольный опыт (Мм экв = Мм/2).
43
КОН + HCl→ KCl + Н2О
Основное применение титриметрические методы находят при определении субстанций стероидных гормонов. К недостаткам метода можно отнести использование большой навески вещества, поэтому данный метод не находит применения в анализе низкодозированных лекарственных форм стероидных гормонов.
5.2.2. Спектральные методы
Как отмечалось выше, УФ-спектроскопия, в том числе и количественная, является унифицированным методом анализа стероидных гормонов, содержащих следующие функциональные фрагменты в молекуле.
1. α, β-ненасыщенные кетоны (андрогены, анаболики, гестагены, кортикостероиды), которые имеют в этанольных растворах сходные УФспектры с максимумом поглощения в области 230–245 нм различной интенсивности. Метод УФ-спектроскопии рекомендован ГФ XI, МФ и ЕФ для контроля качества как субстанций стероидных гормонов, так и лекарственных форм на их основе.
В случае анализа масляных инъекционных растворов, низкодозированных таблеток, суспензий и мазей можно использовать более чувствительный метод дифференциальной спектроскопии, основанный на восстановлении стероидов борогидридами щелочных металлов до соответствующих спектрально неактивных 3-гидроксипроизводных.
44
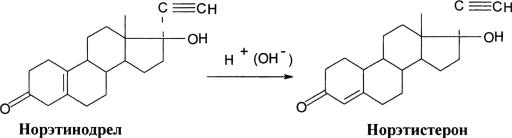
Если в кювету сравнения поместить раствор восстановленного 4-3- кетостероида, а в рабочую – раствор невосстановленного соединения с той же концентрацией, то разница оптических плотностей при 240 нм отвечает содержанию ненасыщенного соединения.
Определение спектрально неактивных 5(10)-3-кетостероидов, например норэтинодрела, можно проводить после его превращения в соответствующие спектрально активные 4-3-кетопроизводные путем кислотного или щелочного гидролиза:
Количественное превращение позволяет проводить избирательное определение норэтинодрела в контрацептивных препаратах методом дифференциальной спектроскопии.
2. фенольное кольцо А – спектры очень характеристичны (λmax = 280 нм), но из-за низкой интенсивности поглощения практически не используются для количественного анализа. Для повышения чувствительности метода ЕФ рекомендует проводить количественное определение эстрадиола в 0,1 М растворе гидроксида натрия, измеряя оптическую плот-
ность при 238 нм (Е 1%1см = 335).
Содержание стероидных гормонов в субстанции или лекарственных формах рассчитывают на основании приведенной в частных статьях величины удельного показателя поглощения (Е 1%1см, табл. 6) или с использованием раствора стандартного образца.
Таблица 6
Значения удельного показателя поглощения (Е 1%1см) стероидных гормонов, используемые в НД для количественного определения
|
|
Максимум поглощения |
Удельный показатель |
Препарат |
|
в УФ-спектре препарата |
|
|
поглощения Е 1%1см |
||
|
|
(нм) |
|
1 |
|
2 |
3 |
|
|
Производные андростана |
|
Тестостерона пропионат |
|
241 |
490 |
Метилтестостерон |
|
241 |
540 |
|
45 |
|
|

|
|
Окончание табл. 6 |
|
1 |
2 |
3 |
|
|
Гестагены |
|
|
Прогестерон |
241 |
535 |
|
Медроксипрогестерона |
241 |
426 |
|
ацетат |
|||
|
|
||
Ципротерона ацетат |
282 |
414 |
|
|
Кортикостероиды |
|
|
Дезоксикортикостерона |
240 |
450 |
|
ацетат |
|||
|
|
||
Кортизона ацетат |
237 |
395 |
|
Гидрокортизон |
241,5 |
448 |
|
Гидрокортизона ацетат |
241 |
395 |
|
Преднизон |
238 |
425 |
|
Преднизолон |
243,5 |
415 |
|
Дексаметазон |
238,5 |
394 |
|
Бетаметазон |
238,5 |
395 |
|
Триамцинолон |
238 |
380 |
|
|
Эстрогены |
|
|
Эстрадиола бензоат |
231 |
500 |
Широкое применение в фармацевтическом и биоклиническом анализе стероидных гормонов находит фотоколориметрия, которая до использования в анализе стероидов хроматографии была единственным достаточно селективным и чувствительным методом анализа стероидных гормонов.
В количественном анализе кетостероидов (андрогены, анаболики, гестагены, кортикостероиды) используют два важнейших метода.
1. Метод с использованием гидразида никотиновой кислоты
(ГИНК) основан на реакции конденсации препарата в растворе метанола, содержащем хлористоводородную кислоту. Для стероидов, содержащих 4- 3-кетогруппы, реакция протекает в течение 20 мин при комнатной температуре. 1,4-3-кетостероиды менее реакционно-способны, поэтому определение проводят при нагревании до 50 °С в течение 1 часа или повышают концентрацию ГИНК.
Преимущества данного метода заключаются в том, что окраска раствора не зависит от природы используемого растворителя (этанол, хлоро-
46

форм и др.) и только для низкодозированных масляных растворов необходимо отделять масло на хроматографической колонке с флорисилом.
Метод ГИНК является унифицированным методом определения кетостероидов в лекарственных формах. ГФ IX использует данный метод для количественного определения преднизолона и гидрокортизона в мазях (ФС
42-3305-96 и ФС 42-1961-96 соответственно).
2. Метод Циммермана основан на взаимодействии 17-кетогрупп стероидных гормонов (эстрон, метаболиты тестостерона) с 1,3-динитро- бензолом в щелочной среде.
Необходимым условием протекания реакции является удобное стерическое расположение кетогруппы по соседству с метиленовой группой. В реакцию не вступают 4-3-кетостероиды и 21-незамещенные-20-кетосте- роиды. Метод Циммермана широко применяется в клиническом анализе для определения 17-кетостероидов в моче.
При фотоколориметрическом анализе эстрогенов находят применение цветные реакции на фенольное кольцо А:
–реакция азосочетания с диазотированными сульфаниловой кислотой, 3-нитроанилином, сульфатиазолом и другими ароматическими амина-
ми (λ = 540–550 нм);
–реакция нитрования ароматического кольца (λ = 400–435 нм);
–реакция восстановления молибдовольфрамофосфата (реактив Фолина) до окрашенного в синий цвет комплекса ((λ = 760 нм);
–реакция образования индофенолового красителя с реактивом Гиб-
бса (λ = 540 нм).
Гораздо большее значение в фармацевтическом фотоколориметрическом анализе эстрогенов имеет более чувствительный метод Кобера и его модификации, основанный на взаимодействии препаратов с минеральными
47
кислотами, в основном серной, или их растворами в различных растворителях (вода, этанол, метанол).
Основная роль кислоты заключается в дегидратации молекулы эстрогена с образованием двойной связи (связей), которые мигрируют к фенольному кольцу А. В ходе этого процесса метальная группа при С13 мигрирует в положение С17, кроме того, происходит сульфирование кольца А при С2. Окраска образующихся продуктов может возникать вследствие протонирования в сильно кислой среде, что приводит к образованию ионов карбонила, способных к резонансу. Вторая стадия метода Кобера носит окислительновосстановительный характер. В результате удлинения π-электронной системы в спектре окрашенного комплекса наблюдается батохромный сдвиг.
Данный метод широко применяется в анализе низкодозированных гормональных препаратов, содержащих этинилэстрадиол и местранол, так как эстрон, эстрадиол и гестагены не вступают в реакцию с серной кислотой в этих условиях.
Несмотря на удовлетворительную чувствительность и селективность реакции с участием реагентов, содержащих серную кислоту, разбавленную этанолом, а также простоту методики, в биофармацевтическом анализе чаще применяют более длительные двухстадийные реакции, обладающие еще более высокой чувствительностью и селективностью, с участием реагентов, содержащих серную кислоту, воду и различные добавки.
Первая стадия основана на классической методике Кобера – пробу лекарственной формы, содержащей эстроген, смешивают с 65 % раствором серной кислоты с добавкой фенола и нагревают – образуется продукт желтого цвета (λ = 450–500 им). На второй стадии смесь разбавляют водой до 40–50 % концентрации серной кислоты и вновь нагревают, окраска переходит в розовую (λ = 560 нм). Вместо фенола можно использовать гидрохинон. Другим важным вариантом метода Кобера является методика Хенни, предложившего реактив, содержащий, помимо серной кислоты, фенола и воды, еще и сульфат железа (III). Присутствие ионов Fe+3 повышает скорость развития окраски и ее стабильность. Метод Хенни включен в Фармакопею США для анализа эстрогенов и их конъюгатов в биожидкостях.
Для фотоколориметрического анализа кортикостероидов предложено множество методик, но основными в фармацевтическом анализе являются следующие.
1.Метод с использованием солей тетразолия рекомендован МФ III
иявляется основным методом анализа субстанций и лекарственных форм глюкокортикоидов и минералокортикоидов.
Ниже представлено уравнение химической реакции между α-кетоль- ной группой кортикостероидов и хлоридом трифенилтетразолия с образованием окрашенного формазана (Е1%1см = 400–405). Реакция 21-эфиров кор-
48

тикостероидов с солями тетразолия протекает медленно, поэтому необходимо провести предварительный гидролиз в щелочной среде. 11-кетопроиз- водные более реакционно-способны, чем 11β-производные. Основным недостатком реакции с солями тетразолия является влияние кислорода воздуха, вследствие чего ее следует проводить в атмосфере азота.
ЕФ рекомендует использовать данный метод для количественного определения флюоцинолона ацетонида в субстанции.
2. Метод Портера – Зильбера используется для анализа глюкокортикоидов в моче и других биопробах, так как в реакцию окисления фенилгидразином в присутствии серной кислоты вступают только 17α-гидрокси- производные:
Для всех классов стероидных гормонов известны методики спектрофлюориметрического количественного определения. В связи с высокой чувствительностью этот метод чаще всего используется для анализа содержания стероидных гормонов и их метаболитов в биологических объектах.
Из всех классов стероидных гормонов собственной флюоресценцией обладают только эстрогены, в структуре которых присутствует ароматическое кольцо А. Максимум возбуждающего излучения эстрогенов и их про-
49

стых эфиров находится около 284 нм, а максимум испускания лежит в области 310–327 нм. Низкая интенсивность флюоресценции эстрогенов и малые длины волн возбуждения и испускания ограничивают возможности данного метода. Как правило, эстрогены переводят во флюоресцирующие производные с помощью химических реакций, например, с дансилхлоридом в щелочной среде:
У образующегося дансил производного максимум возбуждающего излучения находится в области 346–366 нм, а максимум спектра испускания – 502–525 нм. Данный метод рекомендован Британской фармакопеей (1980) для количественного анализа этинилэстрадиола в таблетках.
Появление окраски при взаимодействии стероидных гормонов с сильными минеральными кислотами (серной, фосфорной, трихлоруксусной и др.) обычно сопровождается флюоресценцией, это явление используется как для качественного, так и для количественного анализа. Флюоресценция под действием серной кислоты в присутствии этанола применяется для определения эстрогенов в низкодозированных лекарственных формах.
В основе флюориметрического определения метилтестостерона и метандиенона в таблетках лежит реакция с серной кислотой и 80%-ной фосфорной кислотой с добавлением трихлоруксусной кислоты соответственно.
Известны методики спектрофлюориметрического определения глюкокортикоидов в биопробах, основанные на образовании флюоресцирующих производных в присутствии серной кислоты и этанола. Максимумы возбуждения кортикостероидов находятся при длинах волн 470–780 нм, а максимумы испускания – 530–540 см.
5.2.3. Поляриметрия
Все стероидные гормоны являются оптически активными веществами, и их растворы в различных растворителях (этанол, диоксан, пиридин, хлороформ и др.) имеют характерную величину удельного вращения (см. приложение). Измерение величины угла вращения растворов стероидных гормонов проводят как для оценки их чистоты, так и для определения его концентрации в растворе. Однако метод поляриметрии включен только в
50
