
Preparaty_-_proizvodnye_tsiklopentanpergidrofenantrena__1
.pdfНД на субстанцию метандриола. Это связано с тем, что из-за отсутствия в молекуле метандриола хромофорной системы, возникающей вследствие сопряжения карбонильной группы при С3 и двойных связей кольца А, для него неприменимы унифицированные методики спектрофотометрии в УФ- и видимой областях спектра.
5.2.4.Хроматографические методы
Внормативной документации на субстанции и лекарственные формы стероидных гормонов, разработанной за последнее десятилетие, внедряются методики количественного определения с использованием ВЭЖХ. Этот метод введен в ФС 42-3464-97 «Таблетки метиландростендиола по 0,01 и 0,025 г» для определения примесей посторонних стероидов, однородности дозирования и количественного определения. Метандриол не имеет выраженного максимума поглощения в УФ-спектре, поэтому спектрофотометрическое определение для него невозможно, ранее в ГФ X использовался метод гравиметрии. Расчет количественного содержания проводится путем сравнения площадей пиков стандартного и анализируемого образца метиландростендиола.
Предложены методики количественного определения глюкокортикоидов в мазях (гидрокортизон и его ацетат, преднизолон, флюоцинолона ацетонид) методом ВЭЖХ в обращено-фазном режиме на колонках с сепа-
роном С18. В качестве элюента используется этанол. В сравнении с фармакопейными методами – спектрофотометрии в УФ- и видимой области спектра – относительная ошибка данного метода не превышает ± 4 %.
5.2.5. Полярография
Этот метод довольно распространен в фармацевтическом и биофармацевтическом анализе стероидных гормонов. Из всех функциональных групп стероидов только кетогруппа способна восстанавливаться на капельном ртутном электроде, поэтому основной класс стероидов, определяемый данным методом, это α,β-ненасыщенные кетостероиды – андрогены, анаболики, гестагены и кортикостероиды. Из-за разности потенциалов полуволн 4-3-кето- и 1,4-3-кетостероидов можно проводить их раздельное определение в одной пробе.
Полярографическое восстановление α,β-ненасыщенных 3-кетонов протекает с участием одного электрона и приводит к образованию пинакона:
51
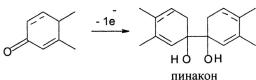
Полярографическое определение 3-кетостероидов проводят в растворе хлорида или гидроксида лития при различных величинах pH, а также в водно-спиртовых растворах на фоне буферного раствора Бриттона – Робинсона.
Для определения отдельных 4-3-кетостероидов (метилтестостерон, прогестерон) используется реакция с 3,5-динитробензоилхлоридом, а также процесс конденсации с раствором диметилглицилгидразида (реактив Жирара) с образованием полярографически активных диметилглицилгидразонов, которые в водно-спиртовых растворах на фоне буферного раствора Бриттона – Робинсона дают четкие полярографические волны.
17-кетостероиды (эстрон, андростерон и др.) не восстанавливаются на ртутном капельном электроде, но их гидразоновые производные обладают этой способностью, что делает возможным полярографическое определение этих соединений в биологических пробах и в культуральной жидкости при постадийном контроле получения эстрогенов, андрогенов и анаболиков.
Описан полярографический метод количественного определения гидрокортизона в мазях, содержащих тетрациклин и полимиксин. Метод основан на экстрагировании мази петролейным эфиром и 0,1 М раствором НСl с последующим полярографированием полученного экстракта гидрокортизона в смеси диметилформамида и (C2H5)4NBr с добавлением буферного раствора Бриттона – Робинсона до pH = 9,5.
Во ВНИИХФИ с помощью полярографического метода контролируют микробиологические реакции получения в полузаводских условиях преднизона из кортизона, преднизолона из гидрокортизона и дианобола из метилтестостерона, а также оптимальные условия экстракции получаемых стероидов из культуральных жидкостей.
Достоинства полярографического определения стероидных гормонов заключаются в следующем:
–высокая чувствительность метода (5–40 мкг/мл), что позволяет анализировать низкодозированные препараты с высокой степенью точности;
–при анализе лекарственных форм (мази, кремы, таблетки) не нужно отделять основу или экстрагировать препарат;
–в минимальных затратах труда.
52
5.2.6.Гравиметрия
Всвязи с трудоемкостью гравиметрического анализа и необходимостью использовать большую массу пробы данный метод редко используется
вколичественном анализе стероидов. ГФ X рекомендовала использовать гравиметрию для определения количественного содержания прогестерона в субстанции и сложных эфиров тестостерона в лекарственных формах.
Воснове определения прогестерона лежит реакция с 2,4-динитро- фенил гидразином в кислой среде, приводящая к образованию 3,20-биди- нитрофенилгидразона, малорастворимого в смеси этанола с водой.
Для надежного определения эфиров тестостерона (главным образом в масляных растворах для инъекций) служит реакция образования семикарбазона по 3-кетогруппе.
6.ОСОБЕННОСТИ КОНТРОЛЯ КАЧЕСТВА СТЕРОИДНЫХ ГОРМОНОВ В ЛЕКАРСТВЕННЫХ ФОРМАХ
Как правило, стероидные гормоны применяют в виде масляных растворов, суспензий или эмульсий для инъекций, таблеток, капсул, мазей и кремов. Основная сложность при проведении контроля качества этих лекарственных форм заключается в предварительной подготовке пробы.
Первым этапом пробоподготовки служит экстракция стероидных гормонов, которые являются, как правило, неполярными веществами. Экстракция гормонов из таблеток не вызывает затруднений, для этого используют метанол, этанол или водно-хлороформные смеси. Из водных суспензий гормоны извлекают хлороформом или дихлорэтаном, из масляных растворов гормоны отделяют с помощью этанола или метанола, для эстрогенов пользуются водными или спиртовыми растворами едкого натра.
При извлечении кортикостероидов из мазей и кремов применяют менее трудоемкую процедуру распределения лекарственной формы между полярным и умеренно полярным органическим растворителем. В первый растворитель переходит наполнитель, а во второй – лекарственное вещество. Чаще всего для экстракции глюкокортикоидов из мазей используют хлороформ, смесь гексан – ацетонитрил. Ацетонитрильную фазу можно непосредственно вводить в жидкостной хроматограф или анализировать спектральными или электрохимическими методами.
На втором этапе проводят идентификацию и количественное определение действующего вещества лекарственной формы. В последнем случае пользуются наиболее чувствительными и точными физикохимическими методами – спектрофотометрией в УФ- и видимой областях, а также ВЭЖХ на нормальных и обращенных фазах. Особые требования к точности и избирательности метода предъявляются при анализе низкодозированных комбинированных таблетированных форм – эстроген – гестаген, андроген – гестаген и др.
53
7. ТЕСТОВЫЕ ЗАДАНИЯ
Выберите правильный вариант ответа.
1.Гидрокортизона ацетат является производным
1)эстрана;
2)прегнана;
3)андростана;
4)холестана.
2.Этистерон (прегнин) является производным
1)эстрана;
2)прегнана;
3)андростана;
4)холестана.
3.Химическое название лекарственного вещества
1)17α-гидроксиандростен-1,4-диол-3β, 11α;
2)прегнен-4-диол-17α, 21-дион-3,20;
3)прегнадиен-1,4-диол-17α, 21-дион-3,20;
4)прегнадиен-1,4-триол-17α, 11β, 21-дион-3,20;
5)прегнадиен-1,4-диол-17α, 21-трион-3,11,20.
4.К производным андростана относится:
54

5.Сочленение колец стеранового цикла стероидных гормонов:
1)АВ-транс, ВС-цис, СД-транс;
2)АВ-цис, ВС-транс, СД-транс;
3)все – цис;
4)все – транс.
6.5α-стероиды обладают специфической гормональной активностью:
1)верно;
2)неверно.
7.Циклогексановый скелет АВС природных стероидов имеет конформацию:
1)ванны;
2)кресла;
3)полукресла;
4)конверта.
8.Введение этинильной группы в 17α-положение тестостерона:
1)усиливает андрогенную активность;
2)приводит к появлению антиандрогенной активности;
3)приводит к появлению гестагенной активности;
4)усиливает анаболическую активность;
5)приводит к появлению пролонгированного эффекта действия.
9.Образование ацетонидов глюкокортикоидов:
1)повышает глюкокортикоидную активность;
2)снижает резорбтивное действие при местном применении;
3)приводит к получению водорастворимого соединения;
55
4) повышает резорбтивное действие при местном применении.
10.Водорастворимые препараты глюкокортикоидов можно получить
путем:
1) образования сложного эфира;
2) использования солюбилизаторов;
3) получения алкоголята натрия по спиртовому гидроксилу; 4) получения натриевых солей при образовании сложных эфиров мно-
гоосновных кислот.
11.Назовите стероидный препарат, растворяющийся в воде:
1)преднизолона гемисукцинат;
2)метилтестостерон;
3)флуоцинолона ацетонид;
4)преднизолон;
5)прогестерон.
12.В растворе гидроксида натрия будет растворяться:
1)преднизолон;
2)этинилэстрадиол;
3)кортизона ацетат;
4)местранол.
13.Тип реакции лекарственного вещества с раствором тетразолиевого синего в щелочной среде
1)окисление;
2)осаждение;
3)диазотирование;
4)солеобразование;
5)электрофильного замещения.
14.Специфический максимум поглощения 4-3-кетостероидов находится в области:
1)260 нм;
2)275 нм;
3)241 нм;
56
4)230 нм;
5)280 нм.
15.Метод УФ-спектрофотометрии не используется в количественном
анализе:
1) дексаметазона;
2) эстрадиола;
3) метандриола;
4) прогестерона;
5) ципротерона ацетата.
16.Общая реакция для метилтестостерона и дезоксикортикостерона
ацетата:
1) азосочетания;
2) гидроксамовая проба;
3) с раствором гидроксиламина гидрохлорида;
4) с реактивом Фелинга;
5) щелочного гидролиза.
17.Фторпроизводные глюкокортикоидов в ИК-спектре имеют харак-
терную полосу поглощения связи C-F в области: 1) 1725 см-1; 2) 1650 см-1; 3) 3400 см-1;
4) 1000–1100 с см-1;
5) 3250 см-1.
18.ИК-спектры эстрадиола и эстрадиола дипропионата отличаются
по полосе поглощения в области: 1) 1725 см-1; 2) 1650 см-1; 3) 3400 см-1;
4) 1000–1100 см-1;
5) 3250 см-1.
19.Кортизон от преднизолона можно отличить:
1)по реакции с кислотой серной концентрированной;
2)по УФ-спектрам;
3)по реакции с реактивом Фелинга;
4)по реакции образования оксима;
5)по реакции азосочетания.
57
20.По реакции образования гидроксамата железа можно идентифи-
цировать:
1)преднизолон;
2)дексаметазон;
3)тестостерона пропионат;
4)триамицинолона ацетонид;
5)метилтестостерон.
21.Производные эстратриенов в УФ-области спектра имеют максимум поглощения при:
1)241 нм;
2)255 нм;
3)235 нм;
4)280 нм;
5)340 нм.
22.Для определения посторонних примесей в препарате кортизона ацетат применяют методы:
1)УФ-спектрофотометрии;
2)гравиметрии;
3)фотоколориметрии;
4)тонкослойной хроматографии;
5)ИК-спектроскопии.
23.Для количественного определения стероидных гормонов применяют все методы, кроме:
1)поляриметрии;
2)спектрофотометрии;
3)фотоколориметрии;
4)ВЭЖХ;
5)рефрактометрии.
24.Специфическая примесь в этинилэстрадиоле и местраноле:
1)эстратриол;
2)эстрон;
3)эстрадиола пропионат;
4)17α-эстрадиол;
5)все вышеперечисленные.
25.В основе количественного определения гидрокортизона йодометрическим методом лежит реакция:
1)комплексообразования;
58
2)электрофильного замещения;
3)окисления α-кетольной группы;
4)присоединения по двойной связи в кольце А.
26.Метод полярографии стероидных гормонов основан на восстанов-
лении:
1)фенольного гидроксила;
2)α-кетольной группы;
3)17β-гидроксигруппы;
4)3-кетогруппы сопряженной с ненасыщенной связью;
5)стеранового цикла.
27.Укажите условия реакции, используемой для получения 11β-окси- производных кортикостероидов
1)хромовая смесь;
2)ферменты микроорганизмов;
3)изопропилат алюминия в смеси с циклогексаноном;
4)все вышеперечисленное.
28.Метод ВЭЖХ в анализе препаратов стероидных гормонов используется для:
1)установления подлинности;
2)определения специфических примесей и их концентрации;
3)количественного определения действующего вещества;
4)все вышеперечисленное.
Выберите все возможные варианты правильных ответов.
29. Преднизолон и тестостерона пропионат можно отличить химическими реакциями с:
1)серной концентрированной кислотой;
2)гидроксиламином в щелочной среде, затем хлоридом железа (III) в кислой среде;
3)фенилгидразином;
4)реактивом Фелинга;
5)солями тетразолия в щелочной среде.
59
30.Наличие ковалентно-связанного фтора в триамцинолоне можно обнаружить:
1)пробой Бейльштейна;
2)реакцией с хромовой смесью;
3)ализаринат-циркониевой пробой после минерализации;
4)ИК-спектроскопией;
5)УФ-спектроскопией;
6)реакцией с нитратом серебра после минерализации.
31.Наличие фенольного гидроксила в структуре этинилэстрадиола устанавливают реакцией:
1)азосочетания;
2)этерификации;
3)с фенилгидразином;
4)с реактивом Гиббса;
5)с концентрированной серной кислотой;
6)с солями тетразолия.
32.Для количественного определения норэтистерона используют ме-
тоды:
1)косвенной алкалиметрии после реакции с нитратом серебра;
2)фотоколориметрии, основанной на реакции с солями тетразолия;
3)фотоколориметрии, основанной на реакции с изониазидом;
4)УФ-спектроскопии;
5)ИК-спектроскопии;
6)полярографии.
33.Тип реакции взаимодействия лекарственного вещества с реактивом Толленса (аммиачный раствор нитрата серебра) при нагревании:
1)окисление;
2)осаждение;
3)диазотирование;
4)солеобразование;
5)электрофильного замещения.
60
