
Preparaty_-_proizvodnye_tsiklopentanpergidrofenantrena__1
.pdfколичеств примесей в препаратах стероидных гормонов, нужны более чувствительные методы флуориметрии, газовой и высокоэффективной жидкостной хроматографии.
5.1. Методы установления подлинности и доброкачественности стероидных гормонов
5.1.1. Физико-химические методы
Современная нормативная документация рекомендует проводить испытание подлинности и доброкачественности стероидных гормонов, основываясь на их физических константах и некоторых физических свойствах. Основные физические константы, включенные в отечественную и зарубежную нормативную документацию, приведены в приложении. Методы УФ-, ИК-спектроскопии и хроматографии будут рассмотрены подробно.
ИК-спектроскопия
Установление подлинности стероидных гормонов методом ИК-спект- роскопии является унифицированным методом, включенным во все фармакопеи, и сводится к последовательному снятию спектров аналогичным способом подготовленных образцов исследуемого и стандартного образца. Совпадение полос двух полученных спектров свидетельствует об идентичности анализируемых соединений. Данная методика, основанная на сравнении со спектром стандартного образца, чаще используется в ЕФ и МФ. ГФ XI допускает установление подлинности стероидных гормонов по спектру сравнения, который приводится в нормативной документации на конкретное соединение с указанием условий его снятия.
Наряду с применением ИК-спектроскопии для идентификации стероидных гормонов, метод имеет большое значение для распознавания полиморфных модификаций, часто встречающихся у стероидных гормонов.
ИК-спектры стероидов снимают в виде суспензий с вазелиновым маслом или нуйолом, а также в виде прессованных дисков с бромидом калия. Благодаря легкости приготовления образцов в вазелиновом масле, этот способ пригоден для быстрой идентификации веществ (ГФ IX). Спектры в таблетках с бромидом калия следует рассматривать как наиболее полные (из-за отсутствия перекрывания с полосами дисперсионной среды) и пригодные для более подробного качественного и количественного изучения структуры стероидных соединений.
К недостаткам методики снятия спектров в таблетках с КВr можно отнести изменения в области валентных колебаний ОН-группы, связанные с образованием водородных связей, с молекулами воды, присутствующей в
21
гигроскопичных галогенидах. Кроме того, известно, что в процессе приготовления таблеток полиморфные изменения в структуре стероидных соединений происходят чаще, чем при изготовлении суспензий.
Общие характеристические полосы поглощения стероидов в ИКобласти спектра обусловлены СН-валентными колебаниями, которые проявляются в интервале 2700–3000 см-1. Деформационным колебаниям СНгрупп насыщенного скелета циклопентанпергидрофенантрена соответству-
ют полосы при 1440–1475, 1333–1389, 1111–1176, 1020–1042, 892–976, 826–
866и 714–736 см-1.
Вобласти 2900 и 2880 см-1 наблюдаются интенсивные полосы поглощения, характерные для валентных колебаний метальных групп (асимметрических и симметричных соответственно).
Производные андуостана. В ИК-спектре тестостерона наблюдается интенсивная полоса поглощения при 1648 см-1, соответствующая сопря-
женной конъюгированной группе С=О при С3 и полоса средней интенсивности при 1603 см-1 – группировке С=С при С4. Помимо этого, в тестостероне имеется менее выраженная полоса при 1725 см-1, которая заметно ослабевает у метилтестостерона и интенсивность которой значительно возрастает у тестостерона пропионата, вследствие влияния карбонильной группы остатка пропионовой кислоты.
Для метилтестостерона характерными можно считать полосы поглощения средней интенсивности в области 928–946 см-1, обусловленные наличием метальной группы в положении 17α и гидроксильной группы в положении 17β.
Тестостерона пропионат может характеризоваться по полосам погло-
щения, соответствующим валентным колебаниям сложноэфирной группы:
О=С-О (1200–1250 см-1), С=О (1724–1745 см-1) и С-О (1075–1094 см-1).
Дополнительным источником информации может служить полоса средней интенсивности связи С=С при С4 (1603 см-1), а также полоса высокой степени интенсивности С=О при С3 (1653 см-1). Интенсивная полоса поглощения при 855 см-1 во всех вышеперечисленных соединениях связана с
деформационными колебаниями СН-сопряженной связи при С4. Метандиенон отличается от метилтестостерона наличием в молекуле
дополнительной сопряженной связи при С1. К наиболее характерным поло-
сам относятся полосы валентных колебаний групп С=О при С3 (1656– 1664 см-1), С=С при С4 (1613–1626 см-1), С=С при С1 (1597–1608 см-1). Раз-
личия в спектрах метилтестостерона и метандиенона проявляются в области
400–1300 см-1 вследствие деформационных колебаний СН-группы при C1 и С2 с образованием полос средней интенсивности (920–936 см-1) и полос слабой интенсивности при 815–826 см-1. Эти полосы отсутствуют у метилтестостерона, что позволяет идентифицировать метандиенон с высокой степенью достоверности.
22
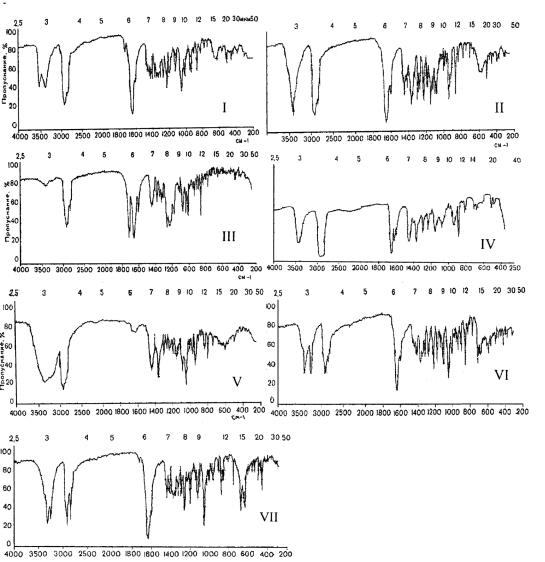
Рис. 2. Инфракрасный спектр производных андростана: тестостерон (I), метилтестостерон (II), тестостерона пропионат (III), метандиенон (IV), метандриол (V), этистерон (прегнин, VI) и норэтистерон (VII)
в таблетках бромида калия.
ИК-спектр метандриола в значительной степени упрощен по сравнению со спектрами рассмотренных ранее соединений, так как отсутствует кетогруппа при С3 и двойная связь находится при С5. Наиболее характерными для этого соединения являются полосы валентных колебаний ОН-группы при С3 (3125–3636 см-1, широкая полоса) и валентных колебаний С-О, полоса интенсивного поглощения в области 1023–1093 см-1. Валентные колебания связи С=С при С5 представлены слабо выраженной полосой (1667–1672 см-1). Другие полосы в области 1600–1800 см-1 отсутст-
23

вуют, что позволяет отличать метандриол от других препаратов производных андростана.
ИК-спектр этистерона (прегнина) имеет полосы поглощения общие с тестостероном в области 1600–1800 см-1. Специфичными для прегнина являются полосы при 3300–3340 см-1, соответствующие валентным колебаниям этинильной группы. Норэтистерон, отличающийся от прегнина отсутствием группы СН3, при C19 имеет те же полосы поглощения в области 1600– 1800 см-1 и 3200–3400 см-1. В области 400–1300 см-1 наблюдается сдвиг основных полос на 20–30 см-1, например, для прегнина 715 см-1 и 860 см-1 и соответственно для норэтистерона 678 см-1 и 880 см-1, что делает спектр последнего характеристичным.
Гестагены. Наиболее характерными для ИК-спектра прогестерона являются три полосы поглощения в области 1600–1800 см-1: при 1605 см-1 средней интенсивности, соответствующая группировке С=С при С4, полоса сильной степени интенсивности при 1648 см-1 (группа С=О при С3) и четко выраженная полоса сильной степени интенсивности при 1690 см-1 (С=О при С20). Имеется также одна полоса поглощения при 940 см-1 и четко выраженная полоса при 864 см-1 (деформационные колебания группы СН при
С4).
Отличительным признаком спектра прогестерона от спектров близких по строению соединений может служить отсутствие у прогестерона четко выраженных полос поглощения в области 1000–1100 см-1.
Рис. 3. Инфракрасный спектр прогестерона в таблетках бромида калия
Минералокортикоиды. Основным структурным группировкам дезоксикортона ацетата соответствуют следующие полосы поглощения: в области 1600–1800 см-1, валентным колебаниям группы С=С при С4 соответствует полоса средней интенсивности при 1605 см-1; Интенсивная полоса поглощения, связанная с сопряженной группировкой С=О при С3, проявляется при 1656 см-1; наблюдается также интенсивная полоса поглощения при 1684 см-1, характерная для связи С=О при С20. Валентные колебания группы ОН в положении С21 проявляются в виде острой полосы поглощения при
24

3480 см-1, а валентные колебания связи С-О при С21 – в виде полос поглощения области 1023–1093 см-1. Для данного соединения специфичны полосы сильной интенсивности, соответствующие валентным колебаниям группы С=О ацетильного остатка (1733 см-1) и группы С-О в сложном эфире
(1231 и 1065 см-1).
Рис. 4. Инфракрасный спектр дезоксикортона ацетата в таблетках бромида калия
Глюкокортикоиды. Для ИК-спектра кортизона ацетата, снятом в вазелиновом масле, наиболее характерной также является область 1600–1800 см-1, на которую приходятся валентные колебания группировки С=С при С4 средней степени интенсивности (1606–1626 см-1), валентные колебания сильной степени интенсивности групп С=О при С3 и С11 (1656– 1684 см-1), группы С=О при С20 (1706–1733 см-1), а также группы С=О ацетильного остатка (1733–1764 см-1).
Вобласти 3400 и 3280 см-1 имеются интенсивные полосы поглощения, соответствующие валентным колебаниям гидроксильных групп.
ВИК-спектре гидрокортизона в области 1600–1800 см-1 проявляются только две полосы интенсивного поглощения, соответствующие валентным
колебаниям С=О группы при С3 (1665 см-1) и при С20 (1695 см-1), а также полоса слабой интенсивности при 1605 см-1, соответствующая связи С=С при С4. Этим ИК-спектр гидрокортизона отличается от спектра кортизона, хотя спектры этих соединений в области 3000–4000 см-1 идентичны.
Для ИК-спектра преднизона, как 1,4 -3-кетостероида, в области 1600– 1800 см-1 характерны следующие полосы: полосы сильной интенсивности валентных колебаний группировки С=С при С1 и С4 (1595 см-1 и 1610 см-1 соответственно); полоса валентных колебаний сопряженной группы С=О при С3 (1656 см-1). Сильная полоса валентных колебаний группы С=О при С20 приходится на область 1690–1720 см-1, в которой также проявляется поглощение группы С=О в положении С11, что приводит к образованию одной широкой полосы.
25

Рис. 5. Инфракрасные спектры кортизона ацетата (А), гидрокортизона (Б), преднизона (В) и преднизолона (Г) в таблетках калия
бромида
ИК-спектр преднизолона практически идентичен спектру преднизона в области 1600–1800 см-1, отличия наблюдаются в области поглощения
3000–4000 см-1 (3360, 3450 и 3560 см-1).
Дексаметазон в отличие от рассмотренных выше препаратов характеризуется наличием широкой полосы с сильной интенсивностью в области 1000–1100 см-1, обусловленной наличием в структуре препарата связи C-F. Область ИК-спектра дексаметазона 1600–1800 см-1 имеет три полосы поглощения: полосы сильной интенсивности валентных колебаний С=О при С3 (1700 см-1), валентных колебаний С=О, сопряженных с двойной связью (1650 см-1), и полоса валентных колебаний С=С связи (1600 см-1).
26
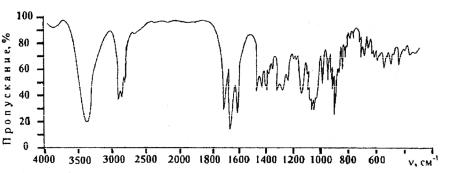
Рис. 6. Инфракрасный спектр дексаметазона в таблетках бромида калия
Производные эстрана. ИК-спектр эстрадиола имеет широкую полосу поглощения с максимумами при 3220 см-1 и 3420 см-1, соответствующим валентным колебаниям гидроксильных групп при С3 и С17. К валентным колебаниям группировок С=С кольца А относятся две полосы средней степени интенсивности при 1575 и 1597 см-1, а также полоса при 1490 см-1. Валентные колебания связи С-О представлены полосой сильной степени интенсивности в области 1238–1282 см-1. Имеется серия полос, соответствующих деформационным колебаниям СН-групп при 777, 810, 865 и 910 см-11.
Идентификация ИК-спектра этинилэстрадиола в таблетках бромида калия затруднена в области 3000–4000 см-1, где поглощают одновременно гидроксильные и этинильная группы. Поэтому для идентификации этинилэстрадиола параллельно снимают спектры его 2,5% раствора в хлороформе. В этом случае полосы поглощения в области 3000–4000 см-1 строго дифференцированы и в спектре имеются интенсивные полосы при 3310 см-1 и 3600 см-1. Первая из них соответствует СН-валентным колебаниям этинильной группы, которые на спектре образца в вазелиновом масле представлены в виде двух интенсивных полос при 3290 и 3320 см-1. Две полосы, соответствующие валентным колебаниям гидроксильных групп, при 3510 и 3610 см-1 в хлороформном растворе проявляются в виде одной полосы с максимумом при 3600 см-1.
Остальные, наиболее характерные для функциональных групп этинилэстрадиола полосы поглощения сохраняются при 1610, 1585 и 1495 см-1, а также в области 1000–1100 см-1.
Для ИК-спектра местранола специфичными являются в области 3000– 4000 см-1 две полосы поглощения при 3240 и 3270 см-1, соответствующие валентным колебаниям СН-группы в этинильном радикале, а также полосы при 3470 и 3520 см-1, свойственные валентным колебаниям гидроксильных групп.
27

Рис. 7. Инфракрасные спектры этинилэстрадиола в таблетках бромида калия (А) и 2,5% раствора в хлороформе (Б)
В области 1500–1700 см-1 в отличие от этинилэстрадиола, имеющего две узкие полосы равной степени интенсивности, местранол проявляет очень интенсивную полосу поглощения при 1603 см-1 и полосу средней интенсивности при 1570 см-1. Более интенсивно, чем у этинилэстрадиола, выражены полосы поглощения С-О-группы в области 1000–1100 см-1 и валентные колебания СН-группы в области 800–900 см-1. Специфической для местранола является полоса при 695 см-1.
Эстрон применяется в качестве лекарственного средства, а также является исходным продуктом синтеза этинилэстрадиола и местранола. Наличие карбонильной группы при С17 в эстроне приводит к появлению на ИКспектре интенсивной полосы поглощения при 1715 см-1, что в сочетании с полосой валентных колебаний гидроксильной группы при С3 (3330 см-1), а также остальными параметрами, специфичными для эстратриенов, делает спектр эстрона характерным (рис. 23). Эта особенность может использоваться не только для идентификации, но и для определения примеси эстрона в препаратах этинилэстрадиол и местранол.
28

Рис. 8. Инфракрасные спектры местранола (А) и эстрона (Б) в таблетках бромида калия
УФ-спектроскопия
УФ-спектрофотометрия используется на всех этапах фармацевтического анализа стероидных соединений (испытание на подлинность, доброкачественность, количественное определение) и является унифицированным методом анализа лекарственных веществ данной группы и их препаратов. При испытании на подлинность исследования проводятся с целью:
–получения спектров поглощения анализируемого и стандартного образцов в области от 220 до 300 нм;
–изучения характера спектров на основании максимумов и минимумов поглощения;
–измерения величины E1%1см.
Для растворения анализируемого образца стероидных соединений пользуются, как правило, 95% этиловым спиртом. Концентрации растворов готовятся в соответствии с рекомендациями НД на конкретный препарат и в большинстве случаев составляют около 0,001 %.
29
4- и 1,4-3-кетостероиды (андрогены, анаболики, гестагены и кортикостероиды) имеют сходные спектры поглощения с максимумом в области 238–241 нм. Это связано с наличием в структуре данных соединений хромофорной системы, возникающей вследствие сопряжения карбонильной группы при С3 и двойных связей кольца А. Исключение составляют метандиенон, максимум которого смещен в длинноволновую область на +4 нм (λ = 245 нм) и метандриол, не имеющий максимума поглощения в области от 200 до 300 нм, из-за отсутствия хромофорной системы.
Стероидные соединения производные эстратриенов (эстрон, эстрадиол, этинилэстрадиол), содержащие в ароматическом кольце А гидроксильную группу при С3, имеют максимум поглощения при 280 нм. Введение в положение С3 метоксильной группы (местранол) обусловливает наличие максимума поглощения в области 285–287 нм, что свидетельствует о батохромном влиянии этой группы.
Хроматографические методы
Вотечественную и зарубежную НД для установления подлинности и доброкачественности стероидных гормонов включены методы хроматографии: ТСХ и ВЭЖХ на нормальных и обращенных фазах.
Хроматография в тонких слоях сорбента (ТСХ). Среди сорбентов,
рекомендуемых НД для ТСХ стероидных гормонов, основное место занимает силикагель и его смеси («Кизельгель», «Силуфол», «Сорбифил» и др.).
Вкачестве проявителей используются специфические (групповые) и неспецифические (общие) реактивы, а также способность стероидных гормонов и их производных к флюоресценции в УФ-свете (254–365 нм). К неспецифическим реактивам следует отнести 6% растворы хлорной кислоты в метиловом спирте (I), раствор концентрированной серной кислоты в метиловом спирте (1:1) (II), 10% раствор фосфорно-молибденовой кислоты в этиловом спирте (III), раствор анисового альдегида в смеси безводной уксусной и концентрированной серной кислот (IV) и раствор бихромата калия
всерной кислоте (V). После обработки хроматографической пластинки реактивами I–V, ее затем нагревают при температуре 105–120 °С в течение 10–15 минут. Вещества на хроматограммах проявляются в виде окрашенных пятен, после чего хроматограмму просматривают в УФ-свете и отмечают наличие и характер флюоресценции.
Кортикостероиды проявляют с помощью группового реактива – трифенилтетразолия хлорида, – основываясь на его способности образовывать
окрашенную восстановленную форму в результате реакции с α-кетольной
30
