
Биохимия семестр 1
.pdfВведение в биохимию. Основные классы биомолекул. Передача информации и энергии в биологических системах.
1. Предмет биохимии. Значение биохимии в системе медицинского образования.
Биохимия - биологическая наука, изучающая химическую природу веществ, входящих в состав живых организмов, их превращения и связь этих превращений с деятельностью органов и тканей. Наука о химическом составе живых клеток и организмов и о лежащих в основе их жизнедеятельности химических процессах.
Значение биохимии. Современная биология и медицина невозможна без знаний молекулярной биологии и генетики. На их основе возникла генная инженерия и биотехнология, которые изучают возможности направленных изменений генетического аппарата. Создаются различные рекомбинантные ДНК, которые используют для синтеза физиологически активных соединений и лекарственных веществ - антибиотиков, гормонов, ферментов и других. Биохимические методы исследования широко используются для диагностики заболеваний, контроля эффективности лечения
2. Основные классы биологических молекул: нуклеотиды, аминокислоты, углеводы и липиды.
Биомолекулы – органические соединения, входящие в состав организмов, образующие клеточные структуры и участвующие в биохимических реакциях обмена веществ.
Нуклеотиды.
Каждый нуклеотид состоит из трех компонентов: азотистого основания, являющегося производным пурина или пиримидина, пентозы (рибозы или
дезоксирибозы) и остатка фосфорной кислоты.
Углеродный атом в первом положении пентозы связывается N-гликозидной связью с атомом азота в 1 положении пиримидина или 9 положении пурина. Образующиеся соединения называют нуклеозидами. Присоединение фосфата в 5'-положение пентоз приводит к образованию нуклеотидов.
Аминокислоты.
Аминокислоты – это строительные блоки макромолекул белков.
По строению они являются органическими карбоновыми кислотами, у которых, как минимум, один атом водорода замещен на аминогруппу.
Таким образом, в аминокислотах обязательно присутствует карбоксильная группа (СООН), аминогруппа (NH2), асимметричный атом углерода и боковая цепь (радикал R).
Углеводы – молекулы, состоящие из моносахаридов и их производных (дисахаридов, гомо- и гетерополисахаридов). В животных организмах моносахариды и гомополисахарид гликоген в основном исполняют энергетические функции, а гетерополисахариды принимают участие в образовании мембран, гликокаликса, соединительной ткани и т.д..
Липиды – молекулы, особенностью которых является гидрофобная природа. Липиды выступают как энергетический материал (нейтральные жиры), являются структурными компонентами мембран (фосфолипиды, гликолипиды) и биорегуляторами (стероидные гормоны, эйкозаноиды, жирорастворимые витамины).
3.Понятие о биополимерах: нуклеиновые кислоты, белки и полисахариды.
Нуклеиновые кислоты (ДНК и РНК) – биологические полимеры, элементарными звеньями (мономерами) которых являются нуклеотиды.
• Нуклеиновые кислоты выполняют функции хранения и передачи наследственной информации, а также являются основой (матрицей) для биосинтеза молекул белка.
Белки – биологические полимеры, элементарными звеньями (мономерами) которых являются аминокислоты.
• Белки лежат в основе структуры любого организма и всех протекающих в нем биохимических реакций.
Полисахариды — высокомолекулярные углеводы, полимеры моносахаридов (гликаны). Молекулы полисахаридов представляют собой длинные линейные или разветвлённые цепочки моносахаридных остатков, соединённых гликозидной связью. При гидролизе образуют моносахариды или олигосахариды.
4. Принципы строения и биологические функции нуклеиновых кислот.
Первичная структура нуклеиновых кислот (НК) — это порядок чередования нуклеотидов в полинуклеотидной цепи, связанных между собой 3',5'- фосфодиэфирной связью. В результате образуются полимеры с фосфатным остатком на 5'-конце и свободной –ОН группой пентозы на 3'-конце.
5. Принципы строения и биологические функции белков.
Объединение аминокислот через пептидные связи создает линейную полипептидную цепь, которая называется
первичной структурой белка.
Первичная структура белков, т.е. последовательность аминокислот в нем, программируется последовательностью нуклеотидов в ДНК.
Вторичная структура белка – это способ укладки полипептидной цепи в более компактную структуру, при которой происходит взаимодействие пептидных групп с образованием между ними водородных связей.
Выделяют два возможных варианта вторичной структуры: в виде "каната" – α- спираль (α-структура), и в виде "гармошки" – β-складчатый слой (β- структура). В одном белке, как правило, одновременно присутствуют обе структуры, но в разном долевом соотношении. В глобулярных белках преобладает α-спираль, в фибриллярных – β-структура.
Вторичная структура образуется только при участии водородных связей между пептидными группами.
Третичная структура – это укладка полипептидной цепи в глобулу ("клубок"). Четкой границы между вторичной и третичной структурами провести нельзя, однако в основе третичной структуры лежат взаимосвязи между радикалами аминокислот, отстоящими далеко друг от друга в цепи. Благодаря третичной структуре происходит еще более компактная укладка белковой цепи.
Аминокислоты принимают участие в формировании третичной структуры, образуя связи своими функциональными группами (радикалами), например:
•водородные – между НО-, СООН-, NH2-группами радикалов аминокислот,
•дисульфидные – между остатками цистеина,
•гидрофобные – между остатками алифатических и ароматических аминокислот,
•ионные – между СОО–-группами глутамата и аспартата и NH3+- группами лизина и аргинина,
•псевдопептидные – между дополнительными СОО–-группами глутамата и аспартата и дополнительными NH3+-группами лизина и аргинина.
6.Определение и биологическая роль ферментов.
Ферменты – биологические катализаторы.
•Катализаторы – вещества, ускоряющие протекание химических реакций.
•Ферменты – катализаторы белковой природы.
•Большинство биохимический реакций в клетке не могли бы происходить в отсутствии ферментов.
•Таким образом, ферментативный катализ является основой протекания всех метаболических процессов и, соответственно, существования жизни как таковой.
8. Метаболические пути. Понятие о метаболизме. Энергетическое обеспечение метаболических процессов. Роль макроэргических соединений. Пути использования энергии АТФ.
Метаболизм – высоко координированная и целенаправленная клеточная активность, включающая два неразрывных процесса – катаболизм и анаболизм.
Катаболизм – расщепление и окисление сложных органических молекул до более простых конечных продуктов.
•Оно сопровождается высвобождением энергии, заключенной в сложной структуре веществ (точнее, в их химических связях).
•Большая часть высвобожденной энергии рассеивается в виде тепла.
•Остальная часть энергии, высвобождаемая в реакциях катаболизма, может запасается в виде химических связей, называемых макроэргическими.
•Основной и универсальной молекулой, которая запасает энергию и при необходимости отдает ее, является АТФ.
Главными источниками субстратов для реакций катаболизма являются питательные вещества, поступающие с пищей – углеводы, жиры и белки.
•После поступление этих веществ в организм происходит их последовательный распад на более простые органические соединения (метаболиты), вступающие затем в различные пути метаболизма (в том числе катаболизма).
•Специфические пути распада этих метаболитов объединяются, образуя общий путь катаболизма.
В ходе общего пути катаболизма субстраты (промежуточные метаболиты) могут полностью окисляться до СО2 и Н2О.
• Кислород в этом процессе используется как акцептор водорода от
окисляемых (дегидрируемых) веществ (субстратов), в результате
чего синтезируется Н2О.
• Таким образом, катаболизм органических веществ в тканях
сопровождается потреблением кислорода и выделением СО2. Этот процесс называют тканевым (клеточным) дыханием.
Анаболизм – это биосинтез белков, полисахаридов, липидов, нуклеиновых кислот и других макромолекул из малых молекул-предшественников.
•Поскольку он сопровождается усложнением структуры веществ, то требует затрат энергии.
•Источником энергии для анаболических процессов являются химические связи в молекуле АТФ. Также для биосинтеза некоторых веществ (жирные кислоты, холестерол) требуются богатые энергией атомы водорода – их источником является НАДФН.
Роль АТФ
Энергия, высвобождаемая в реакциях катаболизма, запасается в виде связей, называемых макроэргическими. Основной и универсальной молекулой, которая запасает энергию и при необходимости отдает ее, является АТФ.
Все молекулы АТФ в клетке непрерывно участвуют в каких-либо реакциях, постоянно расщепляются до АДФ и вновь регенерируют.
Существует три основных способа использования АТФ:
биосинтез веществ,
транспорт веществ через мембраны,
изменение формы клетки и ее движение.
2-3.Классификация и строение нуклеиновых кислот. Уровни компактизации генетического материала. Репликация и репарация ДНК. Репликация и репарация: механизмы и биомедицинское значение. Этапы реализации генетической информации.
1. Строение и функции нуклеиновых кислот. Первичная, вторичная и третичная структура ДНК.
Основные отличия ДНК и РНК.
Первичная структура нуклеиновых кислот
В состав ДНК и РНК входит четыре основных нуклеотида: два пуриновых идва пиримидиновых.
Для краткого изображения последовательности нуклеотидов в нуклеиновых кислотах пользуются однобуквенным кодом. При этом запись осуществляют слева направо, так что первый нуклеотид имеет свободный 5'- фосфатный конец, а последний –ОН- группу в 3'-положении рибозы или дезоксирибозы.
Иногда полинуклеотидная цепь имеет противоположное направление, в этих случаях направление цепей обязательно указывается от 5'-→3'- или от 3'-→5' концу.
ДНК
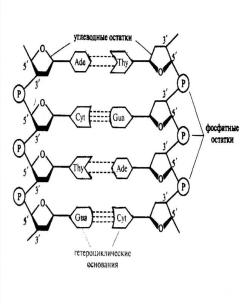
Вторичная структура ДНК представлена правозакрученной спиралью, в которой две полинуклеотидные цепи расположены антипараллельно и удерживаются относительно друг друга за счет взаимодействия между комплементарными, азотистыми основаниями.
Цепи молекулы ДНК не идентичны, но комплементарны друг другу: если известна первичная структура одной цепи, то последовательность нуклеотидовдругой цепи задается
правилом комплементарности оснований: А одной цепи соответствует Т, а С — G в другой цепи.
Поэтому в молекуле ДНК количество адениловых нуклеотидов равно количеству тимидиловых нуклеотидов (А
=Т), а количество гуаниловых равно количеству цитидиловых нуклеотидов (G
=С).
Соотношение А + Т / G + С — величина постоянная и является видоспецифической характеристикой организма (правило Чаргаффа).
Комплементарные основания обращены внутрь молекулы и лежат в одной плоскости, которая практически перпендикулярна оси спирали. Между основаниями в стопке возникают гидрофобные взаимодействия, обеспечивающиет основной вклад в стабилизацию структуры спирали. Рибозофосфатные остатки ограничивают спираль и образуют ее остов. На один виток спирали приходится 10 нуклеотидных пар

Третичная структура ДНК формируется в результате ее взаимодействия с белками. Каждая молекула ДНК упакована в отдельную хромосому, в составе которой разнообразные белки связываются с отдельными участками ДНК и обеспечивают суперспирализацию и компактизацию молекулы
Общая длина ДНК гаплоидного набора из 23 хромосом человека составляет 3,5х 109 пар нуклеотидов. Хромосомы образуют компактные структуры только в фазу деления. В период покоя комплексы ДНК с белками распределены равномерно по объему ядра, образуя хроматин. Белки хроматина включают две группы: гистоны и негистоновые белки.
Гистоны — это небольшие белки с молекулярной массой от 11 000 до 22 000 Д и высоким содержанием лизина и аргинина. Четыре типа гистонов в количестве 8 молекул (по две каждого вида) образуют комплекс — нуклеосомный кор. Этот комплекс за счет ионных связей взаимодействует с отрицательно заряженными фосфатными группами участка ДНК длиной около 146 нуклеотидных пар (примерно полтора витка вокруг кора) и образует четковидную, компактную структуру, называемую нуклеосомой. Между нуклеосомами находится участок ДНК длиной около 30 нуклеотидных пар — линкерный участок, к которому присоединяется молекула гистона Н1. Негистоновые белки представлены множеством ферментов и белков, участвующих в синтезе ДНК, РНК, регуляции этих процессов и компактизации ДНК.
РНК
Вторичная структура РНК формируется в результате спирализации отдельных участков одноцепочечной РНК. В спирализованных участках, или шпильках, комплементарные пары азотистых оснований А и U, G и С соединены водородными связями. Длина двойных спиралей, как правило, не велика и содержит от 20 до 30 нуклеотидных пар. Двуцепочечные фрагменты чередуются с неспирализованными участками молекулы, образующими петли.
Третичная структура РНК образуется за счет дополнительных водородных связей между нуклеотидами, полинуклеотидной цепью и белками, обеспечивает дополнительную компактизацию и стабилизацию пространственной структуры молекулы.

2.Уровни структурной организации хроматина. Роль гистоновых и негистоновых белков в компактизации ДНК.
Первый уровень укладки ДНК в хроматине обеспечивается нуклеосомами. Они представляют собой округлые частицы диаметром 15 нм, которые связаны между собой участками ДНК длиной около 20 нм. Отдельная нуклеосома состоит их белковой сердцевины, на которую накручена молекула ДНК. Молекула ДНК в виде левозакрученной суперспирали совершает 1,75 оборота вокруг сердцевины. При этом в непосредственный контакт с гистонами вступает 146 пар нуклеотидов. Длина линкерной ДНК, соединяющей соседние нуклеосомы, колеблется в пределах 40 70 пар нуклеотидов в зависимости от типа клетки. Таким образом, на одну нуклеосому приходится в среднем около 200 пар нуклеотидов ДНК.
Второй уровень укладки ДНК обеспечивается взаимодействием
линкерной ДНК с гистономH1.
Молекула гистонаH1 своим глобулярным доменом связывается с двумя витками ДНК на нуклеосоме. Одновременно C- концевой фибриллярный домен гистонаH1 вступает в контакт с линкерной ДНК. В результате соседние нуклеосомы приближаются друг к другу, формируя группы из 6 8 частиц – нуклеомеры (супербусины) диаметром
25 30 нм.
Третий уровень укладки ДНК представлен хроматиновыми фибриллами диаметром 30 нм, которые хорошо видны в электронном микроскопе в интерфазных ядрах и митотических хромосомах. Они имеют суперспиральную структуру и содержат максимально сближенные между собой нуклеомеры. В формировании фибрилл диаметром 30 нм принимают участие
гистонH1, а также негистоновые белки сHMG-доменом.
Четвертый уровень укладки ДНК обеспечивается взаимодействием фибрилл диаметром 30 нм с ядерным матриксом. При этом формируются
петлевые домены.
Петлевые домены являются типовой структурно-функциональной единицей хроматина. Домен во многом автономен, независимо реплицируется и транскрибируется. Петлевые домены обеспечивают компактизацию молекулы ДНК в 700 раз.
Пятый уровень укладки ДНК связан с формированием групп из 18-20 петлевых доменов, прикрепленных в виде розетки к общему центру из белков ядерного матрикса. Розетки из петлевых доменов находятся в хроматине в компактном состоянии, образуя округлые гранулы диаметром около 150 нм –хромомеры.
Шестой уровень укладки ДНК определяется формированием хромонемы– фибриллярной структуры диаметром 200 300 нм, состоящей из плотно упакованных хромомеров. В хроматине интерфазного ядра хромонемы обычно не выявляются. Они становятся видимыми только при конденсации хроматина в профазе митоза, а также в ранней телофазе при деконденсации хромосом. Хромомерный и хромонемный уровни укладки позволяют укоротить длину молекулы ДНК в 10 000 раз.
Седьмой уровень укладки ДНК состоит в образовании хроматид
(однохроматидных хромосом) из хромонем.
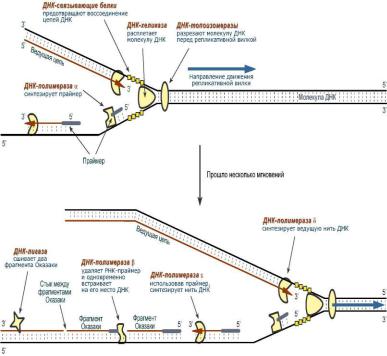
Репликация ДНК.
В хронологическом порядке события репликации развертываются примерно следующим образом:
1.ДНК-топоизомеразы, находясь перед репликативной вилкой, разрезают молекулу ДНК для облегчения ее расплетания и раскручивания.
2.ДНК-хеликазы, следуя за топоизомеразами, раскручивают и расплетают молекулу ДНК.
3.ДНК-связывающие белки (ДСБ) связывают расплетенные нити ДНК и стабилизируют их, не допуская обратного "слипания" друг с другом.
4.ДНК-полимераза δ (греч.: δ – дельта), согласовано со скоростью движения репликативной вилки, осуществляет синтез ведущей цепи дочерней ДНК в направлении 5'→3' на матрице материнской нити ДНК по направлению от ее 3'-конца к 5'-концу (скорость до 100 пар нуклеотидов в секунду).
Этим события на данной материнской нити ДНК ограничиваются.
Далее описан синтез отстающей цепи дочерней ДНК.
5. Непосредственно сразу после расплетания и стабилизации другой нити материнской молекулы к ней присоединяется ДНК-полимераза α (α- альфа ) и в направлении 5'→3' синтезирует праймер (РНК-затравку) – последовательность РНК на матрице ДНК длиной от 10 до 200 нуклеотидов. После этого фермент удаляется с нити ДНК.
Вместо ДНК-полимеразы α к 3'-концу праймера присоединяется ДНКполимераза ε.
6. ДНК-полимераза ε (греч.: ε – эпсилон) как бы продолжает удлинять праймер, но в качестве субстрата встраивает дезоксирибонуклеотиды (в количестве
150-200 нуклеотидов). В результате образуется цельная нить из двух частей – РНК (т.е. праймер) и ДНК. ДНКполимераза ε работает до тех пор, пока не встретит праймер предыдущего фрагмента Оказаки (синтезированный чуть ранее). После этого данный фермент удаляется с цепи.
7. ДНК-полимераза β (греч.: β – бета) встает вместо ДНК-полимеразы ε, движется в том же направлении (5'→3') и удаляет рибонуклеотиды праймера, одновременно встраивая дезоксирибонуклеотиды на их место. Фермент работает до полного удаления праймера, т.е. пока на его пути не встанет дезоксирибонуклеотид (еще более ранее синтезированный ДНК-полимеразой ε). Связать результат свой работы и впереди стоящую ДНК фермент не в состоянии, поэтому он сходит с цепи.
В результате на матрице материнской нити "лежит" фрагмент дочерней ДНК. Он называется фрагмент Оказаки.
8. ДНК-лигаза производит сшивку двух соседних фрагментов Оказаки, т.е. 5'- конца отрезка, синтезированного ДНКполимеразой ε, и 3'-конца цепи, встроенного ДНК-полимеразой β.

Повреждения и репарация ДНК
Так как на геном любой неделящейся клетки постоянно оказывает влияние окружающая среда, то вполне вероятны повреждения в составе нуклеотида, также возможно встраивание неправильного нуклеотида при репликации.
Под влиянием этих физических и химических факторов в структуре ДНК происходит:
•дезаминирование оснований (из цитозина образуется урацил);
•депуринизация — гидролитическое отщепление пуриновых оснований;
•образование пиримидиновых димеров;
•разрыв нуклеотидных цепей;
•появление ковалентных сшивок между цепями или между цепями и гистонами;
•включение некомплементарного основания, вызванное ошибками репликации.
Универсальная система репарации работает следующим образом.
•Специфическая эндонуклеаза обнаруживает нарушение комплементарности и гидролитически расщепляет 3',5'-фосфодиэфирную связь в поврежденной нити ДНК.
•Экзонуклеаза удаляет около 30 нуклеотидных остатков по обе стороны от места разрыва.
•К 3'-концу образовавшейся «бреши» присоединятся ДНК-полимераза β и ,используя дНТФ в качестве субстратов и доноров энергии, заполнят «брешь».
•Одиночный разрыв между вновь синтезированной и основной нитями ДНК устраняет ДНК-лигаза, использующая АТФ в качестве источника энергии.
В ряде случаев в репарации участвуют и некоторые другие ферменты.
Так, если произошло дезаминирование азотистых оснований (например, цитозин превратился в урацил), то некомплементарное основание может удалять фермент ДНК-гликозилаза. Затем участок, лишенный азотистого основания (АП-сайт), об наруживает
АП-эндонуклеаза, гидролизующая апуринизированный или апиримидинизированный сахарофосфатный остов, а далее работает универсальный механизм репарации.
Иногда к дезоксирибозе, лишившейся поврежденного основания — АП-сайта, фермент ДНК-инсертаза присоединяет основание по принципу комплементарности, ликвидируя повреждение в структуре ДНК.
Под влиянием УФО возникают пиримидиновые димеры (чаще всего тиминовые димеры), за счет связывания двух соседних оснований. Это повреждение устраняет фермент фотолиаза. Она расщепляет связи между соседними основаниями и восстанавливает нативную структуру ДНК. Свет активирует фермент и таким образом ускоряет этот процесс.

4. Транскрипция и трансляция.
Генетический код и его свойства. Перспективы использования генной терапии в лечении заболеваний.
Основные виды РНК их функции.
Типы РНК и их функции |
|
матричные РНК |
являются формой |
(мРНК) |
передачи |
|
информации о |
|
первичной |
|
структуре белка; |
рибосомальная РНК |
формируют основу |
(рРНК) |
структуры рибосом |
|
и |
|
катализ трансляции |
|
белка; |
транспортная РНК |
выполняют роль |
(тРНК) |
«адаптора» между |
|
мРНК и |
|
аминокислотами в |
|
ходе синтеза белка; |
|
|
микроРНК |
регуляция генной |
|
экспрессии |
другие |
регуляция генной |
некодирующие |
экспрессии, другие |
РНК |
малоизученные |
|
функции |
Типы РНК-полимераз. |
|
Типы РНК-полимераз и транскрибируемые ими гены
РНК-полимераза I |
• большинство |
|
генов |
|
рибосомальной |
|
РНК |
|
(рРНК); |
|
|
РНК-полимераза II |
• все гены, |
|
кодирующие |
|
белки; |
|
• гены микроРНК; |
|
• гены некоторых |
|
некодирующих |
|
РНК; |
|
|
РНК-полимераза III |
гены транспортной |
• гены других малых |
РНК (тРНК); |
РНК; |
• некоторые гена |
|
рибосомальной |
|
РНК (рРНК); |
|
|
Генетический код и его свойства.
Генетический (биологический) код – это способ кодирования информации о строении белков в виде нуклеотидной последовательности. Он предназначен для перевода четырехзначного языка нуклеотидов (А, Г, У, Ц) в двадцатизначный язык аминокислот. Он обладает характерными особенностями:
•Триплетность – три нуклеотида формируют кодон, кодирующий аминокислоту. Всего насчитывают 61 смысловой кодон.
•Специфичность (или однозначность) – каждому кодону соответствует только одна аминокислота.
•Вырожденность – одной аминокислоте может соответствовать несколько кодонов.
•Универсальность – биологический код одинаков для всех видов организмов на Земле (однако в митохондриях млекопитающих есть исключения).
•Колинеарность – последовательность кодонов соответствует последовательности аминокислот в кодируемом белке.
•Неперекрываемость – триплеты не накладываются друг на друга, располагаясь рядом.
•Отсутствие знаков препинания – между триплетами нет дополнительных нуклеотидов или каких-либо иных сигналов.
Однонаправленность – при синтезе белка считывание кодонов идет последовательно, без пропусков или возвратов назад.
