
- •Глава 1. Общие положения
- •1.1. Основные параметры состояния
- •1.2. Уравнение состояния идеального газа
- •1.3. Уравнения состояния реальных газов
- •Глава 2. Первый закон термодинамики
- •2.1. Виды энергии
- •2.2. Аналитическое выражение первого закона термодинамики
- •2.3. Теплоемкость газов
- •2.4. Энтальпия
- •2.5. Энтропия идеального газа
- •3.1. Круговые процессы или циклы
- •3.2. Общие свойства обратимых и необратимых циклов
- •3.3. Изменение энтропии в обратимых и необратимых процессах
- •3.4. Принцип возрастания энтропии
- •3.7. Эксергетический баланс и эксергетический кпд
- •6.1. Основные термодинамические процессы изменения состояния водяного пара
- •7.2. Циклы газотурбинных установок
- •8.1. Циклы воздушных холодильных установок
- •8.2. Циклы паровой компрессорной холодильной установки
1.2. Уравнение состояния идеального газа
Объектом исследования в технической термодинамике является термодинамическая система – совокупность материальных тел, находящихся в тепловом и механическом взаимодействии друг с другом и окружающей средой.
Процесс преобразования энергии в технических устройствах осуществляется при участии рабочего тела. В качестве рабочего тела рассматривается реальный или идеальный газы.
Идеальным называется воображаемый газ, молекулы которого представляют собой материальные точки, объем которых мал по сравнению с объемом, занимаемым газом, и отсутствуют силы взаимодействия (притяжения и отталкивания).
Уравнением
состояния называется функциональная
зависимость вида
 .
.
Это
уравнение устанавливает связь между
термодинамическими параметрами системы
(рабочего тела) в равновесном состоянии.
Вид функции зависит от природы вещества
и диапазона изменения параметров
состояния. Относительно просто такую
функцию можно получить для идеального
газа путем совместного решения уравнений
(1.1) и (1.2). Подставив уравнение (1.1) в
формулу (1.2), получим
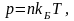 (1.3)
(1.3)
где n – число молекул в единице объема:
 .
(1.4)
.
(1.4)
Здесь N общее число молекул в объеме V:
 ,
(1.5)
,
(1.5)
где m – масса газа в объеме V; µ − молярная масса;
NA = 6,02 1023 1/моль – число Авогадро.
Подставив
выражение (1.5) в формулу (1.4), получим
 (1.6)
(1.6)
а подстановка в формулу (1.3) дает:
 (1.7)
(1.7)
где
 − универсальная газовая постоянная.
− универсальная газовая постоянная.
Окончательно из формулы (1.7) получим уравнение, которое является уравнением состояния для m кг идеального газа:
 ,
(1.8)
,
(1.8)
где
 − газовая постоянная данного газа.
− газовая постоянная данного газа.
Разделив правую и левую части (1.8) на m, получим уравнение состояния для 1 кг идеального газа:
 (1.9)
(1.9)
Умножив
правую и левую части (1.9) на µ, получим
уравнение состояния для 1 моля
идеального газа
 (1.10)
(1.10)
где
 − объем 1 моля газа, м3/моль.
− объем 1 моля газа, м3/моль.
Уравнения (1.8) и (1.9) называются уравнениями Клапейрона, а выражение (1.10) − уравнением КлапейронаМенделеева.
При T = const уравнение (1.9) вид закона БойляМариотта:
 и тогда
и тогда
 .
.
При p = const уравнение (1.9) принимает вид закона Гей-Люссака:
 .
.
При
 уравнение (1.9) принимает вид закона
Шарля:
уравнение (1.9) принимает вид закона
Шарля:
 .
.
Многие реальные газы при давлениях, близких к атмосферному, ведут себя как идеальный газ, поэтому уравнением состояния идеального газа пользуются при решении многих практических задач. Однако для некоторых состояний реального газа (высокое давление или низкая температура) применение уравнений (1.8) – (1.10) приводит к большим ошибкам. По мере повышения давления, или при понижении температуры газ сжимается, и расстояние между молекулами уменьшается. В результате силы взаимодействия начинают проявлять себя в большей степени и поведение реального газа все больше отклоняются от поведения идеального газа.
Необходимо отметить, что полученные соотношения справедливы для индивидуальных веществ, молекулярная масса которых известна. В реальных условиях мы, как правило, имеем дело со смесями газов (например, атмосферный воздух представляет собой смесь большого количества отдельных газов: азот, кислород, углекислый газ, водяной пар и др.).
Смесь газов состоит из отдельных газов, не вступающих между собой в химические реакции. Каждый газ в смеси ведет себя так, как если бы он один занимал весь объем смеси. Молекулы каждого газа оказывают на стенки сосуда давление, которое называется парциальным. Поведение смесей идеальных газов подчиняется закону Дальтона, то есть общее давление смеси газов равно сумме парциальных давлений отдельных газов, составляющих смесь:
 ,
(1.11)
,
(1.11)
где p1, p2,….., pn – парциальные давления отдельных газов.
Поведение реальных газов не подчиняется закону Дальтона. Отклонение тем больше, чем выше давление.
Газовые смеси могут задаваться массовыми, объемными и мольными долями.
Массовая
доля − это отношение массы i-го
газа mi
к массе смеси mсм:
 ;
;
 …
…

Очевидно, что m1 + m2 +…+ mn = mсм;
 .
(1.12)
.
(1.12)
Объемная доля − это отношение парциального (приведенного) объема i-го газа Vi к объему смеси Vсм:
 ;
;
 …
…

Парциальный объем − это объем, который занимал бы данный компонент при температуре и давлении смеси. Его можно определить из закона БойляМариотта. Для каждого газа, входящего в смесь:
V1 = рсм Vсм /р1; V2 = рсм Vсм /р2; Vn = рсмVсм /рn,
Общий объем смеси Vсм идеальных газов равен сумме парциальных объемов всех составляющих смесь газов (закон Амага):

 (1.13)
(1.13)
Мольная
доля − это отношение числа молей газа
к числу молей смеси:
 ,
,
где
 и
и
 ,
,
где i − молярная масса газа; см – молярная масса смеси.
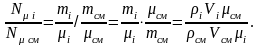 (1.14)
(1.14)
Из закона Авогадро и уравнения Клапейрона–Менделеева при одинаковых температурах и давлениях
 (1.15)
(1.15)
Следовательно, равенство (1.14) можно записать как

То есть задание смеси мольными долями равнозначно заданию ее объемными долями.
Соотношение между массовыми и объемными долями определяется следующим образом:
 (1.16)
(1.16)
или, с учетом формулы (1.15):
 (1.17)
(1.17)
Отсюда
 (1.18)
(1.18)
Состояние идеальных газов описывается уравнением Клапейрона
pV = mRT.
Смесь идеальных газов, состоящая из n компонентов, описывается уравнениями
p1Vсм = m1R1Tсм;
p2Vсм = m2R2Tсм;
pnVсм = mnRnTсм.
После сложения получим
(p1 + p2 + … + pn)Vсм = (m1R1 + m2R2 + … + mnRn)Tсм.
Разделим обе части равенства на массу смеси mсм:
 (1.19)
(1.19)
Из
уравнений (1.18) и (1.13) следует
 а
а
 .
.
Отсюда
 (1.20)
(1.20)
Подставив формулу (1.20) в уравнение (1.19), получим уравнение состояния смеси pсмVсм = mсмRсмTсм.
Газовую постоянную смеси можно выразить также через объемные доли. Из уравнений (1.12) и (1.17) получим
 ;
;

 (1.21)
(1.21)
Если известна газовая постоянная смеси Rсм, можно определить ее молярную массу:
 ,
кг/моль. (1.22)
,
кг/моль. (1.22)
Если
смесь задана массовыми долями,
 определяется
из равенств (1.17) и (1.13):
определяется
из равенств (1.17) и (1.13):
 ;
;
 ;
;
 ;
;

Если
смесь задана объемными долями, см
определяется из равенств (1.12) и (1.17):
 ,
,
 ,
,
 (1.23)
(1.23)
Отсюда
 (1.24)
(1.24)
