
Obschaya_khimia_-_lektsii
.pdf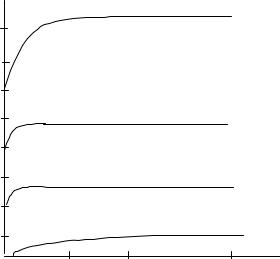
λm 10– 4,См м2 моль– 1
390 |
|
HCl |
|
|
|
340 |
|
|
290 |
|
|
240 |
|
KOH |
190 |
|
|
140 |
KCl |
|
90 |
|
|
40 |
|
CH3COOH |
|
|
|
20 |
|
1/С,л/моль |
200 |
500 |
1000 |
Рис.2. Зависимость молярной электрической проводимости от концентрации раствора для некоторых электролитов
Молярная электрическая проводимость при данном разбавлении λm всегда меньше значения предельной молярной электрической проводимости λ0m . Отношение этих величин, т. е. λm/λ0m характеризует:
а) для слабого электролита — степень его диссоциации при данной
концентрации раствора, т. е. λλ0m = α (соотношение Аррениуса);
m
б) для сильного электролита — коэффициент активности (fa) при |
||
данной концентрации, т. е. |
λm |
= fa . |
|
λ0m |
|
Полагая, что при бесконечном разбавлении растворов слабых электролитов α ≈ 1, а растворов сильных электролитов fa ≈ 1, уравнения (8), (9) примут следующий вид:
λ0m = F (ωА + ωK). |
(10) |
Следовательно, при бесконечном разбавлении растворов электролитов их молярная электрическая проводимость зависит только от абсолютных скоростей движения ионов к электродам. Так как U = F · ω, то:
λ |
0m = UK + UA. |
(11) |
Из последнего уравнения |
следует, что сумма подвижностей катиона |
|
и аниона равна молярной электрической проводимости при бесконечном разведении.
Часто подвижность катиона UK обозначают λ0K и называют предельной проводимостью катиона, а подвижность аниона UA обозначают λ0A и
91
называют предельной подвижностью аниона. Тогда уравнение (11) имеет следующий вид:
λ 0m = λ0K + λ 0A |
(12) |
Отсюда следует, что сумма предельных проводимостей катиона и аниона равна молярной электрической проводимости электролита при бесконечном разведении.
Например, предельная молярная электрическая проводимость уксусной кислоты будет равна: λ0m (CH3COOH)= λ0m (H+)+ λ0 (CH3COO–).
Кондуктометрия Кондуктометрия — это совокупность физико-химических методов,
основанных на измерении сопротивления изучаемых объектов, представляющих собой проводники второго рода. По значению сопротивления раствора электрическому току, протекающему между двумя электродами, погруженными в раствор, определяют электрическую проводимость. При помощи кондуктометрии можно определить концентрацию растворенного вещества, константу и степень диссоциации слабого электролита, растворимость и произведение растворимости труднорастворимых веществ, ионное произведение воды и другие физико-химические величины.
Кондуктометрическое определение степени и константы диссоциации слабого электролита.
1.Определяют удельную электрическую проводимость слабого электролита и рассчитывают молярную электрическую проводимость при
данном разбавлении: |
λm = |
æ |
с |
2. Рассчитывают молярную электрическую проводимость при бесконечном разбавлении, т. е. значение предельной молярной электропрово-
димости λ0m . Предельные молярные электропроводимости катионов λ0k и анионов λ0A находят в справочных таблицах.
λ0m = λ0k + λ0A
3.Для слабых электролитов степень их диссоциации (α) рассчиты-
вают по формуле: |
|
|
|
|
α = |
λ0m |
|
|
|
|
|
|
|
|
λ |
|
|
|
|
|
|
|
m |
4. Подставляя это соотношение в уравнение закона разбавления |
|||||||
Оствальда: |
Кдис. |
= |
α2C |
|
|
|
|
|
|
|
|
1−α |
|
|
|
получают: |
|
(λ |
/ λ0 )2 C |
|
|||
Кдис. = 1−(λ |
/ λ0 |
) |
|
|
|||
|
|
m |
|
m |
|
|
|
m m
Кондуктометрическое титрование. При кондуктометрическом титровании измеряют электрическую проводимость раствора до титрования и по мере добавления небольших определенных объемов титранта.
92
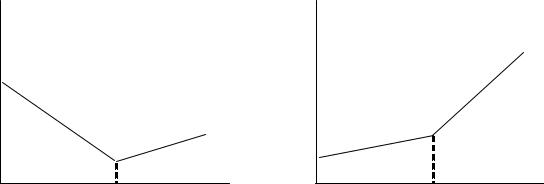
Точку эквивалентности находят графическим методом с помощью кривой в координатах æ — V титранта.
æ |
æ |
А |
|
В |
С |
|
|
т.э. |
V(NaOH) |
|
а |
|
С |
В |
|
А |
|
т.э. |
V(NaOH) |
|
|
б |
|
Рис. 3. Кривые кондуктометрического титрования
На рис. 3 приведены кривые зависимости удельного электрической проводимости æ от объема приливаемого титранта. При титровании сильной кислоты сильным основанием (рис. 3а) на кривой титрования образуется минимум (точка эквивалентности), соответствующий замене ионов водорода на менее подвижные ионы образующейся соли (ветвь АВ):
H+ + Cl– + Na+ + OH– = H2O + Na+ + Cl–
После точки эквивалентности начинается резкий подъем электрической проводимости (ветвь ВС) т. к. в растворе будет нарастать концентрация ионов Na+ и ОН–.
При титровании слабой кислоты сильным основание (рис. 3б) увеличивается электрическая проводимость раствора, что объясняется значительной диссоциацией образующейся соли по сравнению с диссоциацией исходного вещества (ветвь АВ):
CH3COOH + Na+ + OH– = H2O + CH3COO– + Na+.
После точки эквивалентности начинается резкий подъем электрической проводимости (ветвь ВС) т. к. в растворе будет нарастать концентрация ионов Na+ и ОН–.
Кондуктометрическое титрование используют для определения концентрации окрашенных, мутных растворов, в которых изменение цвета индикатора маскируется, в том числе и в биологических жидкостях.
93
Лекция 15 Гетерогенные равновесия. Константа растворимости.
Условия образования и растворения осадков. Совмещенные химические равновесия в гетерогенных системах
Гетерогенные равновесия — это равновесия, которые устанавливаются в гетерогенных системах. Гетерогенные системы состоят из нескольких фаз, разделенных реальными физическими границами раздела фаз. Примеры гетерогенных систем: газ - жидкость, твердое тело — жидкость, твердое тело-газ. Гетерогенные системы всегда многофазные. Фаза — это часть системы с одинаковыми химическими и физическими свойствами.
Константа растворимости. Рассмотрим гетерогенную систему, состоящую из малорастворимого осадка сильного электролита и насыщенного раствора над ним, между которыми устанавливается динамическое химическое равновесие. При контакте осадка (например, BaSO4) с водой в системе протекают процессы:
1)растворения –– полярные молекулы воды переводят часть ионов из кристаллической решетки BaSO4 в жидкую фазу;
2)осаждения –– под влиянием электростатического поля кристалли-
ческой решетки BaSO4 часть ионов Ва2+ и SO24− переходят из жидкой фазы
втвердую, достраивая кристаллическую решетку соли.
Стечением времени скорость растворения станет равной скорости осаждения и установится динамическое равновесие между кристаллическим осадком малорастворимой соли BaSO4 и его водным раствором, со-
держащим ионы Ва2+(p) и SO24− (p):
BaSO4(к) Ba2+(p) + SO42− (p) |
(1) |
Раствор, находящийся в равновесии с твердой фазой, состоящей из BaSO4, называют насыщенным относительно осадка. Такой раствор представляет собой равновесную гетерогенную систему.
Применим к этому равновесному гетерогенному процессу закон действующих масс. Так как ВаSO4 — малорастворимый сильный электролит, то используем кажущуюся концентрацию (активность):
Кх.р. = |
aBa2 + (p) aSO42 − |
(p) |
(2) |
aBaSO4 (k) |
|
||
|
|
|
В химии активность а твердой фазы принято считать равной единице и она является постоянной величиной. Произведение двух констант дает новую постоянную величину, которую называют термодинамической
константой растворимости и обозначают К0S.
94
а |
= 1, тогда Кx.p aBaSO |
(к) = aBa 2 + |
( р) |
aSO42 − ( р) , т. е. |
||||||
BaSO4 |
1442443 |
|
|
|
|
|||||
|
|
Ks0 |
|
|
|
|
|
|
|
|
|
K 0 |
= = a |
Ba |
2 + |
( р) |
a |
2 − |
( р) |
|
(3) |
|
s |
|
|
|
SO4 |
|
|
|||
Эту величину часто называют произведением растворимости и обозначают ПР.
Таким образом, в насыщенном растворе малорастворимого сильного электролита произведение равновесных активностей его ионов есть величина постоянная при данной температуре.
Раствор, находящийся в равновесии с осадком BaSO4 является насыщенным, но сильно разбавленным. В разбавленных растворах сильных электролитов коэффициент активности fa →1, и a → С. В таком случае активности ионов можно заменить их молярными концентрациями и термо-
динамическая константа растворимости Ks0 перейдет в концентрационную константу растворимости KS.
Уравнение (3) будет иметь вид: |
|
KS = C(Ba2+) C(SO42− ), |
(4) |
где С — равновесные концентрации катионов и анионов (моль/л) в насыщенном растворе малорастворимого сильного электролита.
Если малорастворимый сильный электролит образует при диссоциации несколько ионов, то в выражения Ks0 и KS входят активности (кон-
центрации) ионов в соответствующих степенях. Примеры:
Ag2CrO4 2Ag+ + CrO24− ; Ks0 = a2(Ag+) a( CrO24− ); Ks = С2(Ag+) С( CrO24− ); PbCl2 Pb2+ + 2Cl–; Ks0 = a(Pb2+) a2(Cl–); Ks = С(Pb2+) С2(Cl–).
Для упрощенных расчетов пользуются концентрационными константами растворимости KS, принимая fa = 1.
В общем виде концентрационная константа растворимости для ре-
акции АmВn mАn+ + nВm– запишется: |
|
КS = СAmn CBnm− · |
(5) |
Для упрощения расчетов пользуются концентрационными констан-
тами КS , принимая fa = 1.
Взаимосвязь между растворимостью и КS0. Растворимость веще-
ства — это равновесная концентрация ее в растворе. Количественно растворимость различных веществ выражается концентрацией насыщенных растворов. Растворимость данного вещества равна его молярной концентрации в насыщенном растворе (молярная растворимость вещества): S моль/л. Растворимость часто также выражают в граммах растворенного
95
вещества на 100 г растворителя или в граммах растворенного вещества на 1 л раствора.
Растворимость твердых веществ зависит от природы растворенного вещества, растворителя, температуры и т. д.
Связь между величиной Ks0 и растворимостью зависит от числа ионов,
на которые распадается малорастворимый сильный электролит в растворе. Рассмотрим несколько примеров расчета молярной растворимости малорас-
творимого сильного электролита по величине его Ks0 , при условии Ks0 = Ks: 1. Бинарный электролит:
AgCl(к) Ag+(p)+ Cl–(p)
Ks(AgCl)= C(Ag+) С(Cl–) = 1,8 10–10.
В состоянии равновесия в соответствии с условием реакции: C(Ag+) = C(Cl–) = S(AgCl).
Выразим величину Ks соли через значение ее растворимости: Ks(AgCl) = S2(AgCl), следовательно:
S(AgCl) = Ks (AgCl) = |
1,8 10−10 |
=1,3 10−5 (моль/л). |
|||||
2. Трехионный электролит: |
|
|
|
|
|
||
Ag2CrO4(к) 2Ag+(p) + CrO42− (p); |
|
|
|||||
2 + |
|
CrO2 |
− |
|
|
–12 |
. |
Ks(Ag2CrO4)= C (Ag |
) C( |
4 |
|
) = 1,1 10 |
|||
В состоянии равновесия в соответствии с уравнением реакции: C( CrO24− ) = S(Ag2CrO4); C(Ag+) = 2S(Ag2CrO4)
Выразим величину Ks соли через значения ее растворимости
Ks(Ag2CrO4) = (2S)2 S = 4s3(Ag2CrO4), следовательно:
|
K |
(Ag |
CrO |
4 |
) |
= 3 |
1,1 10−12 |
|
|
|
S(Ag2CrO4) = 3 |
s |
2 |
|
|
|
|
= 6,5 10–5 |
(моль/л). |
||
|
4 |
|
|
|
4 |
|||||
|
|
|
|
|
|
|
|
|||
В общем виде зависимость между Ks и S малорастворимого сильного электролита типа AmBn выражается следующим уравнением:
S (A |
B ) = m+n |
Ks (Am Bn ) |
(6) |
|
mm nn |
||||
m |
n |
|
Сравнивая величину Ks0 однотипных (1 моль разных малораствори-
мых сильных электролитов образует при растворении одинаковое число моль ионов) электролитов можно качественно оценить растворимость осадков.
Осадок |
Ks0 |
(25 ºС) |
|
|
AgCl |
|
|
–10 |
Из приведенных галогенидов серебра наи- |
AgBr |
1,8 10 |
–13 |
менее растворим AgI, наиболее — AgCl |
|
|
|
|||
AgI |
5,3 10 |
–17 |
|
|
|
|
|
||
|
8,3 10 |
|
|
|
96
Условия образования и растворения осадков
Зная концентрации ионов в растворе, можно предположить направление гетерогенного процесса. Пусть у нас имеется равновесная гетеро-
генная система: AgCl Ag+ + Cl–. В этой системе насыщенный раствор будет при условии, если С(Ag+)·С(Сl–) = КS. В другом случае раствор бу-
дет ненасыщенным, если С(Ag+)·С(Сl–) < КS. Происходит растворение осадка или сдвиг равновесия в данной гетерогенной системе вправо. Оса-
док AgCl будет выпадать, когда С(Ag+)·С(Сl–) > КS.
Таким образом, осадок выпадает в том случае, если произведение концентрации ионов малорастворимого сильного электролита будет больше величины концентрационной константы растворимости КS.
Процесс образования осадка — это последовательный процесс, который можно разделить на три основные стадии:
1)возникновение зародышей кристаллизации;
2)рост кристаллов из зародышей;
3)агрегация кристаллов с образованием поликристаллического
осадка.
Эти стадии протекают с разной скоростью. Вот почему при
С(Ag+)·С(Сl–)> КS не всегда образуется осадок хлорида серебра AgCl. Последняя стадия может продолжаться несколько часов или даже суток.
Растворение осадка или сдвиг равновесия вправо может быть осуществлен с помощью любого метода уменьшения концентрации свободных катионов Аn+ или свободных анионов Вm–:
1)связыванием этих ионов в другой менее растворимый осадок;
2)связыванием ионов металла в комплекс;
3)связыванием аниона в малодиссоциированную кислоту;
4)окислением или восстановлением катиона или аниона.
Конкурирующие равновесия в гетерогенных системах.
В реальных системах редко приходится сталкиваться со случаями, когда имеет место только одно гетерогенное равновесие. Присутствие в биологических жидкостях большого числа ионов приводит к тому, что одновременно могут образовываться несколько малорастворимых электролитов.
Однотипные конкурирующие равновесия. Допустим, имеется гете-
рогенная равновесная система
KS
СаSO4 Ca2+ + SO42–
В эту систему добавим раствор хлорида стронция SrCl2. Образуются два однотипных конкурирующих равновесия.
97
Кs (СаSO4) = 2,5 ·10–5 Кs (SrSO4) = 3,2 ·10–7
При Кs(СаSO4) > Кs(SrSO4) и составимых концентрациях анионов происходит преимущественно образование SrSO4. Конкуренцию за общий ион «выигрывает» тот малорастворимый электролит, который имеет меньшее значение Кs.
Если в растворе в равных концентрациях присутствуют SO 24− -ионы и СО32− -ионы,
Ks1
CaSO4 
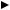 Ca2+ + SO24−
Ca2+ + SO24−
+
Sr 2+
 Ks2 SrSO4
Ks2 SrSO4
Ks1
CaSO4 
 Ca2+ + SO24−
Ca2+ + SO24−
+СО32−

 Ks2
Ks2
то при введении в раствор ионов кальция |
CaCO3 |
Са2+ в осадок в первую очередь переходит |
|
СаСО3, т. к. Кs(СаCO3) < Кs(CaSO4).
Таким образом, в общем случае катион М+ может образовывать два малорастворимых электролита с анионами А– и В–: МА и МВ. При
Кs(МА) = Кs(МВ) и равных исходных концентрациях А– и В– будет происходить одновременное образование МА и МВ в равных количествах.
При Кs(МА) > Кs(МВ) и сопоставимых концентрациях анионов происходит преимущественное образование МВ. Отсюда следует: чем меньше константа растворимости, тем раньше (т. е. при меньшей концентрации) начнет выпадать осадок.
Сравнение значений констант растворимости имеет смысл только в том случае, если рассматриваемые электролиты дают при ионизации одинаковое число ионов. Например:
1.AgJ, AgCl, CaSO4, BaSO4.
2.Ag2CrO4, PbCl2, Ag2CO3, PbJ2.
3.Ca3(PO4), Ba3(PO4).
При рассмотрении конкурирующих гетерогенных равновесий с участием разнотипных электролитов СаСО4 и Са3(РО4)2 математический аппарат усложняется.
Конкурирующие равновесия разных типов
Параллельно с гетерогенными равновесиями в реальных системах могут иметь место:
–равновесие с образованием комплексных соединений (связывание ионов металла малорастворимого сильного электролита в комплекс);
–кислотно-основное равновесие (связывание аниона малорастворимого сильного электролита в малодиссоциированную кислоту);
–окислительно-восстановительное равновесие (окисление или восстановление ионов малорастворимого сильного электролита).
98

1. Влияние равновесия с образованием комплексного соедине-
ния на гетерогенное равновесие. |
|
K s1 |
|
Рассмотрим систему из двух разнотипных |
I AgCl |
Ag+ + Cl– |
|
равновесий: |
|
+ |
2NH3 |
Кs(AgCl) = 1,1·10–10 |
|
|
|
|
|
KН |
|
Кнест. [Ag(NH3 )2 ]+ = 6,8·10–8 |
|
|
|
|
|
[Ag(NH3 )2 ]+ |
|
При пропускании аммиака через насыщен-
ный раствор хлорида серебра AgCl (гетерогенное равновесие I) образуется комплексный ион [Ag(NH3 )2 ]+ и возникает новое равновесие, вызванное
диссоциацией этого комплексного иона (равновесие II). В результате образования комплексного иона активность ионов Ag+ в растворе уменьшается, и осадок хлорида серебра начинает растворяться. По мере добавления новых порций аммиака можно полностью растворить осадок AgCl. Чем прочнее комплексный ион (чем меньше константа нестойкости), тем больше равновесие будет сдвинуто в сторону образования комплексного иона и растворения осадка.
2. Влияние кислотно-основного равновесия на гетерогенное равновесие.
Рассмотрим растворение осадка карбоната кальция с образованием малодиссоциированной слабой угольной кислоты.
CaCO3 |
Ks Ca2+ + CO 32− HCl |
I+ 2Н+
II Кдис. H2O
Н2СО3  CO2
CO2
Сначала раствор, соприкасающийся с осадком карбоната кальция СаСО3, является насыщенным относительно этого осадка. Это означает,
что произведение концентраций ионов С(Са2+)·С(СО32–) равно константе растворимости карбоната кальция Кs(СаСО3). При приливании хлороводородной кислоты ионы водорода начинают связывать карбонат-ионы СО32– в молекулы угольной кислоты, которая затем распадается на СО2 и Н2О. В растворе уменьшается количество карбонат-ионов, т. е. часть осадка переходит в раствор. Возникает новое, уже гомогенное равновесие II. При добавлении определенного количества кислоты, т. е. при определенном значении рН, может произойти полное растворение осадка карбоната кальция.
В биологических системах в норме и патологии кальциевые соли представляют твердую фазу (основную), а растворимость их увеличивается с увеличением кислотности.
99
3. Влияние окислительно-восстановительного равновесия на гетерогенное равновесие.
Растворение осадков может происходить в результате изменения степени окисления какого-либо элемента, входящего в состав твердой фазы, т. е. при протекании окислительно-восстановительных процессов. Для осадка со свойствами восстановителя надо подобрать довольно сильный окислитель, а для осадка со свойствами окислителя — сильный восстановитель. Например, анион С2О42– малорастворимого электролита оксалата кальция СаС2О4 является восстановителем и для него лучшим окислителем являются перманганат-ионы МnО4–, добавляемые в гетерогенную систему I в виде раствора перманганата калия:
I CaC2O4 |
Ks Ca2+ + C2O 42− |
KMnO4 |
|
+ MnO 4− |
pH<7 |
II 2СО2
В этих двух системах (I-гетерогенная, II-гомогенная) идет конкуренция за оксалат-ион С2О42–. Выигрывает перманганат-ион МnО4– , который
окисляет оксалат-ион, и в конце концов осадок растворяется, а выделение СО2 быстро смещает равновесие в сторону растворения осадка.
Для растворения осадка окислитель или восстановитель подбирают по значению их окислительно-восстановительных потенциалов. Например, для растворения осадка со свойствами восстановителя нужно подобрать достаточно сильный окислитель, а для осадка со свойствами окислителя — сильный восстановитель. Например, для растворения
СаС2О4 лучше взять KMnO4, чем I2, так как E0H2C2O4 /2CO 2 = –0,49В;
E0MnO−4 /Mn 2 + = 1,51В; E 0 I2 / 2I − = 0,5В. В первом случае E0 = 1,51 – (–0,49)
= 2,0B, а во втором всего E0 = 0,5 – (–0,49) = 0,99B, т. е. в 2 раза меньше.
Гетерогенные равновесия в жизнедеятельности организмов
В организме человека образование костной ткани это наиболее важный гетерогенный процесс с участием неорганических соединений. Основным минеральным компонентом костной ткани является гидроксидфосфат кальция Ca5(PO4)3OH. Часть ионов Ca2+ замещена ионами Mg2+, а очень незначительная часть ионов OH– замещена ионами фтора, которые повышают прочность кости.
Образование Ca5(PO4)3OH из слабощелочных растворов в опытах «in vitro» можно объяснить следующим образом. Известно, что при физиоло-
гическом значении рН крови (7,4) в системе сосуществуют ионы HPO24− и H2PO−4 . Сопоставление значений констант растворимости Ks0 (СаНPO4) =
100
