
Obschaya_khimia_-_lektsii
.pdf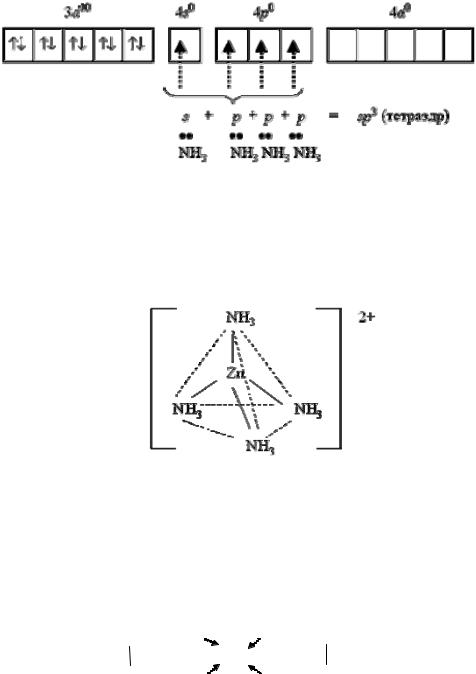
Природа химической связи в комплексных соединениях
Согласно методу валентных связей между центральным атомом и лигандами возникают ковалентные связи по донорно-акцепторному механизму. Лиганды — доноры электронных пар, центральный атом — акцептор. Центральный атом принимает на свободные валентные орбитали неподеленные пары электронов лиганда. Рассмотрим образование комплекс-
ного иона [Zn(NH3)4]2+: Zn2+ + 4NH3 → [Zn(NH3)4]2+.
Катион [Zn(NH3)4]2+ включает центральный атом цинк (II). Электронная оболочка иона цинка имеет формулу [Аr] 3d10 4s0 4р0 и может быть условно изображена так:
Вакантные 4s- и 4р-орбитали атома цинка образуют четыре sр3-гиб- ридные орбитали, ориентированные к вершинам тетраэдра. Каждая молекула аммиака имеет неподеленную пару электронов у атома азота. Орбитали атомов азота, содержащие неподеленные пары электронов, перекрываются с sр3-гибридными орбиталями атома цинка, образуя комплексный катион тетраамминцинка (II) - [Zn(NH3)4]2+:
Внутренняя координационная сфера связана с внешней сферой ионной связью.
Циклические комплексы или хелаты
Комплексы с полидентатными лигандами содержат циклы, которые включают центральный атом. Такие комплексы называются хелатными. Примером такого комплекса может служить этилендиаминовый комплекс меди (II):
CH2— H2N: |
: NH2 — CH2 |
CH2— H2N: |
Сu2+ |
: NH2 — CH2 |
61

К группе хелатов относятся и внутрикомплексные соединения, у которых центральный атом связан с лигандами ковалентной связью по обменному механизму и донорно-акцепторному. Образование внутрикомплексного соединения сопровождается вытеснением из кислотных функциональных групп одного или несколько протонов ионом металла:
Сu2+ |
H2N– CH2 |
H2C— NH2 |
|
O — C = O |
+ 2 |
= |
Сu2+ |
+2H+ |
|
|
HO – C = O O = C — O |
|
NH2 – CH2 |
|
Внутрикомплексными соединениями являются гемоглобин, хлорофилл, витамин В12, многие ферменты, и другие биологически важные соединения.
Классификация и номенклатура комплексных соединений.
I. По заряду внутренней сферы выделяют комплексы:
Катионные: [Ag(NH3)2] +Cl — хлорид диамминсеребра (I); [Cu(NH3)4] 2+SO4 — сульфат тетрамминмеди (II). Анионные: К4[Fe(CN)6]4– — гексацианоферрат (II) калия; К[Pt(NH3)Cl3]– — трихлороамминплатинат (II) калия. Нейтральные: [Со(NH3)3Cl3]0 — трихлоротриамминкобальт; [Fe(CO)5]0 — пентакарбонилжелезо.
II. В основу другой классификации комплексных соединений по-
ложена природа лигандов.
Ацидокомплексы. В качестве лигандов выступают кислотные остатки: Cl– (хлоро), CN– (циано), CNS– (родано), NO2– (нитро), SO42– (суль-
фато), и т. д.: К2[Cu(CN)4], К3 [Со(NО2)6].
Аминокомплексы (аммиакаты). В качестве лигандов выступают молекулы аммиака: [Cu(NH3)4]SO4; [Сr(NH3)6]Cl3; [Рt(NH3)6]Cl4.
Аквакомплексы. В качестве лигандов выступают молекулы воды: [Co(H2O)6]Cl2; [Cr(H2O)6]Cl3.
Гидроксокомплексы. В качестве лигандов выступают гидроксид-
ионы ОН-: Na3 [Al(OH)6]; Na2 [Zn(OH)4].
Карбонатные комплексы. В карбонатных комплексах СО-лиганды ковалентно связаны через атом углерода с металлом в нулевой степени окисления: [Ni(CO)4]; [Fe(CO)5].
Диссоциация комплексных соединений в растворах.
Внутренняя и внешняя сферы комплексного соединения сильно различаются по устойчивости. Частицы, находящиеся во внешней сфере, связаны с комплексным ионом электростатическими силами и легко распадаются в водном растворе. Лиганды, находящиеся во внутренней сфере, связаны с центральным атомом значительно прочнее и распадаются в небольшой степени. Поэтому диссоциация комплексных соединений проте-
62

кает в две стадии. На первой стадии диссоциация идет по типу диссоциа-
ции сильных электролитов: [Ag(NH3)2Cl] → [Ag(NH3)2]+ + Cl–.
На второй стадии диссоциация идет по типу слабых электролитов:
ступенчато, обратимо, частично: [Ag(NH3)2]+ Ag+ + 2NH3. Диссоциация ионов[Ag(NH3)2]+ , как и диссоциация всякого слабого электролита, выражается константой химического равновесия:
[Ag+ ][NH3 ]2
Кх.р = [[Ag(NH3 )2 ]+ ]
Константа химического равновесия Кх.р. в случае диссоциации комплексного иона называется константой нестойкости Кн. Она характеризует устойчивость и прочность внутренней сферы комплексного соединения. Чем меньше Кн., тем меньше концентрация продуктов распада комплекса и тем более прочный и устойчивый комплекс.
Для характеристики устойчивости комплексных соединений можно пользоваться величиной, обратной константе нестойкости, называемой
константой устойчивости Ку.: Ку.= |
1 |
= |
[[Ag(NH3 )2 ]+ ] |
. Чем больше Ку., |
|
Кн. |
|
|
|||
|
[Ag+ ][NH3 ]2 |
||||
тем более устойчивее и прочнее комплекс.
Разрушение комплексных соединений.
Чтобы разрушить комплекс, надо сместить равновесие диссоциации внутренней сферы вправо. Этого можно достичь путем образования более прочного комплекса, труднорастворимого осадка, слабого электролита или газообразного продукта. Например, равновесие диссоциации иона Ag(NH3)2]+ можно сместить вправо связыванием Ag+ или NH3:
[Ag(NH3)2]+  Ag+ + 2NH3
Ag+ + 2NH3
HNO3
KI (NH4)2S KCN
а) [Ag(NH3)2]+ + 2CN– → [Ag(CN)2]– + 2NH3 ↑,
Кн. [Ag(CN)2]– = 1 10–21 < Кн. [Ag(NH3)2]+ = 6,8 10–8;
б) 2[Ag(NH3)2]+ + (NH4)2S → Ag2S↓ + NH4+ + 4 NH3↑; в) [Ag(NH3)2] + KJ→ AgJ↓ +2NH3↑ + K+;
г) [Ag(NH3)2]Сl + 2HNO3 = AgCl↓ + 2NH4NO3.
Равновесияипроцессыврастворахсучастиемкомплексныхсоединений
В организме человека непрерывно происходит образование и разрушение биокомплексов из катионов биометаллов (железо, медь, цинк, кобальт) и биолигандов (порфиринов, аминокислот, белков, полипептидов,
63

нуклеиновых кислот, АТФ). Изучение процессов, протекающих в организме с образованием комплексных соединений, может иметь большое значение для профилактики лечения ряда заболеваний. Например, для выведения из организма ионов токсичных металлов все шире используют комплексоны - полиаминокарбоновые кислоты и их соли. В медицине сложилось специальное направление, связанное с использованием комплексонов — хелатотерапия. Наиболее широкое применение получила динатриевая соль этилендиаминтетрауксусной кислоты (ЭДТА или комплексон III, торговое название — трилон Б):
NaOOCH2C |
CH2COOН |
|
N — CH2 — CH2 — N |
НOOCH2C |
CH2COONa |
С помощью этой соли ускоряется выведение из организма токсичных металлов: свинца, ртути, кадмия, бария и др. Образующиеся комплексные соединения водорастворимы, практически не расщепляются в биологической среде и легко выводятся через почки. Способность к образованию прочных комплексных соединений со многими металлами проявляется и у других солей ЭДТА — кальциевых, кобальтовых. Например, кальциевая соль CaNa2 ЭДТА (тетацин) широко используется при отравлении свинцом.
Белки являются полидентатными лигандами и тоже хорошо связываются с тяжелыми металлами. При отравлении солями тяжелых металлов пострадавшему дают пить молоко и сырые яйца, которые содержат много белков. Образующиеся комплексные соединения не всасываются в кровь из кишечника и тяжелые металлы, таким образом выводятся из организма.
Жизненно необходимые элементы Zn,Cu, Fe, Mn, Co, Mo входят в состав некоторых ферментов, которые называются металлоферментами. Наиболее известные металлоферменты: карбоангидраза, ксантиноксидаза, цитохромы — в активных центрах содержат цинк, молибден и железо соответственно. Лигандами в металлоферментах выступают белки, а центральными атомами — ионы металлов.
Лекция 11 Химическая кинетика как основа для изучения скоростей
и механизмов биохимических процессов. Кинетические уравнения реакций нулевого, первого и второго порядка
Химическая кинетика — раздел физической химии, представляющий собой учение о скоростях и механизмах протекания химических реакций.
64
Основные понятия химической кинетики Химическая реакция. Химической реакцией можно считать любое
изменение вещества, при котором образуются или разрываются химические связи между атомами. Различают простые и сложные реакции. Простые реакции — это реакции, протекающие в одну стадию и их стехиометрическое уравнение правильно отражает реальный ход реакции:
H2 + I2 → 2HI.
Сложные реакции протекают через несколько стадий. Стехиометрическое уравнение не отражает реального хода процесса и является выражением суммарного результата нескольких стадий. Например, реакция взаимодействия между пероксидом водорода и йодоводородом может протекать в две стадии:
Первая стадия: H2O2 + HI →НIО + H2O.
Вторая стадия: HIO + HI →I2 + H2O. Суммарное уравнение: H2O2 + 2HI →I2 + 2H2O.
Абсолютное большинство химических реакций являются сложными. Совокупность стадий, из которых складывается химическая реакция, носит название механизма химической реакции. Каждая отдельная стадия, через которую идет реакция, называется элементарным актом реакции.
Исходные, конечные и промежуточные вещества. Вещества, которые образуются в процессе химического превращения и не изменяются при дальнейшем протекании реакции, называются конечными веществами или продуктами реакции.
Вещества, которые образуются на первой стадии химической реакции, затем превращаются в другие вещества на следующей стадии этой же реакции, называются промежуточными веществами. Например, в выше рассмотренной реакции кислота HIO является промежуточным веществом.
Гомогенные и гетерогенные реакции. Химическая реакция, протекающая в пределах одной фазы, называется гомогенной химической реакцией. Химическая реакция, протекающая на границе раздела фаз, называется гетерогенной химической реакцией. Примером гомогенных реакций может служить любая реакция в растворе. Примером гетерогенной реакции может служить любая из реакций, идущих на поверхности твердого катализатора (гетерогенная каталитическая реакция).
Скорость химической реакции Скорость химической реакции — это изменение концентрации
любого из участвующих в реакции веществ в единицу времени. Средняя скорость реакции (V) за промежуток времени t2–t1 равна:
− |
C2 − C1 |
С |
V = − |
|
= – t |
t2 − t1 |
65
где C — изменение концентрации, знак минус означает, что концентрация исходного вещества в процессе реакции постепенно убывает и, следовательно, скорость реакции уменьшается. Отношение в пределе, переходя
к бесконечно малым величинам, дает производную: – |
С |
||||||
t |
|||||||
|
|
|
С |
dC |
|
||
|
|
|
|
= – |
|
|
|
|
|
|
|
||||
|
|
|
|||||
|
|
|
t t →0 |
|
dt t →0 |
|
|
Таким образом, производная от концентрации по времени характеризует мгновенную (истинную) скорость химической реакции: V = − dCdt .
Скорость химической реакции всегда является величиной положительной, отношение же dCdt может иметь и положительное и отрицатель-
ное значение в зависимости от того, представляет ли С концентрацию одного из исходных веществ или одного из продуктов реакции. В первом
случае dCdt <0, но так как скорость должна быть величиной положительной,
перед производной ставят знак минус; во втором случае dCdt >0 и чтобы скорость реакции имела положительное значение берут производную со знаком плюс. В общем случае кинетическое уравнение имеет вид: V = ± dCdt .
Измеренные по разным веществам скорости не равны, а пропорциональныоднадругой. Скорость химическойреакциивыражаетсявмольл–1 с–1.
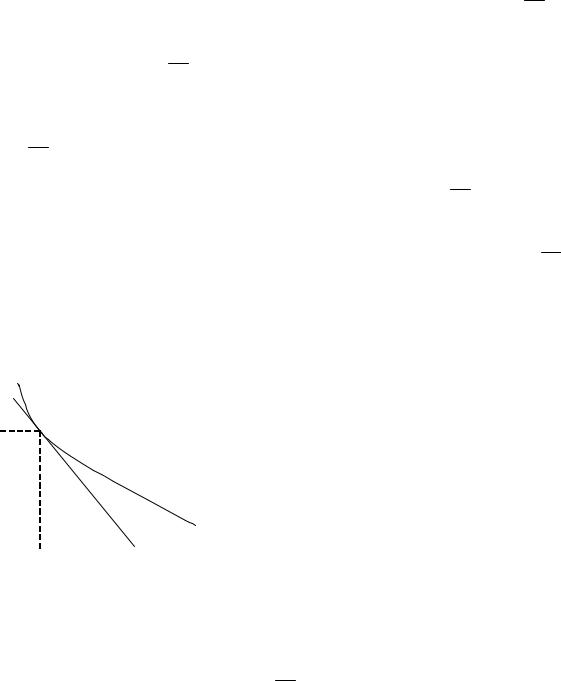
Определение скорости реакции. При определении скорости реак-
C |
|
|
|
|
|
|
|
ции производят измерение концентрации |
||
|
|
|
|
|
|
|
реагентов в зависимости от времени. Кри- |
|||
|
|
|
|
|
||||||
|
|
|
|
|
dC |
|
|
вая, изображающая зависимость концен- |
||
|
|
|
|
V = − |
|
|
трации какого-либо вещества от времени в |
|||
Ci |
|
|
|
dt |
||||||
|
|
|
|
ходе процесса химического превращения, |
||||||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
носит название кинетической кривой. Зная |
||
|
|
|
|
|
|
|
|
кинетическую кривую для какого-либо |
||
|
|
|
|
|
|
|
|
компонента, можно легко определить ско- |
||
|
|
|
|
|
|
α |
рость его накопления или расходования |
|||
|
|
|
|
|
|
графическим дифференцированием кине- |
||||
|
|
|
|
|
|
|
|
|||
|
|
|
ti |
|
|
t |
||||
|
|
|
|
|
тической кривой (рис. 1). |
|
||||
Рис. 1. Кинетическая кривая |
Крутизна |
кинетической кривой |
в |
|||||||
|
|
|
|
|
|
|
|
каждый момент |
времени характеризует |
|
|
|
|
|
|
|
|
|
истинную скорость реакции в этот момент |
||
|
|
|
|
|
|
|
|
времени, так как наклон касательной |
в |
|
точке численно равен скорости: V = − dCdt = tgα.
66
Существуют и косвенные методы определения скорости химической реакции, когда за ходом химического превращения следят за изменением рН раствора, электропроводности, показателя преломления, оптической плотности и т. д.
Порядок реакции и константа скорости реакции.
Скорость химической реакции зависит от многих факторов: концентрации, природы реагирующих веществ, давления (для газовых систем), температуры, катализаторов и даже формы реакционного сосуда. Зависимость скорости реакции от концентраций реагирующих веществ описыва-
ется основным постулатом химической кинетики: скорость реакции в каждый момент времени пропорциональна произведению концентраций реагирующих веществ, возведенных в некоторые степени. Для реакции аА + вВ → сС + dD можно записать: V = k[A]a [B]в.
Уравнение, отражающее зависимость скорости реакции от концентраций реагирующих веществ, называется кинетическим уравнением
реакции.
Множитель k в этом уравнении показывает скорость химической реакции при концентрациях реагирующих веществ, равных 1 моль/л, называется константой скорости химической реакции. Она не зависит от концентрации и характеризует влияние природы реагирующих веществ на скорость их взаимодействия друг с другом. Из этого следует, что константа скорости реакции является мерой реакционной способности молекул.
Показатели степени а и b называются порядком реакции по данному веществу. Сумма (а + b) — общий порядок реакции. Порядок реакции - величина формальная. Может быть положительной, отрицательной, целым, дробным, нулевым числом. Порядок реакции определяется экспериментально, его нельзя предсказать заранее.
Для многих химических реакций порядок реакции по данному веществу не равен стехиометрическому коэффициенту.
Для простых реакций показатели степеней в кинетических уравнениях равны коэффициентам стехиометрических уравнений. Например, скорость реакции H2 + I2 = 2HI может быть записана следующим образом:
V = k[H2] [I2],
где порядок реакции по водороду и йоду равен единице, а порядок реакции в целом равен 1 + 1 = 2. В этом случае стехиометрическое уравнение правильно отображает элементарный акт реакции.
Эта закономерность находит свое отражение в законе действующих масс, сформулированном в 1867 г. норвежскими учеными К. Гульдбергом и П. Вааге: скорость простой реакции в каждый момент времени про-
порциональна произведению концентраций реагирующих веществ, возведенных в степени, равные коэффициентам в стехиометрическом уравнении.
67

Таким образом, закон действующих масс является частным случаем основного постулата химической кинетики. Закон действующих масс является справедливым только для простых реакций.
Классификация химических реакций по порядку.
V |
|
|
|
1. |
Для реакции нулевого |
||
|
|
|
порядка скорость реакции не за- |
||||
|
|
|
|
||||
|
|
|
|
висит от концентрации вещества |
|||
|
|
|
|
и графически скорость реакции от |
|||
|
|
|
|
концентрации дает прямую ли- |
|||
|
|
|
|
нию, параллельную оси абсцисс |
|||
|
|
|
|
(рис.2). Математическое выраже- |
|||
|
|
|
|
ние для реакции нулевого порядка |
|||
|
|
|
|
V= − |
dC |
= kC0 = k , где k — |
|
|
|
|
|
dt |
|||
|
|
C |
|||||
Рис. 2. Зависимость скорости реакции |
константа скорости и ее размер- |
||||||
V нулевого порядка от концентрации |
ность равна: k = [с] [t]−1 . |
||||||
|
|
|
|
К |
реакциям нулевого по- |
||
рядка относятся следующие реакции:
а) фотохимические реакции Н2 + Cl2 → 2НCl;
б) реакция гидролиза этилацетата СН3СООС2Н5 + Н2О → СН3СООН + С2Н5ОН.
2. Для реакции первого порядка V = − dCdt = kC1 , а размерность
константы скорости k = [t]−1 . В этом случае зависимость lnс от времени имеет прямолинейный характер (рис. 3). Первый порядок имеют: реакция
гидролиза сахарозы С12Н22О11 + Н2О = С6Н12О6 + С6Н12О6; реакция разложения N2О5 (N2О5(г) → 4NО2(г) + О2; реакции радиоактивного распада.
3. Скорость реакции второго порядка для двух реагентов подчиняется кинетическому уравнению V= − dCdt = kC11 C12 . Если С1= С2 или, если
реагируют одинаковые частицы, то V= − dCdt = kC12. В этом случае размер-
ность константы скорости реакции k равна [с]−1 [t]−1 . Второй порядок име-
ют, например, реакции: 2NOCl = 2NO + Cl2; 4НBr + O2 = 2Н2О + Br2.
В случае реакции второго порядка зависимость 1/С от времени имеет прямолинейный характер. Эта зависимость показана на рис. 4.
Сравнивать между собой реакции разного порядка можно по скоростям, т. к. скорости реакции разного порядка имеют одинаковую размерность. Сравнение констант скорости разного порядка не имеет смысла, так как они имеют разные размерности. Можно сравнивать между собой константы скорости одного и того же порядка.
68
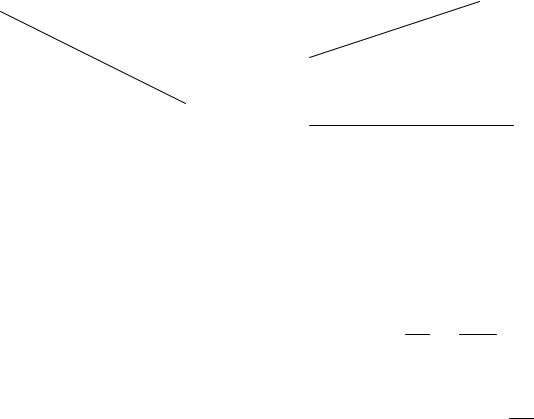
lnC |
|
1/C |
|
|
|
|
|||
|
|
|
|
|
t |
t |
Рис. 3. Зависимость lnС от времени |
Рис. 4. Зависимость 1/С от времени |
для реакции первого порядка |
для реакции второго порядка |
Период полупревращения (период полураспада). Период полупревращения — это время, в течение которого прореагирует половина исходного вещества в химической реакции (t1/2). Для реакции нулевого порядка t1/2 = С0/2k, т. е. t1/2 пропорционально начальной концентрации (С0) исходного вещества. В случае реакции первого порядка t1/2 = lnk2 = 0,693k , т. е.
t1/2 не зависит от начальной концентрации исходного вещества, а константа скорости (k) обратно пропорциональна периоду полупревращения.
Период полупревращения для реакции второго порядка равен: t1/2 = kC1 0 ,
т. е. период полупревращения обратно пропорционален начальной концентрации.
Чем больше значение времени полупревращения t1/2 , тем больше вещества находится в организме. Это имеет значение для токсикологии, фармакологии.
Молекулярность реакции. Молекулярность реакции определяется числом молекул, одновременно сталкивающихся и приводящих к химическим превращениям. Молекулярность характеризует элементарный акт реакции, т. е. простую реакцию. Имеет вполне определенный химический смысл. Например, реакция: I2 = 2I — мономолекулярная, так как в основе ее лежит распад исходного вещества; реакция H2 + I2 = 2HI — бимолекулярная. Реакция 2NO + H2 = N2O + H2O является примером тримолекулярной реакции. Молекулярность более высокого порядка не встречается, так как одновременное столкновение четырех частиц почти невозможно.
Для простых реакций порядок и молекулярность совпадают. Для сложных реакций эти понятия чаще всего не совпадают.
69
Лекция 12 Кинетика биохимических реакций. Зависимость скорости
реакций от температуры. Теория активных соударений и переходного состояния. Гомогенный и гетерогенный катализ. Ферменты как биохимические катализаторы
Влияние температуры на скорость химической реакции. Прави-
ло Вант-Гоффа. В 1884 г. Вант-Гофф установил, что при повышении температуры на 10 градусов скорость многих реакций увеличивается в 2–4
раза. Математически эта зависимость выражается соотношением:
t2 −t1
V2 = V1 γ 10
где V2 и V1 — скорости реакции при температурах t1 и t2, γ — температурный коэффициент скорости реакции. Для многих реакций γ имеет значения в пределах 2–4. Коэффициент γ показывает, во сколько раз увеличится скорость реакции при повышении температуры на каждые десять градусов. Правило Вант-Гоффа можно использовать тогда, когда реакция проводится при температуре близкой к комнатной.
Для биохимических реакций температурный коэффициент γ находится в интервале от 7 до 10, т. е. биохимические реакции сильнее зависят от температуры. Для расчета γ скорость биохимических реакций измеряется через 2º, 3º, 5º (∆t = 2º, 3º, 5º и т. д.). Все жизненные процессы идут в узком температурном интервале от 0 ºС до 45–50 ºС.
Теория активных соударений. Более точную зависимость константы скорости реакции от температуры дает теория активных соударений С. Аррениуса, предложенная им в 1889 г. В основе этой теории лежит представление о том, что для протекания химической реакции необходимо соударение между молекулами исходных веществ. Но не каждое соударение молекул приводит к химическому превращению: к нему приводит лишь активное соударение.
Активные соударения — это соударения, которые происходят, например, между молекулами А и В с большим запасом энергии. Тот минимальный запас энергии, которым должны обладать молекулы исходных веществ для того, чтобы их соударение было активным, называется энергетическим барьером реакции. Наглядное представление об энергетическом барьере реакции дает графическое изображение энергетики химической реакции (рис. 1). На этой диаграмме в качестве абсциссы используется так называемая координата реакции, которая является сложной функцией межатомных расстояний. По оси ординат откладывается потенциальная энергия всей системы.
То дополнительное количество энергии, которое надо добавить к средней энергии молекул исходных веществ, чтобы соударение между мо-
70
