
- •Основы составления баланса
- •1. Назначение материальных и энергетических балансов
- •2. Законы сохранения в закрытой системе
- •2.1. Законы сохранения массы в закрытой системе
- •2.2. Закон сохранения энергии в закрытой системе
- •3. Законы сохранения в поточной системе
- •3.1. Понятие поточной системы и виды потоков
- •3.3. Уравнение неразрывности потока
- •3.5. Выражение энергетического баланса в поточной системе
- •Свойства периодических процессов
- •Основные свойства
- •Достоинства непрерывных процессов
- •Причины существования периодических процессов
- •3. Стационарные системы
- •4. Нестационарные системы (процессы)
- •5. Открытые системы
- •Совместимые понятия
- •Несовместимые понятия
- •Классификация систем по фазовому состоянию реагента
- •2. Способы повышения скорости гомогенных процессов.
- •3. Гетерогенные системы
- •6. Методы увеличения скорости гетерогенных процессов
- •Химический катализ.
Основы составления баланса
Назначение материальных и энергетических балансов
Законы сохранения в закрытой системе
Закон сохранения массы
Закон сохранения энергии
Законы сохранения в поточных системах
Понятие поточной системы и виды потоков
Характеристика основных потоков
Конвективный поток
Диффузионный (основной) поток
Переходящий поток
Источник или сток
Уравнение неразрывности потока. Частные выражения уравнения неразрывности потока
Закон сохранения массы в поточной системе
Закон сохранения энергии в поточной системе
Виды балансов, формы и методы составления балансов.
1. Назначение материальных и энергетических балансов
- для анализа работы технологической схемы и отдельных аппаратов схемы
- для проектирования новых производств
- для проектирования и конструирования новых химических аппаратов
- для отыскания важнейших технологических показателей процесса:
А) расходные коэффициенты
Б) потери на отдельных стадиях процесса
В) степени превращения
В основе расчетов ХТП лежат законы сохранения. Законы сохранения допускают только такие превращения, при которых суммы масс, энергии и импульса внутри системы остаются неизменными. Законы сохранения массы, энергии и импульса были открыты в результате наблюдений таких ученых как Ломоносов, Лавуазье, Майер и Джоуль.
В покоящейся системе суммы масс, энергии и импульса остаются неизменными внутри системы, независимо от процессов, протекающих в этой системе.
Система, в которой не происходит обмена массой, энергией и импульсом с окружающей средой, называется закрытой
2. Законы сохранения в закрытой системе
2.1. Законы сохранения массы в закрытой системе
Система, в которой не протекают химические реакции.
Гомогенная закрытая система.
Одна фаза и несколько компонентов.
Фаза – те гомогенные составные части гетерогенной системы, которые отделены друг от друга поверхностью раздела;
Фаза – совокупность тождественных по химическому составу, физическим и термодинамическим свойствам частей системы, ограниченных поверхностью раздела.
Компонент – минимальное число независимых составных частей системы, которые необходимы для ее построения;
Компонент – составная часть системы, включающая одно простое или сложное вещество.
Если в системе имеются несколько компонентов К и одна фаза (I=1), то сумма масс всех компонентов будет равна массе системы: m1+m2+m3+…+mk=mφ
![]() или
в молях
или
в молях
![]() N
– количество молей
N
– количество молей
Закрытая гетерогенная система
Количество фаз равно z (φ =z ), количество компонентов к = 1
Если один компонент образует систему из нескольких фаз, то сумма масс всех фаз будет равна массе системы в целом.
NX + Ny + …+ NZ = N
mx + my+…mz = m
![]() Согласно
приведенному выражению вещество может
переходить из одной фазы в другую (лед
– вода – пар – вода – лед).
Согласно
приведенному выражению вещество может
переходить из одной фазы в другую (лед
– вода – пар – вода – лед).
Многокомпонентная гетерогенная система
Если несколько компонентов образуют систему из нескольких фаз z, то закон сохранения массы нужно выразить для каждого компонента отдельно. Полученное таким образом уравнение называется балансом компонента или частичным массовым балансом.
Проще баланс составлять через мольные доли компонента.
Мольная
доля i-го
компонента в фазе х:
 ;
или Хi
=
;
или Хi
=
![]()
Nx – число молей данной фазы
Nix – число молей i-го компонента, присутствующее в фазе x:
Мольная
доля в фазе «y»
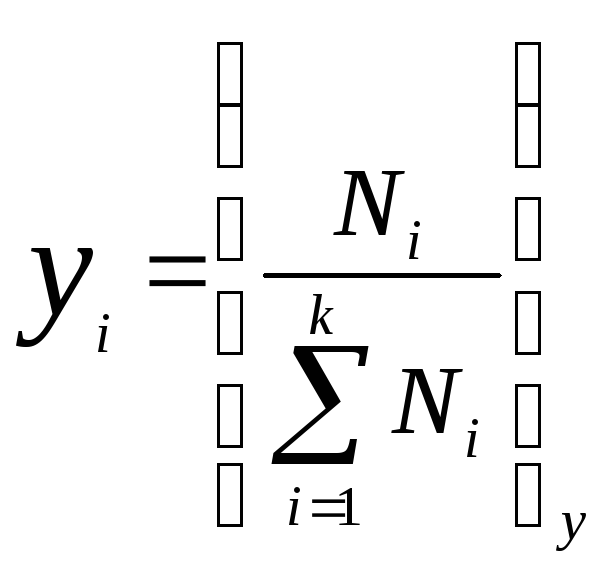
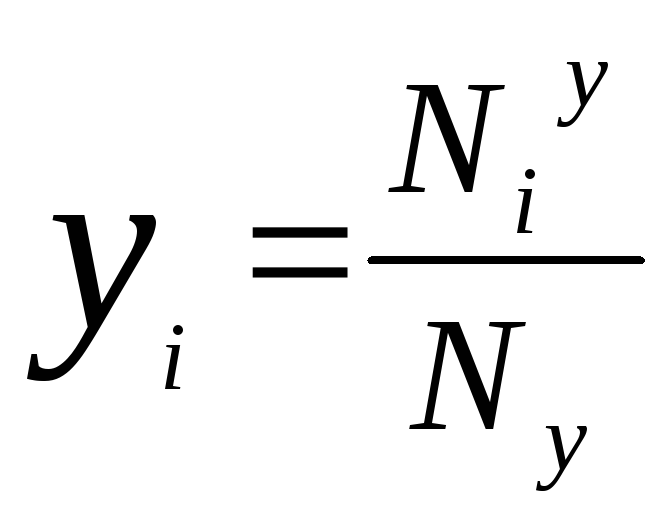
Для каждой фазы существует отдельная зависимость, причем сумма мольных долей всех компонентов внутри одной фазы будет равна единице.
![]() ;
;
![]() - балансы для каждой фазы
- балансы для каждой фазы
Если в фазе два компонента, то х1+х2=1.
В многокомпонентной гетерогенной системе нужно составить систему уравнений частных массовых балансов для каждого компонента, присутствующего в данной системе.
x1Nx + y1Ny + …+z1Nz = N1 – уравнение для первого компонента
x2Nx + y2Ny + …+z2Nz = Nz
…………………………...
…………………………...
x kNx
+ ykNy
+ …+zkNz
= Nk
kNx
+ ykNy
+ …+zkNz
= Nk
+![]()
По вертикали – числа молей каждой фазы
По горизонтали – суммы молей каждого компонента во всех фазах.
Последнее выражение – закон сохранения массы в закрытой многокомпонентной гетерогенной системе, в которой не происходит химической реакции.
В том случае, когда происходят химические реакции, закону сохранения подчиняются не компоненты, а химические элементы или радикалы.
Вместо суммы чисел молей отдельных компонентов неизменной остается сумма чисел атомов отдельных элементов или сумма радикалов.
![]()
![]()
![]() ,
,
где νiMi – дает число атомов отдельного элемента в соответствующих единицах массы.
Мi – химическая формула i-го компонента.
