ем
Рис.
15. Promonotus
orientalis (Proseriata).
Строение
стенки
тела.
Продольный
разрез. (По: Беклемишев,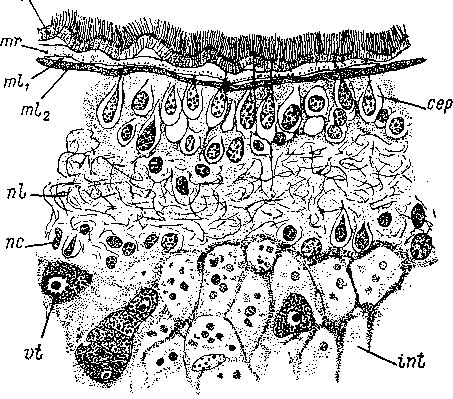
19276).
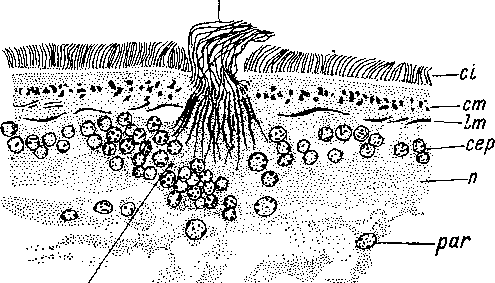
сер — погруженные эпидермальные клетки, ер — эпителиальная пластинка, int — клетки кишки, пс — нервные клетки, nl — боковой нервный ствол, ml± — наружные продольные миофибриллы, ml2 — внутренние продольные миофибриллы, mr — кольцевые миофибриллы, vt — желточные клетки.
вителя Proseriata — Promonotus orientalis. Это будто бы единственный пример, когда эпителиально-мускульные элементы и базальная мембрана существуют одновременно. Развитие эпидермальной мускулатуры у высокодифференцированной формы,— пишет Акс,— говорит против первичности этого признака и заставляет считать его во всех случаях, когда он проявляется, вторичным приспособлением. Автор ссылается при этом на данные В. Н. Беклемишева (19276), касающиеся Promonotus orientalis.
Однако при внимательном изучении этой работы (Беклемишев, 19276, стр. 91—98, табл. II, рис. 6) выясняется, что представление о существовании у Promonotus orientalis миофибрилл внутри эпидермиса основано на недоразумении. Как все Monocelidi- dae, Promonotus orientalis обладает погруженным эпителием. Эпителиальная пластинка разделена на полигональные клеточные территории и подостлана тонкой базальной мембраной, под которой в паренхиме залегают слои кожно-мускульного мешка — кольцевой и два продольных (рис. 15). На стр. 93 своей работы Беклемишев сообщает, что ему не удалось найти никаких особых миобластов в области кожно-мускульного мешка, и он думает поэтому, что у моноцелидид «кожно-мускульные волокна представляют еще истинный продукт эпидермиса», однако при этом они полностью обособились уже от эпителиальной пластинки. Последнее утверждение Беклемишева можно понять только как общее высказывание об эпидермальном происхождении кожномускульного мешка.
Наконец, Акс ссылается на примеры независимого развития эпителиально-мускульных клеток у различных Metazoa. Мио- эпителиальные элементы известны в эпидермисе и в глотке Rotatoria и Gastrotricha, в глотке Archiannelida и Bryozoa и в слюнных, потовых и слезных железах Mammalia. По тонкой структуре они настолько отличаются от эпителиально-мускульных клеток Cni- daria, что невозможно говорить о какой-либо гомологии всех этих образований. Н. Г. Хлопин, который детально проанализировал дифференциацию, происхождение и поведение в культурах миоэпителиальных элементов позвоночных, пишет относительно них гораздо осторожнее: «. . . клетки миоэпителиального характера. . . встречаются во всем своем многообразии у различных представителей животного мира и являются благодарным материалом для демонстрации явлений дивергентного развития, а также параллелизмов. Для общего объяснения последних, с моей точки зрения, вполне достаточно общих законов эволюционной биологии, согласно которым глубокие черты сходства имеют своей причиной генетическое родство, различия зависят от дивергентной эволюции мелких и крупных систематических групп, а более поверхностные черты сходства могут быть и результатом конвергентного развития образований, имевших очень неодинаковые пути эволюции» (1946, стр. 363—364).
Признавая в общем независимое параллельное развитие многих миоэпителиальных элементов, мы тем не менее считаем, что в пределах класса турбеллярий они гомологичны друг другу. Более того, у турбеллярий они как раз обнаруживают принципиальное сходство с эпителиально-мускульными клетками Cnidaria, что говорит если не о гомофилии, то по крайней мере о их гомоплазии.
Эпидермальные железы
Покровы Turbellaria, как известно, обладают сильно выраженной секреторной функцией. В состав эпидермиса турбеллярий входят слизистые и белковые железы в виде бокаловидных или грушевидных железистых клеток, рассеянных или собранных в комплексы. Они чрезвычайно разнообразны и еще недостаточно изучены. Часть кожных желез производит оформленный зернистый или палочковидный секрет в виде гиалоидов, которые в их наиболее совершенной форме называются рабдитами (рис. 12).
Особенно интересны лобные, или фронтальные, железы турбеллярий (рис. 63, 81), ибо они обнаруживают общую гомологию с теменными, или головными, железами многих низших беспозвоночных и их личинок и, следовательно, относятся к числу весьма характерных первичных органов примитивных Metazoa. Кроме турбеллярий, ими обладают личинки ленточных червей (Cestoda- ria) — ликофоры, взрослые Cestodaria (Amphilina) и Cestoda (ско- лексовые железы; Fuhrmann, 1930—1931), личинки и взрослые Monogenoidea (Быховский, 1957), личинки и взрослые Gyrocoty- loidea, личинки и взрослые формы Nemertini (Burger, 1897—1907; Hyman, 1951), а также некоторые трохофорu.Polychaeta (например, Lopadorhynchus, по: Мейер, 1897). У турбеллярий фронтальные железы представляют собой комплекс одноклеточных циано- фильных желез, слизистый секрет которых играет важную роль при овладевании добычей. Их выводные протоки открываются на переднем конце тела на небольшом участке покровов, способном несколько впячиваться и лишенном ресничек. Замечательно, что почти у всех Acoela фронтальные железы сильно развиты. Однако фронтальные железы имеются также у личинок Polycladida, у Macrostomida и встречаются у многих представителей Neoophora, в том числе у Prolecithophora, Proseriata и Neorhabdocoela.
Нельзя не упомянуть также о так называемом фронтальном органе, представленном совокупностью выводных протоков фронтальных желез и прилегающими к нему нервными элементами. Он свойствен Archoophora, именно Acoela и Macrostomida, а среди Neoophora встречается у некоторых низших — у Prolecithophora и Proseriata.
Органы кожного вооружения
Рабдитные железы. Рабдиты
Некоторые специфические образования и органы, связанные с покровами, выполняют у турбеллярий функции нападения и защиты. К ним прежде всего относятся рабдитные железы. Рабдиты, как известно, представляют собой очень характерный, оформленный палочковидный секрет турбеллярий. За пределами этого класса они обнаружены только у трематоды Rhabdiopoeus (Johnston, 1913) и в эпителии хобота некоторых немертин (Gontcharoff, 1957). Свойства рабдитов различны у представителей разных отрядов ресничных червей, л детальное сравнительное изучение их едва начато, У додикладид рабдитные клетки всегда входят в состав эпидермиса (рис. 12), но у других турбеллярий обычно лежат в паренхиме, так как представляют собой одноклеточные погруженные железы.
Среди разнообразных форм рабдитов различают как малодифференцированные палочки секрета — хондроцисты и раммиты,, так и палочки, обладающие очень сложной структурой, — собственно рабдиты. Попав в воду из тела турбеллярии, рабдиты разбухают и дают слизь, которая имеет защитное значение, иногда обладает отпугивающими врагов свойствами, нередко играет важную роль при захвате добычи или вместе с секретом других кожных желез образует защитную оболочку при инцистировании (Bresslau, 1928—1933; Reisinger, 1969).
Ультраструктура,, генезис и процесс выведения рабдитов из тела животного недавно были изучены (с помощью электронного и фазово-контрастного микроскопов) у некоторых Macrostomida (Macrostomum, Promacrostomum), Neorhabdocoela (Mega- lorhabdites), Proseriata (Bothrioplana), Tricladida (Dugesia, Proco- tyla, Fonticola, Atrioplanaria) (Pedersen, 1961; Kelbetz, 1962; Reisinger u. Kelbetz, 1964; Reisinger, 1969). К сожалению, до сих пор мы ничего не знаем об ультраструктуре рабдитов у представителей других отрядов.
Наиболее сложно устроенными рабдитами обладают Macrostomida, т. е. как раз та группа турбеллярий, которую Акс (Ах, 1961) считает наиболее близкой к первичным ресничным червям. Это несоответствие усугубляется также тем, что рабдиты макро- стомид однотипны и лежат исключительно в погруженных рабдит- ных железах в отличие от более примитивных рабдитов, формирующихся в эпидермисе у многих Acoela, у Polycladida и у многих Prolecithophora. Каждый сформированный рабдит у макростомид; имеет сложную оболочку и центральную зернистую массу. Оболочка состоит из наружного слоя тонких кольцевых фибрилл и двух глубже лежащих слоев из перекрещивающихся под углом в 50— 90° диагональных (спиральных) волоконец. Кроме того, к оболочке снаружи прилегает слой рыхлых продольных волоконец. На переднем конце рабдита, или на «головке», находится скопление особого «контактного» вещества, вероятно, вытекающего из середины рабдита, и шаровидное полярное тельце (Reisinger и. Kolbetz, 1964).
Формирование рабдита начинается возле ядра рабдитной железы образованием гранул центральной массы, которые появляются среди канальцев сильно развитой эндоплазматической сети. По соседству располагаются митохондрии; аппарат Гольджи всегда прилетает к переднему полюсу будущего рабдита. Оболочка образуется после накопления центральной массы, причем мембраны эндоплазматических канальцев, усаженные рибосомами, дают наружные продольные волоконца. Однако участие этих мембран в образовании кольцевого и диагональных слоев оболочки не доказано.
Раздражение животного вызывает «выталкивание» рабдитов. При этом на их заднем конце сразу же начинаются интенсивное поглощение воды и связанное с ним сильное разбухание центрального вещества, а также происходит распрямление спиральных волоконец диагональных слоев оболочки. Эти процессы очень быстро распространяются на впереди лежащие участки рабдита; в результате палочка мгновенно вытягивается в длинную нить, на конце которой еще некоторое время сохраняется сравнительно мало- измененная, булавовидная головка рабдита. Таким образом, процесс выталкивания несколько напоминает механизм движения ракеты (Reisinger, 1969). Внешне он похож также на выбрасывание нитей трихоцист у инфузорий (например, у Paramecium). Однако в деталях между рабдитами и трихоцистами имеются настолько существенные различия, что о гомологизации их говорить не приходится (Иванов, 1968; Reisinger, 1969).
Bothrioplana semperi также обладает этим типом «выталкивающихся» рабдитов, но строение последних резко отличается. Зрелый рабдит этого пресноводного представителя Proseriata целиком состоит из 15—17 концентрически расположенных вокруг его продольной оси пластинок, слагающихся из тончайших продольных фибрилл. Слоистой оболочки нет, полярное тельце и контактное вещество отсутствуют. Рабдиты Bothrioplana тоже образуются внутри эндоплазматической сети железистой клетки, будучи тесно окружены митохондриями.
Выталкивание этих рабдитов совершается примерно так же, как у макростомид. Разбухание пластинок начинается на заднем конце рабдита; он быстро вытягивается в нить, которая затем превращается, как и у макростомид, в слизистую массу.
Иной тип рабдитов свойствен Neorhabdocoela (если судить по единственной изученной форме) и Tricladida — это так называемые разбухающие рабдиты, которые сразу растворяются и дают массу слизи, как только попадают в воду.
Некоторые рабдиты наземной неорабдоцелиды — Megalorhab- dites (сем. Protoplanellidae) — напоминают таковые Bothrioplana, так как тоже состоят из концентрических, правда слегка волнистых, пластинок. Пограничная мембрана этих рабдитов непосредственно переходит в стенки эндоплазматических канальцев железистой клетки. Рабдиты планарий по структуре очень просты; снаружи они одеты двойной мембраной и состоят из однородной зернистой массы, которая иногда (например, у Dugesia tigrina) разделена на корковый слой и сердцевину (Pedersen, 1961). По детальному исследованию Ленца (Lentz, 1967), у планарии Рго- cotyla fluviatilis первый зачаток рабдита формируется из одного из пузырьков аппарата Гольджи, прилегающего к ядру вместе с густым участком эндоплазматической сети. Этот зачаток затем окружается тончайшими продольными трубочками (microtubuli), которые связаны с апикальным концом аппарата Гольджи. Корковый слой рабдита развивается из кольцевидно расположенных узких мембран внутри оболочки. На апикальном (переднем) конце рабдита образуется пробочка из слившихся зерен основного вещества. Рейзингер сравнивает ее с контактным веществом и полярным тельцем рабдита макростомид и на этом основании считает рабдиты планарий вторично упрощенными. Подтверждение этому он видит в том, что у некоторых трикладид. (Fonticola vitta, F. paravitta, Polycladod.es alba) рабдиты начинают растворяться в воде с заднего конца, хотя и не относятся к типу выталкивающихся рабдитов.
Таким образом, по мнению Рейзингера, анцестральные формы турбеллярий обладали ^высокоспециализированными рабдитами, сходными с таковыми макростомид. Возникшие от них рабдиты планарий претерпели значительные вторичные упрощения. Рабдитные палочки Bothrioplana по ультраструктуре занимают якобы промежуточное положение между рабдитами макростомид и трикладид. Что касается рабдитов Megalorhabdites, то и они, по Рей- зингеру, произошли от выталкивающихся рабдитов макростомид и тоже значительно упрощены (Reisinger, 1969).
Нам представляется, что факты не подтверждают нарисованной Рейзингером картины эволюции рабдитов. Самыми простыми рабдитами, по-видимому, обладают Acoela, Catenulida и многие Prolecithophora, у которых в ряде случаев они представляют лишенный особой структуры палочковидный секрет (Graff, 1904—1908; Westblad, 1948; Беклемишев, 1952; Иванов, 1952; Pullen, 1953; Мамкаев, 1967). Естественно предположить, что от этих примитивных хондроцист эволюция пошла в нескольких независимых направлениях. Одно из них привело к очень специализированным рабдитам Macrostomida. Что же касается рабдитов Megalorhabdites, Bothrioplana и Tricladida, то их особенности, вероятно, развились независимо.
Иглообразующие железы
Несомненную специализацию рабдитных желез представляют так называемые иглообразующие железы, до сих пор известные только у дальневосточной Convoluta sagittifera (Иванов, 1952а). Это крупные веретеновидные клетки, глубоко вдающиеся в паренхиму (рис. 16, А). Центральная часть клетки занята большой вытянутой вакуолью, содержащей одну большую твердую иглу. Дистальный конец клетки в виде узкого протока открывается на поверхность тела. Замечательно, что этот проток окружен многочисленными, преимущественно кольцевыми мускульными волокнами, обособляющимися от кожно-мускульного мешка. Веретеновидная, едва искривленная игла стекловидно прозрачна и достигает 50 мкм в длину, т. е. в 10 раз больше самых крупных рабдитов. Расположение желез с иглами весьма характерно. Значительная их часть залегает по бокам тела на брюшной стороне, преимущественно на уровне рта. Другая группа связана с женским половым
отверстием
и образует пару веерообразных пучков
в области влагалища. Третья, хвостовая,
группа иглообразующих желез расположена
позади мужского полового отверстия
(рис. 16, Б).
На боковых краях тела иглы служат
преимущественно для
умерщвления добычи, когда она
подминается передним концом и
охватывается весьма подвижными
краями. При этом, по-видимому, иглы
выталкиваются из желез сокращением
их мускульных волокон и втыкаются в
тело жертвы. Роль хвостовых желез должна
быть ана-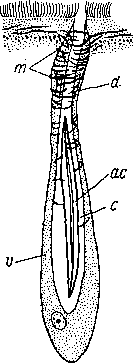
й cm -
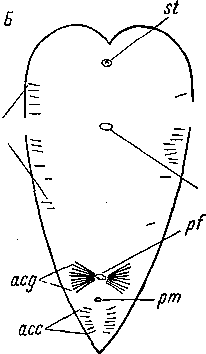
— I Рис. 16. Convoluta sagittifera (Acoela).
А — иглообразующая железа, Б — схема расположения игло- п образующих желез. (По: Ива- ^нов, 1952а). ас— игла, асс — каудальные иглы, acg — генитальные иглы, ас т — маргинальные иглы, с — вакуоль, d — проток железы, m — мускульные волокна протока, о — ротовое отверстие, р/ — женское половое отверстие, рт — мужское половое отверстие, st — статоцист, v — цитоплазма железы.
логичной, но, возможно, им свойственна только первичная защитная функция. Часть иглообразующих желез утратила первоначальное значение органов защиты и целиком обслуживает половой аппарат, превратившись в органы раздражения партнера при копуляции. Смена функций, которой подверглись иглообразующие железы Convoluta sagittifera, находит себе аналогию у других Acoela, у которых сходную судьбу испытали органы кожного вооружения другого типа (см. ниже).
Сагиттоцисты
Интерес представляют далее сагиттоцисты, похожие на первый взгляд на иглообразующие железы. Они свойственны лишь немногим видам Convoluta, например С. roskoffensis и С. schultzei (Graff, 1891).
По мнению В. Н. Беклемишева (1964), они могут быть гомологичны книдоцистам книдарий, что указывает на отдаленное родство Cnidaria и Acoela. Подобно стрекательной капсуле, сагитто- циста образуется в цитоплазме особой эпидермальной клетки (са- гиттоцита) как ее оформленный секрет; она имеет вид небольшого мешочка, наполненного жидкостью; внутри нее формируется за
остренная с обоих концов игла, которая рассматривается в качестве гомолога стрекательной нити (Беклемишев, 1964). Оба образования развиваются сходно, как внутренний вырост стенки мешочка или капсулы. Иглы сагиттоцист используются как средство защиты и нападения — они втыкаются в тело врага или добычи. По описанию Граффа (Graff, 1891), сагиттоцисты не имеют протока, острая игла, выдавливаясь наружу, легко прокалывает стенку клетки.
Паракниды
Некоторым сравнительно высокоразвитым турбелляриям, именно Coelogynoporidae из отряда Seriata, свойственны очень специализированные одноклеточные ядовитые железы, называемые паракнидами (Karling, 1966а). У низших турбеллярий эти образования полностью отсутствуют. Паракниды напоминают на первый
с
Рис.
17. Coelogynopora
paracnida
(Proseriata).
Паракнида. (По: Karling,
1966а).
с
— ввернутый внутрь вырост стенки
клетки, ер — эпидермис, п—
ядро.
взгляд нематоцисты Cnidaria, так как содержат, подобно им, ввернутую внутрь длинную нить, способную внезапно выворачиваться или «выстреливать» (рис. 17). Однако истинный стрекательный аппарат Cnidaria — книдоциста — есть только оформленный секрет нематоцита, тогда как паракнида представляет собой целую клетку, наружная стенка которой впятилась внутрь в виде нити. Механизм выбрасывания нити паракниды и нити стрекательной капсулы одинаков, по крайней мере внешне. Таким образом, паракниды — это новый интересный случай конвергентного развития весьма сходных органов у филогенетически весьма удаленных форм.
Грушевидные органы
Наиболее сложные органы кожного вооружения представлены у турбеллярий многоклеточными грушевидными железами и железистыми шипами. Грушевидные органы (вооруженные железы, бутылкообразные железы, простатоидные органы, или мускулистые железистые органы) свойственны только двум отрядам — Acoela и Polycladida. Это многоклеточные пузыревидные железы, глубоко погруженные в паренхиму, выделяющие зернистый ядовитый секрет (рис. 18). Снаружи каждая железа одета слоем мускульных волокон. Наружный проток ее обычно имеет характер заостренного хитиноидного наконечника, или стилета, кутикулярной природы. Железа снабжена протракторами, при сокращении которых стилет высовывается и пронзает добычу, в то время как сокращением мускульной оболочки органа достигается выпрыскивание ядовитого секрета (Graff, 1904—1908; Bock, 1927).
Рис.
18. Грушевидные органы.
А
— Convoluta
convoluta (Acoela), Б
— Apidioplana
mira (Polycladida)
(A — no: Graff, 1904—1908, В
—
no: Bock, 1927). ер
—
эпидермис,
g
— клеточная
стенка железы, gc
— железистая
клетка, т
— мускульная мантия железы, р
—
наконечник, ра
—
паренхима, рг
—
протрактор, г — резервуар железы.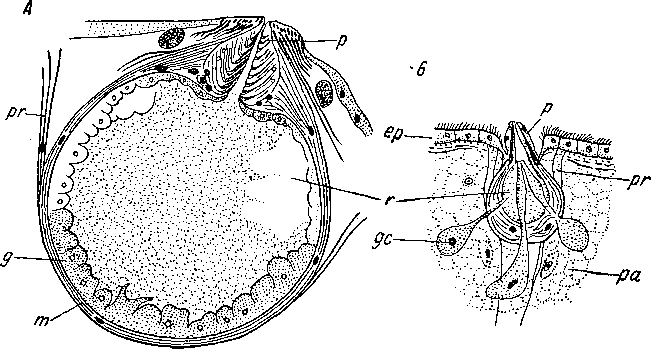
Ланг и Графф (Lang, 1884; Graff, 1904—1908) высказали предположение, что часть грушевидных органов у Polycladida и Acoela, изменив свою первоначальную функцию умерщвления добычи, перешла на службу половому аппарату. Эта концепция основана не только на принципиальном сходстве строения сравниваемых органов, но и на непосредственных наблюдениях над поведением живых червей. Так, Ланг неоднократно наблюдал у поли- кладид Thysanozoon diesingi и Pseudoceros superbus, содержавшихся в аквариуме, употребление совокупительных органов (у Pseudoceros их два) в качестве орудий нападения на других турбеллярий. При нормальном спаривании поликладид, происходящем обычно путем подкожной инъекции спермы, пенис наносит партнеру рану, в которой оставляется клубок спермиев. Со времен Ланга и Граффа свидетельства в пользу этого представления о происхождении некоторых типов мужских совокупительных и раздражающих органов значительно умножились. В недавнее
время они поддерживались В. А. Догелем (1952, 1954) и особенно В. Н. Беклемишевым (1937, 1964).
Для каждого подотряда Polycladida можно составить свой морфологический ряд олигомеризации грушевидных органов. Так,
Рис.
19. Polyposthides
affinis
(Polycladida).
Схема организации. (Из: Bresslau,
1928—1933).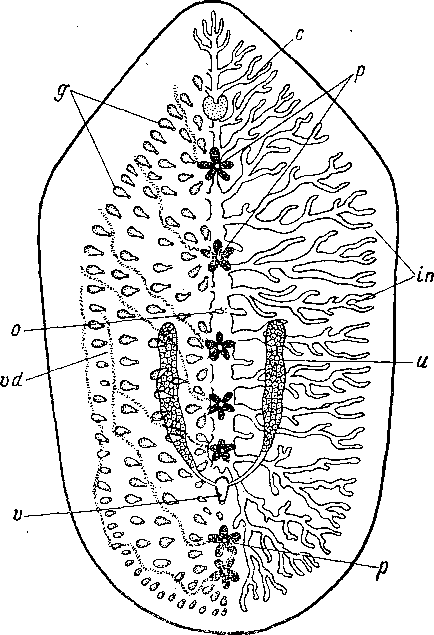
g — грушевидные органы, in, с — боковые ветви кишки, о ■— ротовое отверстие, р — мужские половые аппараты, состоящие каждый из пяти грушевидных органов, и — маточный канал, v — влагалище, vd — главные семяпроводы.
у Acotylea намечаются следующие модельные случаи олигомеризации.
Polyposthides (из примитивного семейства Polyposthiidae) — пелагические поликладиды, обитающие у берегов о. Калимантан, имеют множество грушевидных органов, покрывающих всю брюшную поверхность тела (рис. 19). Часть этих органов — ряд, расположенный вдоль срединной линии, — связана семяпроводами
и берет на себя функцию совокупительных органов (Palombi, 1923).
Apidioplana mira (Apidioplanidae), обитающая на колониях
горгонарий
в районе островов Фиджи, имеет до ста
грушевидных органов, расположенных по
бокам и в задней части
тела
на брюшной стороне (рис. 20). Один из
них, нахо- ос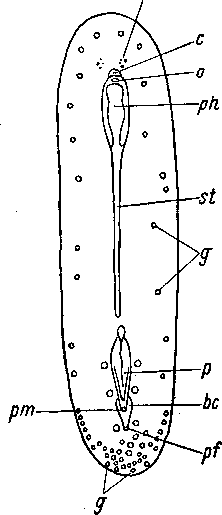
дящийся впереди женского полового отверстия, отличается крупными размерами и представляет собой мужской совокупительный орган (Воск, 1927). Этот пример, как и предыдущий, замечателен тем, что грушевидные органы не ограничены только генитальной областью.
Polyphalloplana bocki (Polyposthiidae) несет около 135 грушевидных органов в задней части тела, причем каждый имеет свой собственный семяпровод и открывается отдельным отверстием. Polyphalloplana, таким образом, обладает множеством мужских половых отверстий (Beauchamp,
1949, 1951).
Polyposthia (рис. 21) и Gryptocelides (и некоторые другие Polyposthiidae) обла-
Рис. 20. Apidioplana mira (Polycladida). Расположение грушевидных органов. (По: Воск, 1927).
Ьс — совокупительная сумка, с — мозг, g — грушевидные органы, о — ротовое отверстие, ос — глаза, р — пенис, pf — женское половое отверстие, ph — глотка, pm — мужское половое отверстие, st — желудок.
дают большим количеством грушевидных органов, окружающих мужской антрум и открывающихся в связанный с ним кожный карман (Bergendal, 1892—1893).
Многие Discocelidae — Discocelis, Adenoplana, Corodena — имеют много грушевидных органов вокруг пениса. Так, например, у Corodena mutabilis, живущей у атлантических берегов Северной Америки, 7 больших грушевидных органов помещаются в карманах мужского антрума в виде венца и еще около 50 мелких — на самом пенисе и в стенках антрума (Hyman, 1940). В этом случае пенис, по-видимому, не гомологичен грушевидному органу.
Diplandros singularis (Leptoplanidae) и Bergendalia (Stylo- chidae) сохранили только два непарных грушевидных органа, лежащих рядом, один позади другого. Но у первой формы оба органа прободены семяизвергательным каналом и играют роль пениса, а у второй — лишь передний (Laidlaw, 1903; Hyman, 1953; Е. а. Е. Marcus, 1966).Большинство Acotylea имеет один мужской совокупительный орган.
Параллельный ряд прослеживается и среди Cotylea.
Anonymus viridis (Anonymidae) снабжен двумя боковыми рядами грушевидных органов (9—11 в каждом ряду), пронизанных семяизвергательным каналом и функционирующих как пенисы и как органы нападения и защиты (рис. 22; Lang, 1884).
Представители Boniniidae по общему развитию и расположению грушевидных органов напоминают Discocelidae (из Acotylea).
...... У Paraboninia многочис-
• Г* К / • '• '
ленные
вооруженные грушевидные органы
располагаются на брюшной по- .р
верхности тела позади мужского антрума,
а у Во-
ninia
открываются
в него (Воск, 1923; Prudhoe,
1945).
Traunfelsia (Boninii- dae). Позади пениса имеется только один грушевидный орган. Этот случай совершенно аналогичен Bergendalia (из Acotylea).
х Is
Рис. 21. Polyposthia similis (Polycladida). Расположение грушевидных органов. (Из: Beauchamp, 1961).
" ЙИГ""
g — грушевидные органы, р —• совокупительный орган, pf — женское половое отверстие, рт — мужское половое отверстие.
"Л
Thysanozoon и некоторые виды Pseudoceros (Pseudoceridae) обладают одной парой грушевидных органов, превращенных в пенисы (Lang, 1884; Е. а. Е. Marcus, 1966).
Как и у Acotylea, многие представители Cotylea имеют один непарный пенис, гомологичный грушевидному органу.
Аналогичная смена функций и олигомеризация грушевидных органов свойственны представителям Convolutidae из отряда Acoela.
Начальная стадия процесса демонстрируется примитивной Convoluta sordida, у которой на брюшной стороне тела, преимущественно впереди рта, расположено около 200 грушевидных органов, причем все они играют роль органов защиты (Graff, 1904— 1908).
Следующий этап олигомеризации мы видим у представителей рода Oligochoerus.
Oligochoerus limnophilus, единственный пресноводный вид Acoela, описанный недавно из рек Центральной Европы (Ах и.
Dorjes, 1966), имеет 8 пар грушевидных органов, функцией которых, по мнению Акса и Дорьеса, должны быть захват и умерщвление добычи. Среди них нет еще органов, специализированных как генитальные (рис. 23).
Рис.
22. Anonymus
viridis (Polycladida).
Вид
с брюшной стороны. (По: Lang,
1884).
с — присоска, се — мозг, окруженный глазами, in — ветви кишечника, ос — краевые глаза, ov — яичники, р — совокупительные органы, ph — складчатая глотка, st — желудок (зачернен), t — семенники, vd — семяпроводы (зачернены).
О. bakuensis имеет 6 пар брюшных грушевидных органов (рис. 24, А). Самая крупная передняя пара, лежащая на уровне рта, и следующие три пары служат для поражения добычи. Две задние пары лежат в области женского и мужского половых отверстий — это генитальные органы, служащие, по-видимому, для раздражения партнера по копуляции (Беклемишев, 1963а).
0. erythrophthalmus обладает 4 парами грушевидных органов: две пары — позади рта, две — на уровне половых отверстий (Беклемишев, 1963а).
Convoluta convoluta с атлантических берегов Европы имеет три пары грушевидных органов (Graff, 1904—1908; Westblad,
. Оральная пара лежит на уровне рта, а две пары помельче — генитальные — возле мужского полового отверстия и сразу же позади него. Заднюю пару Графф считает запасной, замещающей переднюю, когда она изнашивается.
fn
Oligochoerus chlorella сохранил лишь две пары ядовитых органов — оральную и генитальную — возле мужского полового отверстия (рис. 24, Б\ Беклемишев, 1963а). Сходные отношения свойственны Convoluta hipparchia (Переяславцева, 1892) и С. convoluta с берегов Мурмана и Белого моря (Мамкаев, 1967).
Convoluta flavibacillum и
С. adaica имеют только одну генитальную пару в области муж^ ского антрума (Graff, 1904—1908; Westblad, 1946; Беклемишев, 1964), a Brachypea кепота — одну пару около женского полового отверстия (Antonius, 1968).
Рис. 23. Oligochoerus limnophilus (Acoela). Нервный аппарат, грушевидные органы, мужской совокупительный орган. (По: Ах u. Dorjes, 1966).
с — мозг, dn — спинной нервный ствол, fn — фронтальный нервный ствол, g — грушевидные органы, In — боковой нервный ствол, т — подвернутый боковой край тела, ос — глаз, р — совокупительный орган, st — статоцист, vn — брюшной нервный ствол, те — ложный семенной пузырек.
Conaperta кгата и С. thela отличаются наличием двух непарных грушевидных органов, лежащих один за другим позади мужского полового отверстия (Antonius, 1968).
Соблазнительно рассматривать кутикуляризованный совокупительный орган некоторых Acoela как видоизмененный грушевидный орган. Так, у Atriofrontapolyvacuola, недавно описанной Дорь- есом (Dorjes, 1968), конусовидный пенис состоит из хитиноидной трубочки — наконечника, которая выделяется окружающими его клетками матрикса (рис. 25). Своим основанием пенис примыкает к мускулистому семенному пузырьку, вместе с которым чрезвычайно напоминает грушевидный орган. Одно время предпола-
А
— О.
bahuensis,
В
— О.
chlorella.
(По:
Беклемишев, 1963а). bs
—
семенная сумка, со — мужской совокупительный
орган, g
—
грушевидные органы, gg
—
генитальные грушевидные органы, go
—
оральные грушевидные органы, га —
подвернутый боковой край тела, о
— ротовое отверстие, ос — глаз, ph
—
глотка, pf
—
женское половое отверстие, рг —
наконечники, st
—
статоцист, vd
—
семя- выносящий проток, vdrn
—
его мускулистый отдел, vg
—
влагалище.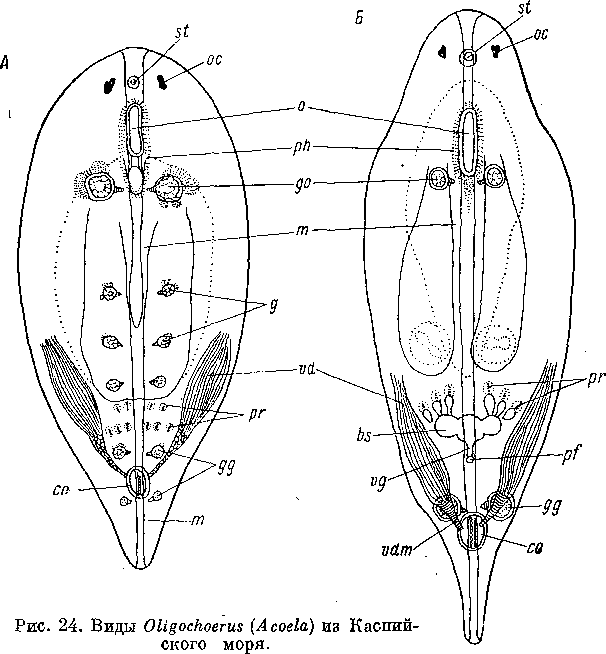
галось, что за счет грушевидных органов у некоторых Acoela, а именно у Tetraposthia,1 Childia, сформировалось несколько пенисов, которые затем испытали олигомеризацию, подобно тому как это происходило у Polycladida (Беклемишев, 1937, 1964; Догель, 1952, 1954). Однако при детальном изучении совокупительных органов обнаружилось, что мощные кутикулярные нако-
1 Позднее выяснилось (Westblad, 1948), что у Tetraposthia за часть совокупительных органов ошибочно принимали пучки спермиев.
49
А. В. Иванов и Ю. В. Мамкаев
нечники Childia и родственных форм лишены слоистой структуры, характерной для стилетов грушевидных желез Acoela, но состоят из пучка хитиноидных палочек или игл (Westblad, 1945). Это говорит против их гомологии с истинными грушевидными органами. Единственный пенис некоторых примитивных представителей других отрядов турбеллярий устроен по типу пениса Atriofronta или пениса поликладид. Иногда рядом с таким пенисом развиваются грушевидные органы, не служащие для выведения спермы, например у рабдоцелиды Phonorhynchoides flagellata. Изредка оба типа грушевидных органов могут использоваться и как органы нападения на добычу. Совокупительный орган Monogenoidea и Gastrotricha
Macrodasyoidea
тоже
построен по типу грушевидных
органов (Беклемишев, 1964).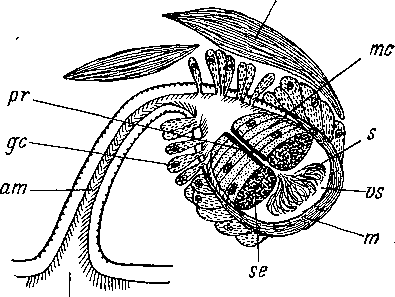
Рис. 25. Atriofronta poly- vacuola (Acoela). Копуля- гивный орган на продольном разрезе. (По: Dorjes,
1968).
am — мужской антрум, gc — железистая клетка, т — мускулистая стенка семенного пузырька, тс — клетки матрикса наконечника, рт — мужское половое отверстие, рг — наконечник (хитиноидная трубочка пениса), s — спермии, se — секрет, vs — семенной пузырек.
рт
По крайней мере часть семенных бурс также рассматривается как гомологи грушевидных органов (Graff, 1911а; Догель, 1952; Мамкаев, 1967). Бурсы (bursae seminales) — дополнительные органы женского полового аппарата — свойственны лишь части Acoela. Обычно бурса представляет собой тонкостенный мешочек, снабженный торчащим в паренхиму слоистым хитиноидным наконечником, и иногда открывается наружу посредством трубчатого влагалища.
В пользу этой гомологизации говорят следующие факты.
Структура бурсы нередко до деталей совпадает со строением типичного грушевидного органа.
Иногда, например у Oligochoerus bakuensis, О. chlorella (рис. 24) и Pseudactinoposthia daena (Marcus, 1954), передний конец бурсального наконечника сообщается с наружной средой узким каналом (Беклемишев, 1963а; см. также: Мамкаев, 1967, стр. 73, подстрочное примечание).
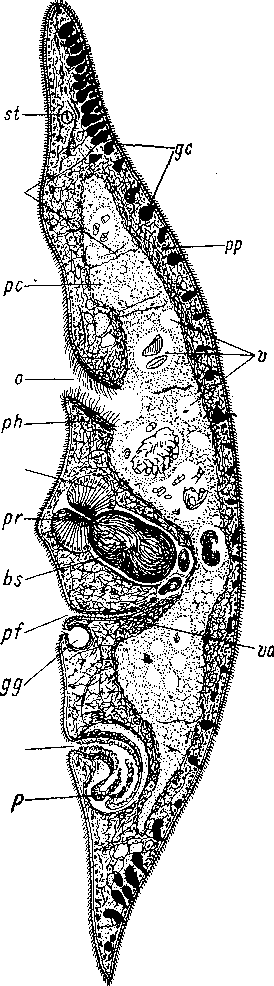
У некоторых конволютид — Convoluta convoluta, С. aegyptica, Brachypea кепота, Praeconvoluta primitiva и других — наконечник бурсы направлен не вперед, навстречу зрелому яйцу, как это обычно наблюдается у Acoela, а примыкает к вентральной стенке телаРис. 26. Convoluta convoluta (Acoela). Сагиттальный разрез. (Из: Bresslau, 1928—1933).
bs — семенная сумка, gc — железистые клетки, gg — генитальный грушевидный орган, тс — клетки матрикса наконечника, mdv — дорсо- вентральные мускульные волокна, о — ротовое отверстие, р — пенис, рс — пищеварительная паренхима, pf — женское половое отверстие, ph — глотка, рт — мужское половое отверстие, рр — периферическая паренхима, рг — наконечник, st — статоцист, ь — пищеварительные вакуоли с пищевыми частицами, ш — влагалище.
(рис. 26) и иногда даже связан с ней мускульными волокнами (Мамкаев, 1967; Antonius, 1968; Dorjes, 1968).
Генитальные раздражающие органы у Convoluta convoluta закладываются внутри тела и лишь позднее прорываются наружу (Westblad, 1946). Если таково их развитие, то очевидно, что оно легко может при- mdv вести к полному отрыву наконечника от стенки тела (Мамкаев, 1967).
Влагалище, соединяющее бурсу с внешним миром, встречается далеко не у всех форм. Несомненно оно появилось вторично, на что указывает развитие женского полового аппарата у Oligochoerus chlorella, у которого несколько снабженных ку- тикулярными наконечниками мешковидных бурс лишь в конце индивидуального развития животного получают сообщение с центральным расширением влагалища (рис. 24, Б).
Вероятно, семенные бурсы возникали многократно и независимо в различных систематических группах Acoela из разных зачатков, в том числе и из грушевидных органов. Этим, по-видимому, объясняется то, что их наличие или отсутствие не имеет особенно большого систематического значения (Dorjes, 1968).
У представителей рода Anaperus и у многих других форм рт
тс
нет настоящих бурс, так как они не имеют собственных стенок и в случаях множественного развития обнаруживают тенденцию к слиянию (например, у Oligochoerus chlorella). Однако строение
их кутикуляризованных наконечников типично для грушевидных органов, а наклонность к слиянию отнюдь не противоречит гомологии с грушевидными органами (Догель, 1952).
Трудно признать эндогенное происхождение бурс из элементов паренхимы, так как очень сомнительно, чтобы кутикуляр- ные хитиноидные образования вроде бурсального наконечника могли возникать не из дериватов эпидермиса.
|9. У ряда Acoela имеется не одна, а несколько, иногда множество семенных бурс (рис. 27) или бурсальных наконечников
(рис.
24, А).
Эти случаи представляют собой
различные переходные состояния от
множественных грушевидных органов
к одиночной бурсе (третий критерий
гомологии, по: Remane,
1956).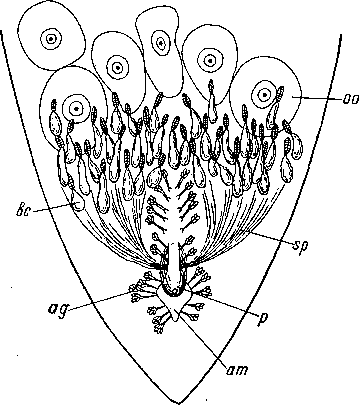
В. А. Догель (1952, 1954) хорошо иллюстрировал последовательную олигомеризацию бурс (от 64 до 1), их слияние, а также уменыпе-
Рис. 27. Polychoerus gardineri (Acoela). Задняя область тела. (По: Graff, 1911b).
ag — железистые шипы, am — мужской антрум, Ъс — семенные сумки с наконечниками, оо — ооцит, р — пенис, sp — потоки спермы.
ние числа наконечников у бурс, снабженных эпителиальными стенками (от 50 до одного). Его ряды теперь могут быть дополнены данными В. Н. Беклемишева (1963а), описавшего несколько интересных видов Oligochoerus из Каспийского моря.
Очень примитивное состояние мы находим у Polychoerus gardineri, который имеет от 64 до 32 бурс (рис. 27; Graff, 1911b), и у Oligochoerus limnophilus с его 40—10 бурсами (Ах u. Dorjes, 1966). У Anaperus tvaerminnensis — от 10 до 5 бурс (Luther, 1912). Описанные Беклемишевым виды Oligochoerus обладают различным числом наконечников — от 9 до одного. Особенно интересен
О. chlorella, у которого в онтогенезе можно наблюдать присоединение 6 отдельных первичных бурс с наконечниками к одной общей вторичной бурсе, возникающей на внутреннем конце влагалища (рис. 24, Б). Этот пример показывает, как мог образоваться путем слияния отдельных бурс большой бурсальный мешок со многими (до 50) наконечниками у Polychoerus caudatus (Mark, 1892) или большая сумка Amphiscolops с несколькими (A. langerhansi Graff, 1891) или с двумя наконечниками (A. cinereus Graff, 1874; А. Ъег- mudensis Hyman, 1939)
.
Итак, очевидно, часть семенных бурс у Acoela произошла из грушевидных органов путем смены их функций. В других отрядах такие же бурсы с кутикулярным наконечником встречаются лишь спорадически у форм, сохранивших еще очень примитивное строение женской половой системы. Прежде всего следует подчеркнуть, что бурса с кутикулярным и к тому жо слоистым наконечником, очень напоминающим мундштук грушевидного органа и семенной сумки у Convolutidae, свойственна Gnathostomulida (Мамкаев, 1961). Подобные же бурсы встречаются у некоторых Macrostomida (Bresslau, 1928—1933, fig. 234), Prolecithophora (Graff, 1911b, 1913; Meixner, 1938, fig 4F; Karling, 1940) и даже у Neorhabdocoela (Graff, 1913; Karling, 1940).
Железистые шипы
Железистые шипы, представляющие еще один тип кожного вооружения, по описанию В. Н. Беклемишева (1929), состоят из
Рис.
28. Achoerus
caspius (Acoela).
Железистый
шип на разрезе через заднюю стенку
антрума. (По: Беклемишев, 1929).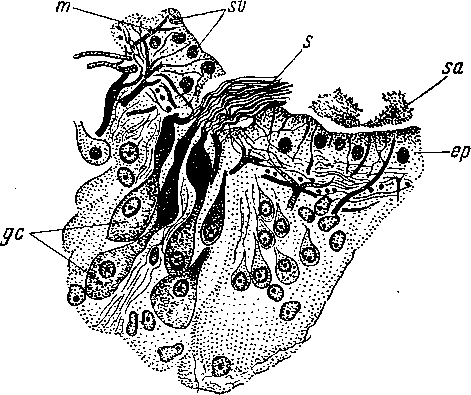
ер — эпидермис, gc — железистые клетки, т — интраэпите- лиальные окончания мускульных волокон, s — шип, состоящий из тонких трубочек, so — скопление секрета, si? — вакуоли секрета.
пучка тончайших палочек или трубочек, выделенных каждая отдельной грушевидной железистой клеткой (рис. 28). Эти клетки лежат в паренхиме у основания шипа, но имеют эпидермальное происхождение. Железистые шипы характерны для некоторых Acoela (сем. Anaperidae), но встречаются и у некоторых Polycladida
.
У поликладиды Enantia spinifera они входят в состав эпидермиса, особенно на боковых краях тела, так что их многочисленные ку- тикулярные шипы торчат наружу (Graff, 1890).
У
бескишечных турбеллярий железистые
шипы обнаруживают явную олигомеризацию
(Догель, 1952, 1954), что видно из следующего
морфологического ряда.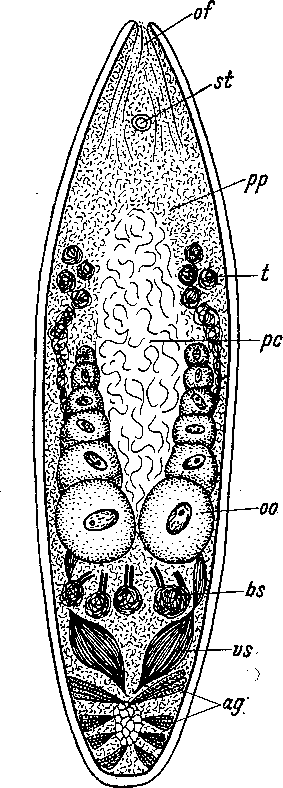
Achoerus caspius, A. sulcatus и A. ferox характеризуются наличием на стенках мужского антрума многочисленных и беспорядочно расположенных железистых шипов, несущих функции органов раздражения партнера по копуляции (Беклемишев, 1914).
У Polychoerus gardineri на брюшной стороне тела имеется несколько пар железистых шипов; кроме того, несколько пар находится в антруме (рис. 27). Все шипы служат для прикрепления к телу партнера во время спаривания и одновременно играют роль раздражающих органов. Общее их число колеблется от 42 до 37 (Graff, 1911b).
Anaperus rubellus имеет 20 шипов в мужском антруме (Westblad, 1945).
Anaperus tvaerminnensis обладает 8 шипами (рис. 29), причем два передних отличаются своими крупными размерами (Luther, 1912).
Pseudoconvoluta aurantiaca обладает одним или двумя железистыми шипами возле мужского полового отверстия; они несут функцию органов раздражения и локализованы совершенно так же, как грушевидные органы
Рис. 29. Anaperus tvaerminnensis (Acoela). Схема организации. (По: Dorjes, 1968).
ag — железистые шипы, bs — семенные сумки, of — фронтальный орган, оо — ооцит, рс — пищеварительная паренхима, рр — периферическая паренхима, st — статоцист, t — семенные фолликулы, vs — ложный семенной пузырек.
у Convoluta convoluta и С. flavibacillum (Беклемишев, 1929).
Часть железистых шипов, выполнявших первоначально роль раздражающих органов, меняет свою функцию, превращаясь в мужские совокупительные органы (см.: Беклемишев, 1937 и 1964), которые, по-видимому, потом олигомеризуются.Одну из начальных ступеней этого процесса мы видим у Ра- raphanostoma cycloposthium, у которой 10—20 одинаковых железистых шипов, функционирующих как пенисы, расположены венчиком (рис. 30).
У обитающего в Каспии Achoerus ferox к одному из многих железистых шипов, лежащих в мужском антруме, резко превосходящему по размеру остальные, примыкает большой ложный семенной пузырек, лишенный собственных стенок, сам же шип пронизан семяизвергательным каналом. К
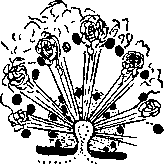
Рис. 30. Paraphanostomacycloposthium, (Acoela). Совокупительный аппарат, состоящий из радиально расположенных железистых шипов. (По: Westblad,
1948).
этому же типу совокупительных органов принадлежит пенис Paranaperus pellucidus (Беклемишев, 1964).
У Anaperus biaculeatus единственная сохранившаяся пара больших железистых шипов играет роль пенисов (Богута, 1970).
Морфологическое значение органов кожного вооружения
Подводя итоги, можно сказать, что развитие органов кожного вооружения — структур весьма примитивных и архаических — свойственно двум низшим отрядам Archoophora — Acoela и Polycladida. Исключение представляют только паракниды, развивающиеся лишь у части Proseriata. У Polycladida встречаются железистые шипы и грушевидные органы, но только последние приобрели большое эволюционное значение как один из источников формирования совокупительных органов. Наибольшее разнообразие органов кожного вооружения мы видим у Acoela. Именно в этом отряде имеются сагиттоцисты, иглообразующие железы, грушевидные органы и железистые шипы. Все эти типы органов используются для половой функции. Процесс вовлечения грушевидных органов и железистых шипов в построение полового аппарата сплошь и рядом заходит очень далеко, и при этом у ряда форм (Acoela, Polycladida, Prolecithophora, Lecithoepitheliata и Neorhabdocoela) дифференцировались настоящие совокупительные органы. Сравни- тельно-анатомическое значение сагиттоцист и иглообразующих желез гораздо скромнее, так как они, насколько мы знаем, остаются на самых первых этапах включения в половую систему да и нё могут быть использованы как дополнительные половые органы в силу своей одноклеточности.
Замечательно далее, что в процессе смены функций при переходе на службу половому аппарату все органы кожного вооружения испытывают постепенную олигомеризацию, которая легко иллюстрируется красивыми морфологическими рядами. Эти последние
служат хорошим подтверждением гомологии между исходным типом органов кожного вооружения и развивающимися из него органами половой системы (раздражающим органом, пенисом, семенной сумкой), так как отвечают основным требованиям третьего ремановского критерия гомологии (см.: Remane, 1956).. Характерно также, что в наиболее примитивном своем состоянии органы кожного вооружения обнаруживают признаки множественной закладки новообразующихся органов в понимании В. А. Догеля (1954), что свидетельствует об общей глубокой примитивности отрядов Acoela и Polycladida.
Теория происхождения мужских совокупительных органов из органов кожного вооружения (Waffentheorie der Penisent- stehung, по немецким авторам) нашла живой отклик у зоологов, изучавших турбеллярий. Некоторые из них отрицательно отнеслись к этой концепции, причем особенно серьезные возражения сделали Мейкснер, Акс и Рейзингер (Meixner, 1938; Ах, 1957; Reisinger, 1968).
Мейкснер утверждает, что построенные по одному типу мужские совокупительные органы, раздражающие органы, аденодактили и железистые органы, распространенные преимущественно среди высокодифференцированных видов и систематических групп, встречаются спорадически. Это говорит о том, что они представляют собой не филогенетически древние органы, унаследованные от Acoela, а независимо возникшие новообразования. Иначе говоря, это только аналогичные органы. В сущности Мейкснер, не обсуждая проблемы во всей ее полноте и вовсе не касаясь случаев множественного развития гомологичных органов, ограничивается лишь этим самым общим и голословным суждением о совокупительных органах высших турбеллярий. Между тем основные процессы эволюционного развития совокупительных органов, как мы видели, разыгрывались в низших группах Archoophora.
Акс справедливо полагает, что ключ к разрешению вопроса может дать изучение отдельных примеров множественного развития обсуждаемых органов. В то же время он принимает a priori, что все известные случаи такого рода есть результат вторичного умножения, или полимеризации, органов — процесса, протекавшего независимо у неродственных форм и сходного по своей природе с известным явлением полифарингии у некоторых планарий. Акс описывает очень интересные случаи развития нескольких одинаковых совокупительных органов у двух далеких друг от друга представителей Proseriata, именно у Monotoplana diorchis и Poly- styliphora filum (рис. 31), и показывает, что у первой формы ее несколько пенисов формируются последовательно один за другим из общего эмбрионального зачатка, сходно с развитием серии пенисов у Multipeniata kho (Prolecithophora), описанным Н. В. Насоновым (1932; рис. 32).
Эти примеры, касающиеся сравнительно высокоорганизованных турбеллярий, действительно можно толковать лишь как резуль
тат конвергентной полимеризации. Акс думает, что они дают нам право распространить этот вывод решительно на все известные случаи развития множественных совокупительных органов. После обсуждения возможных причин филогенетического процесса умножения совокупительных органов Акс (Ах, 1957) дает ему следующее «каузальное объяснение»: «Тотальные умножения органов распространены в природе как реальные мутации (Remane, 1956). Толкование внезапных умножений органов как реальных мутаций дает право рассматривать эти мутационные явления как причинный фактор умножения копу- лятивных органов, включая простатоидные органы, в большинстве сопоставленных вначале случаев» (стр. 247—248).
Однако
это объяснение ничего не объясняет.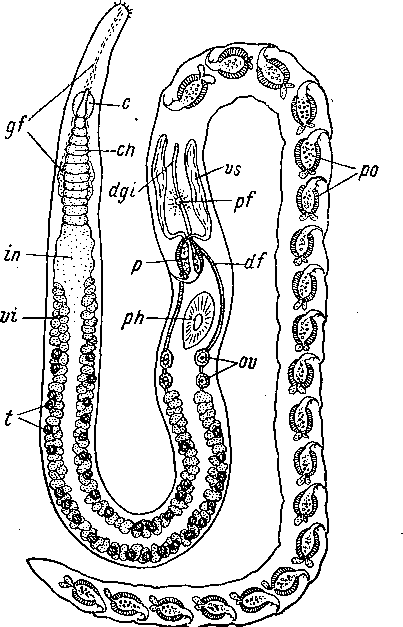
Рис. 31. Poly sty liphora filum (Proseriata). Общий вид. (По: Ах, 1957).
с — мозг, ch — головной отдел кишки, df — гермовителлодукт, dgi — auctus genito-mtestinalis, gf — фронтальные железы, in — кишка, р — мужской совокупительный орган, pf — женское половое отверстие, ph — глотка, ро — простатические органы, ov — яичники (гермарии), t — семенники, vi — желточники, vs — семенной пузырек.
Следует, разумеется, отличать явные случаи вторичной полимеризации органов у высокодифференцированных форм вроде исследованных Аксом Proseriata от первичной множественности некоторых органов у Acoela и Polycladida. Последовательную закладку многих одинаковых органов из одного эмбрионального зачатка, явно развившуюся как вторичное изменение онтогенеза, невозможно себе представить у таких примитивных форм, как например Convoluta distorta, Apidioplana mira или Polyposthiidae с их многочисленными грушевидными органами.
Рейзингер описал совершенно исключительный случай смены функций мужского совокупительного органа с полным отделением его от мужского полового аппарата у одного из представителей
Lecithoepitheliata — Xenoprorhynchus steinbocki (рис. 33, Б; Reisinger, 1968). Характерная особенность всех Prorhynchidae заключается в том, что мужской совокупительный орган с колющим кутикулярным пенисом сообщается с ротовой полостью, находящейся на переднем конце тела, тогда как женская половая система открывается на брюшной стороне тела (рис. 33, А). Однако у Хе- noprorhyncus семяпровод отделен от совокупительного органа и, очевидно, вторично присоединен к женскому антруму, который, таким образом, превратился в общее половое преддверие (atrium
Рис.
32. Multipeniata
kho
(Prolecithophora).
Ряд копулятивных органов, развивающихся
последовательно друг за другом. (По:
Насонов, 1932).
gc
—
железистые клетки, р — пенис, s
—
мешок пениса, vs
—семенной
пузырек.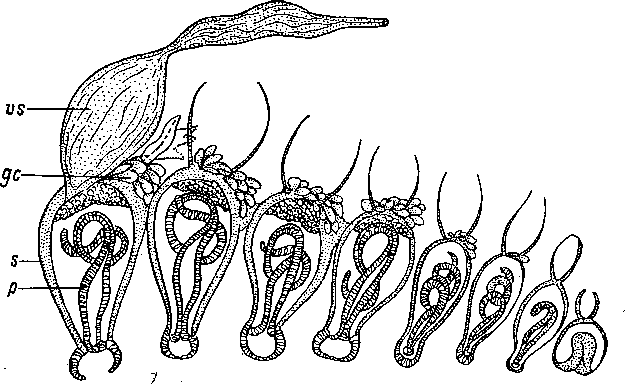
commune). Полностью отделившийся совокупительный орган сохранил все основные черты, характерные для Prorhynchidae, но совершенно утратил половую функцию и служит исключительно для обороны от врагов и для поражения добычи.
Не
приходится сомневаться, что эта смена
функций носит вторичный характер.
Xenoprorhynchus
хотя
и представляет собой типичного
представителя Prorhynchidae,
отличается
рядом несомненных прогрессивных
особенностей и должен рассматриваться
как наиболее высокодифференцированный
член этого семейства. Этот пример, по
мнению Рейзингера, говорит против теории
Ланга и Граффа о происхождении мужских
совокупительных органов из органов
кожного вооружения. Половая функция
совокупительного органа должна быть
первичной, а защитная — вторичной, а не
наоборот, как предполагает эта теория.
Поэтому появлению нового ядовитого
органа у Xenoprorhynchus
должно
было предшествовать значительное
вторичное расширение функций совокупи-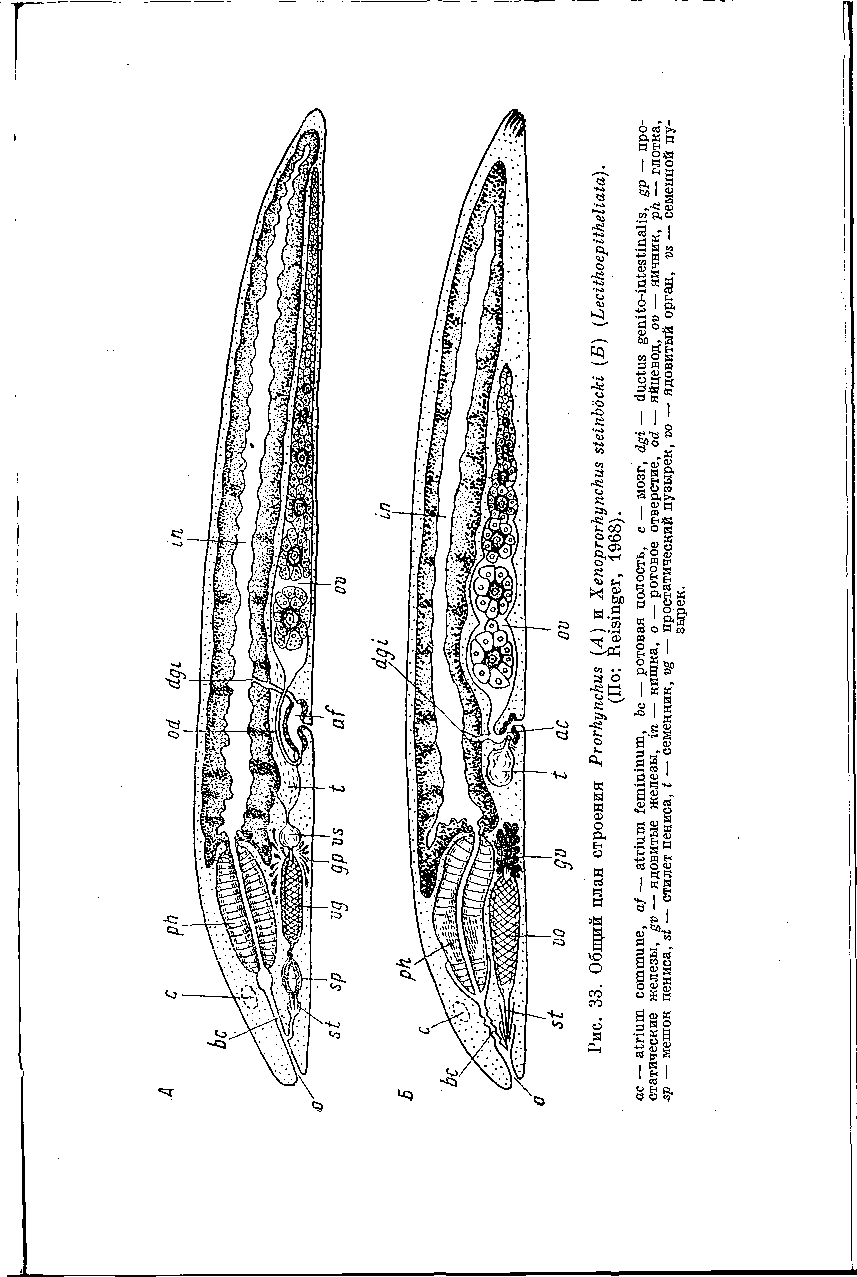
тельного аппарата — к его первоначальной половой функции добавилась новая функция нападения и защиты. И действительно, говорит Рейзингер, у близкородственного рода Prorhynchus секреторный аппарат и стилеты пениса служат не только органами спаривания, но употребляются и как оружие при нападении на добычу. Такое же расширение функций, возникшее независимо, замечено и у Gyratrix (Neorhabdocoela, Kalyptorhynchia).
Разумеется, Рейзингер прав, признавая вторичный характер эволюционных процессов, приведших к появлению нового ядовитого органа у Xenoprorhynchus. Мы не думаем, однако, что этот вторичный процесс заставляет отказаться от признания первичной смены функций, в результате которой грушевидные органы примитивных турбеллярий, находящихся на организационном уровне Acoela или Polycladida, превратились в органы совокупления. Первичная, защитная функция еще долгое время сочеталась у многих форм со вторичной, половой. Это состояние известной широты функций проявляется и у многих современных турбеллярий, сохранивших еще архаический тип совокупительного аппарата, гомологичного грушевидному органу. Оно наблюдалось еще Лангом у ряда Polycladida и неоднократно отмечалось при наблюдениях поведения у особей Prorhynchus stagnalis и рабдоцелид Gyratrix hermaphroditus и Astrorhynchus bifidus. Поэтому, вряд ли можно предполагать вторичное расширение функции совокупительного органа у непосредственных предков Xenoprorhynchus. Способность его выполнять функции нападения и защиты следует считать не новоприобретением, а сохранившимся древним свойством.
Итак, вопреки Рейзингеру мы думаем, что наиболее вероятная последовательность событий была следующей. У древних, очень примитивных турбеллярий существовало большое количество слабо дифференцированных, более или менее беспорядочно рассеянных органов кожного вооружения (грушевидных органов или железистых шипов). Часть из них путем смены функций перешла на службу половому аппарату и превратилась в органы раздражения и копуляции. Затем произошла резкая олигомеризация — у большинства турбеллярий остался один мужской совокупительный орган. Последний у многих форм сохранял еще и функции органа защиты и нападения. Наконец, Xenoprorhynchus совершил как бы возврат к прежнему состоянию, но, однако, на новой основе, при гораздо более совершенном строении совокупительного органа, обладающего своей специальной иннервацией. Поэтому этот «возврат» нельзя рассматривать как повторение уже пройденного этапа.
С точки зрения авторов, видящих в примерах множественного развития копулятивных органов всегда только результат вторичного умножения (кроме упомянутых выше, также Гайман (Hyman, 1951) и Бошан (Beauchamp, 1961)), невозможно найти удовлетворительное объяснение биологической целесообразности умножения совокупительных органов 0 щх гомологов у низших тур'
беллярий Acoela и Polycladida. Какой смысл может быть в замене немногих совершенных органов многочисленными, но слабо дифференцированными? Приняв же теорию Ланга и Граффа, мы получаем возможность объяснять процесс эволюции органов кожного вооружения как постепенную олигомеризацию и дифференциацию множественных и примитивных вначале органов, приводящую к значительному их совершенствованию.
Пищеварительная система
Положение ротового отверстия
Крайняя
изменчивость положения рта — несомненно
одно из ярких проявлений общей
примитивности турбеллярий. Ни в одной
группе животного мира оно не варьирует
в таких широких пределах. Acoela
в
этом отношении явно выделяются.
Большинство представителей этого отряда
обладает брюшным ртом, но у трех видов
Diopis-
thoporus
рот
лежит на заднем полюсе (рис. 34), а у
Proporus,
Hallangia
и
Hof-
stenia —
на
переднем конце тела (рис. 35).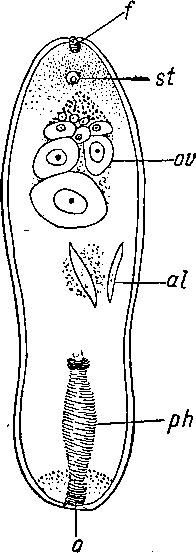
Prolecithophora (примитивный отряд Neo- ophora) представляют собой второй отряд с почти столь же изменчивым положением рта. Среди них Urostomatidae имеют кау- дально лежащий рот. У Polycladida ротовое отверстие всегда вентральное; чаще всего оно сдвинуто к заднему концу, реже — к переднему концу тела.
На том сомнительном основании, что у преобладающего большинства турбеллярий ротовое отверстие лежит на брюшной
Рис. 34. Diopisthoporus longitubus (Acoela) в состоянии женской зрелости. (По: Westblad, 1940).
al — заглоченные диатомовые водоросли, f — фронтальный орган, ph — глотка, о — ротовое отверстие, ov — яичник, st — статоцист.
стороне тела, многие авторы считают именно эту его локализацию исходной для класса (Bresslau, 1928—1933; Meixner, 1938; Westblad, 1948; Hyman, 1951; Ливанов, 1955; Ax, 1961). Между тем, по справедливому замечанию В. Н. Беклемишева (1964), за первичное положение рта у турбеллярий следует принять заднее. Ротовое отверстие у турбеллярий гомологично бластопору, который у Ме~ tazoa закладывается на, заднем, или вегетативном, полюсе зародыша.(наружные кольцевые и внутренние продольные слои). Однако такого рода отличия не могут иметь серьезного филогенетического значения вследствие своей большой изменчивости, как это видно на примере Protomonotresidae (из Prolecithophora)', в этом семействе наряду с формами, обладающими обычным расположением глоточных мускульных слоев, есть виды, сходные в этом отношении с Plicastoma (Riedl, 1954; Ах, 1961). Впрочем, Акс не
Рис.
37. Основные типы глотки у турбеллярий.
Схема. (По: Ах,
1961).
А
— простая глотка, Б
— складчатая, В
— массивная глотка, cm
—
кольцевой мускульный спой, ест
— наружный кольцевой мускульный слой,
elm
—
наружный продольный мускульный слой,
ер
— эпителий глоточного влагалища, или
кармана, g
—
железистые клетки, г
— стенка кишки, гст
— внутренний кольцевой мускульный
слой, Пт
— внутренний продольный мускульный
слой, 1т
— продольный мускульный слой, п.
— кольцевой нерв, г — радиальный мускул,
s
—
мембрана,' отделяющая глотку от окружающей
паренхимы.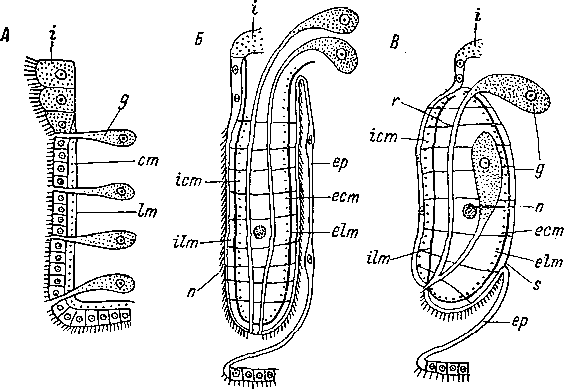
исключает и возможности независимого происхождения складчатой глотки Polycladida и Prolecithophora. Некоторым турбелля- риям со складчатой глоткой свойственна полифарингия, возникающая вследствие полимеризации глотки. Несколькими глотками, развивающимися от задних ветвей кишечника, отличаются пресноводные планарии Crenobia sp. sp., Pkagocata gracilis и Digono- phyla harmeri. У последней развивается до 100 глоток и до 63 ротовых отверстий. Среди поликладид Diplopharyngeata нормально обладает двумя глотками, а среди морских трикладид много- глоточность встречается как уродство.
Массивная глотка — pharynx bulbosus — произошла из складчатой глотки путем отделения тела глотки от окружающей паренхимы посредством пограничной пластинки (рис. 37, В). Массивная глотка имеет слабее развитый и менее подвижный выступ. Раз- итие мускулов ретракторов и протракторов делает ее очень подвижной, но она не может высовываться так далеко наружу через ротовое отверстие, как складчатая глотка. Тем не менее и массивная глотка представляет собой очень мощный сосательный и глотательный орган. Среди Archoophora массивная глотка отсутствует. Среди Neoophora массивной глоткой обладают Lecithoepitheliata, часть Prolecithophora, почти все Neorhabdocoela, в том числе Tern- nocephalida, а также Udonellida. В несколько измененном виде массивная глотка свойственна Nemathelminthes.
©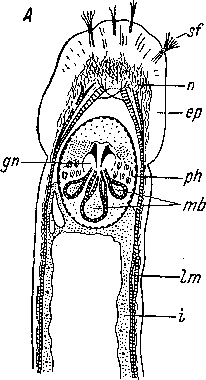
Рис. 38. Строение глотки Gnathostomulida.
А — Gnathostornula paradoxa, фронтальный разрез переднего конца тела; В, В — Mesognatharia гетапег: В -— базальная пластинка, В — челюсти (А — по: Ах, 1956; Б ж В — по: Sterrer, 1966). ер — эпидермис, gn — челюсти, г — кишка, 1т — продольная мускулатура, mb — мускульные луковицы глотки, п — интразпидермальный нервный слой, ph — глотка, sf — осязательные щетинки.
Различаются три формы ph. bulbosus: изменчивая глотка — ph. variabilis, розетковидная — ph. rosulatus и бочонковидная — ph. doliiformis (см. исчерпывающий сравнительно-анатомический анализ в кн.: Karling, 1940). Pharynx variabilis, свойственный Prolecithophora и Lecithoepitheliata, отличается погруженным эпителием, развитой внутренней продольной мускулатурой, прилегающей к каналу глотки, и преобладанием внутриглоточных желез (рис. 39, Б—Г). По Карлингу, у различных видов Plagiosto- тит (Prolecithophora) обнаруживаются переходные состояния от ph. simplex к ph. variabilis (рис. 39, Б, В). В том же семействе Plagiostomidae описаны и другие независимые случаи возникновения ph. variabilis (Riedl, 1959b). Поэтому Акс вполне резонно считает параллельное многократное развитие этого типа глотки у Prolecithophora очень вероятным.
5 А. В. Иванов и Ю. В. Мамкаев
65
Рис.
39. Филогенетическое выведение подтипов
массивной глотки от стадии складчатой
глотки по Аксу (Ах, 1961).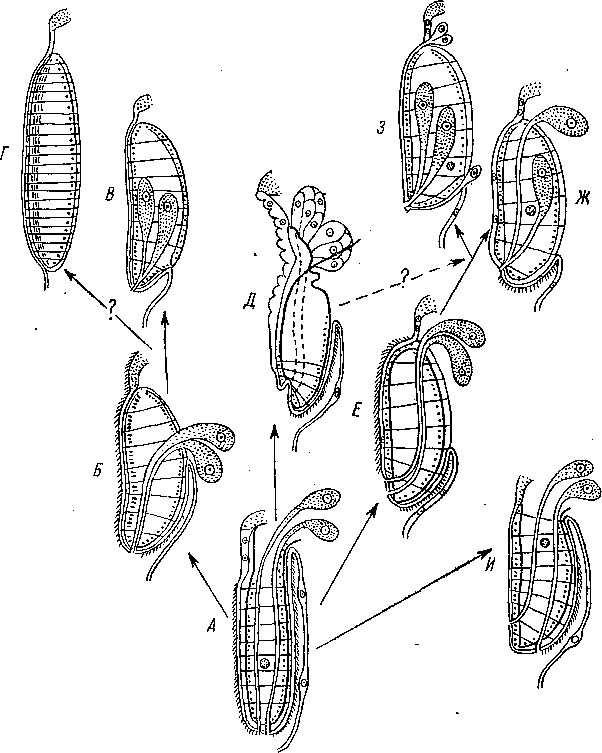
А — складчатая глотка; В — примитивный pharynx variabilis у Prolecitko- phora (Plagiostomum ponticum) с внешним и внутренним ресничным покровом и с внеглоточными железами; В — более совершенный ph. variabilis У Prolecithophora (тип Plagiostomum lemani) — глоточное влагалище уменьшено, ресничный покров редуцирован; Г — ph. variabilis у Lecithoepitheliata (Pro- rhynchus)', Д — ph. bulbosus у Solenopharyngidae (Anthopharynx vaginatus); E — глотка Ciliopharyngiella intermedia (Proseriata) с комбинацией признаков ph. plicatus и ph. rosulatus; Ж — ph. rosulatus (Typhloplanoida); 3 — ph. do- liiformis (.Dalyellioida)', И — ph. plicatus у Bulbotoplana acephala (Proseriata, Otoplanidae) (А, Б и И — по: Ax, 1956; В, Д, 3, Ж — по: Karling, 1940; Г — по: Steinb6ck, 1927; Е — по: Ах, 1952).По мнению Карлинга, разделяемому Аксом, глотка Lecithoepi- theliata произошла от примитивного ph. variabilis Prolecithophora путем редукции глоточного влагалища и ресничного покрова (рис. 39, Г). Однако, как уже указывалось, недавно Штейнбек доказал несомненное родство между Hofsteniidae (Acoela) и Рго- rhynchidae (Lecithoepitheliata) (Steinbock, 1966; см. также: Rei- singer, 1968). Правда, последовательность мускульных слоев в глотке Prorhynchus обратна обычному — наружное положение занимают не кольцевые, а продольные слои, однако совсем такой же порядок слоев свойствен Hofsteniola pardii (Papi, 1957). Далее, у примитивного представителя проринхид — Hofsteniople- sia haswelli — ткани глотки еще нерезко отграничены от окружающей паренхимы, т. е. налицо признак настоящего ph. simplex. Наконец, Prorhynchidae лишены глоточного кармана, наличие которого в глотке Prolecithophora, естественно, не говорит в пользу тесного родства этих двух групп. Таким образом, все особенности ph. variabilis у Prorhynchidae легко выводятся из отношений, характерных для Hofsteniidae.
Эволюция pharynx rosulatus и ph. doliiformis рассмотрена Аксом (Ах, 1961, 1963а). Первый тип глотки, характерный для Typhloplanoida, отличается несколько более примитивным состоянием (рис. 39, Ж), признаки которого рассеяны спорадически у разных представителей этого подотряда. Это — ресничный покров внешних краев глотки и частично внеглоточные железы. Ph. doliiformis, свойственный подотряду Dalyellioida, характеризуется редукцией ресничек и миграцией содержащих ядра клеточных тел эпителия в зоб (рис. 39, 3). По Карлингу, существует тесная связь между глотками рабдоцелид и Solenopharyngidae, которых причисляют то к Neorhabdocoela (Karling, 1940), то к Prolecithophora (Meixner, 1938). Акс установил также несомненное сходство их с Ciliopharyngiellidae, принадлежащими к Proseriata, и на этом основании выводит глотку Neorhabdocoela от ph. plicatus предков современных Proseriata, а сходство с Solenopharyngidae рассматривает как результат конвергентного развития.
Наконец, недавно Карлинг описал особенно сложно устроенную глотку у Gnosonesima (Lecithoepitheliata) (Karling, 1968). Она состоит из двух частей — так называемой внутренней глотки массивного типа и внешнего мускулистого и очень подвижного конуса, весьма напоминающего хоботок Eukalyptorhynchia (Neorhabdocoela). По мнению Карлинга, глотка Gnosonesima (рис. 40) не может быть отнесена ни к одному из трех дотоле известных типов глотки, поэтому он предлагает называть ее pharynx coniformis. Сходство конусовидного выступа глотки с хоботком Eukalyptorhynchia, разумеется, носит характер аналогии (Karling, 1968).
С большим удовлетворением мы можем сделать здесь интересный для нас вывод. Первоклассный знаток турбеллярий Петер Акс, придающий строению глотки первостепенное филогенетическое значение и делающий на основе сравнительного ее изучения
о
с — канал глотки, се — ресничный поясок глотки, се — мозг, eg — железистая клетка, cm — кольцевая мускулатура, di — диафрагма, ограничивающая мембрана глотки, gf — проток фронтальной железы, gph — железы глотки, in — кишка, пс — нервное кольцо глотки, о — рот, cph — карман глотки, oes — пищевод, phi — «внутренняя глотка», п — внутренний ретрактор, rph — ретрактор глотки, sc — чувствительная ямка.основные выводы о происхождении отдельных отрядов, вынужден признать в ряде случаев независимое происхождение таких сложных органов, как высшие типы глотки.
Кишка
Еще сто лет тому назад В. Н. Ульянин (1870) разделил всех турбеллярий по отсутствию или наличию кишки на две группы: Acoela и Coelata. Первые полностью лишены кишечника в обычном понимании этого слова, и химическая обработка пищи совершается у них в паренхиме преимущественно посредством внутриклеточного пищеварения. Паренхима Acoela в гистологическом отношении может быть охарактеризована только как смешанная паренхима, т. е. как первичная клеточная структура с очень слабо выраженной сегрегацией однородных клеток и зачаточным ткане- образованием (см. выше). В эволюционном смысле паренхима Acoela характеризуется как сравнительно слабо изменившийся фагоцитобласт двуслойного предка Metazoa, а в сравнительноэмбриологическом аспекте — как общий зачаток внутренних зародышевых листков, еще не разделившийся полностью на центральный й периферический фагоцитобласты (энтодерму и мезодерму).
Таким образом, вопреки мнению многих современных авторов (Remane, 1951, 1958; Ливанов, 1955; Marcus, 1958; Ах, 1961; Федотов, 1966) вслед за И. И. Мечниковым, Л. Граффрм и В. Н. Беклемишевым мы считаем отсутствие эпителиального кишечника у Acoela их первобытной и примитивной особенностью.
Строение и клеточный состав пищеварительной паренхимы очень разнообразны у различных представителей Acoela; существуют разные ее типы и могут быть намечены определенные тенденции ее эволюции (Graff, 1882, 1891, 1904—1908; Bohmig, 1895). Вслед за классиками-турбелляриологами Бресслау (Bresslau, 1928—1933) различал несколько типов пищеварительной паренхимы. Все они характеризуются развитием заполняющей все тело плазматической массы (которую многие авторы рассматривают как синцитий).
При более примитивном строении паренхимы в этой массе рассеяны клетки разного рода — опорные, соединительнотканные, блуждающие фагоциты (рис. 41), а также амебоциты, обладающие широкими потенциями, и среди них — первичные половые клетки. Кроме того, паренхима содержит созревающие мужские и женские половые элементы, тела погруженных кожных желез, нервные клетки мозга, нервные стволы и пересекается многочисленными мышечными волокнами. Такое состояние паренхимы известно у Proporus venenosus, Convoluta sordida (рис. 7; Graff, 1904— 1908) и у Oxyposthia praedator (Иванов, 1952a).
Дальнейшая эволюция паренхимы в основном сводится к постепенному разделению ее на периферическую часть, в которой сосредоточены клеточные (преимущественно соединительноткан
-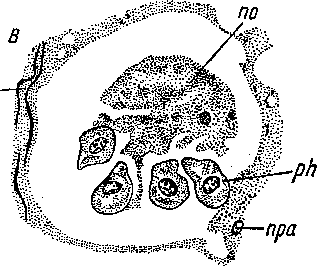

Рис. 41. Oxyposthia praedator (Acoela). Блуждающие фагоциты паренхимы. (По: Иванов, 1952а).
А — фагоцит с заглоченной пшцей, В — фагоциты в центральной пищеварительной паренхиме, В — фагоцитирующие пищеварительные клетки, ер — цитоплазма, dl — пищевые включения, т. — миофибриллы, по — пищевая масса, пра — ядро клетки паренхимы, ра — паренхима, ph — фагоцит.
т
ра
ные) элементы, и на центральную пищеварительную область, в ва-куолях которой переваривается проглоченная добыча. У Аескта-lotus pyrula, паразитирующего в кишечнике голотурии Eupyrgus,опорные и соединительнотканные клетки еще перемешаны с пище-варительной плазматической массой, и только в самом центретела имеется свободное от них пространство. У Convoluta convoluta(рис. 42) ,WAphanostoma pallida и у других видов паренхима дости-гает наиболее'полного разделения на две части (Graff, 1904—1908;д Беклемишев, 1915; Bresslau, 1928—1933).
<з7х Периферическая паренхима нередко содер-
жит опорные вакуоли. Несмотря на полное
обособление, центральная пищеварительная часть паренхимы по- прежнему пронизывается дорсо-вентральными мускульными волокнами. Иногда эта особенность сохраняется за пределами Acoela даже после полной эпителизации кишечника, например у Phae- nocora polycirra из отряда Neorhabdocoela (рис. 43, А; Беклемишев, 1929). «С этого момента, — пишет В. Н. Беклемишев (1964, II, стр. 165), — у Acoela, как и у высших кишечнополостных, можно различать центральный фагоцитобласт, пищеварительный, от периферического, лишенного этой функции, или, точнее, сохраняющего ее в ограниченной степени. Последнюю оговорку приходится делать ввиду того обстоятельства, что способные к фагоцитозу клетки сохраняются в известном количестве в периферическом фагоцитобласте всех высших Metazoa, начиная с турбеллярий (прославленное открытие И. И. Мечникова (1883). . .); у большинства животных они служат для уничтожения проникших в организм микробов, для удаления посторонних частиц и экскретов. . . Фагоциты периферического фагоцитобласта некоторых живот-
ных принимают деятельное участие в пищеварении, на время проникая для этого в полость кишечника; в особенности это относится к иглокожим, пластинчатожаберным и низшим брюхоногим моллюскам».
1904—1908).
cm
—
кольцевой мускульный слой, ср
— центральная паренхима, dvm
—
дорсо-вентральные мускулы, ер
— эпителиальная пластинка, g
—
железистые клетки глотки, gc
—
железистые клетки покровов, 1т
— продольный мускульный слой,
nph—глоточный
нерв, оо
— ооцит, ph
—
глотка, рр
•— периферическая паренхима, v
—
вакуоль в центральной паренхиме, х
— симбиотические водоросли.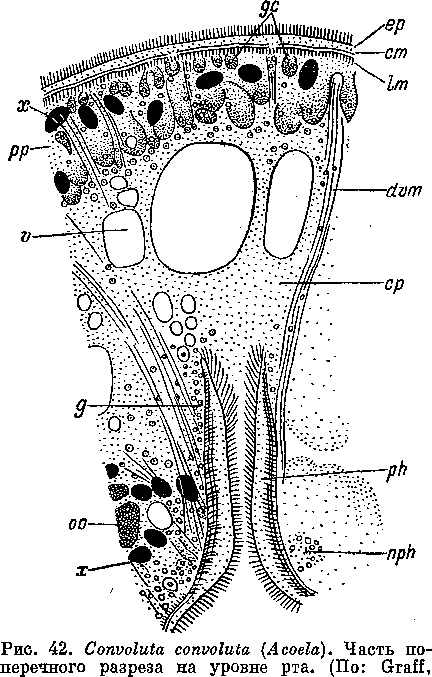
У Xenoturbellida и у всех остальных Turbellaria периферический фагоцитобласт сохраняет аморфное строение, но из центральной пищеварительной паренхимы формируется мешковидный кишечник, слагающийся из амебоидного эпителия (термин И. И. Мечникова). Однако у громадного большинства турбеллярий кишечник обладает лишь неустойчивой эпителиальной струк-
Рис.
43.
Примитивные особенности кишечника
некоторых Neorhab
docoela.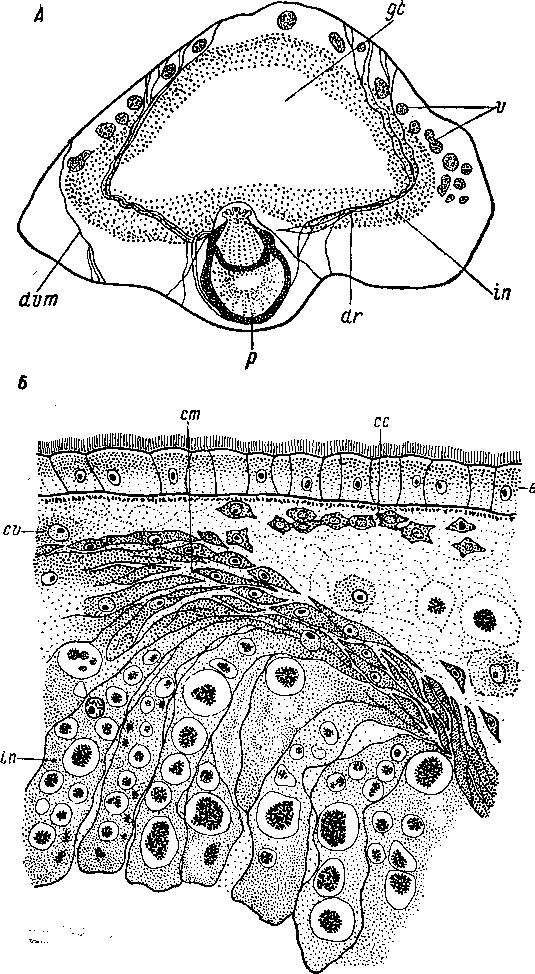
А — Phaenocora polycirra. Проникновение дорсо-вентральных мышц сквозь эпителий кишечника. (По: Беклемишев, 1929). Б — Pte- rastericola fedotovi. Физиологическая регенерация за счет клеток паренхимы. (По: Беклемишев, 1916). сс — соединительнотканные клетки, от — клетки «кишечной мембраны», от —• вакуолизирован- ные клетки паренхимы, dr — ретрактор совокупительного органа, гомолог дорсо-вентральных мышц, проходящий сквозь эпителий кишки, dvm — дорсо-вентральные мускулы, ер — эпидермис, go — полость кишки, in — эпителий кишки, р — совокупительный ор ган, v — ветви желточника.турой, которая легко заменяется временным паренхиматозным или синцитиальным состоянием. Это явление, часто называемое физиологическим синцитированием, очень широко распространено. По данным многих авторов (Westblad, 1922; Willier, Hyman а. Rifenburgh, 1925; Reisinger, 1959; Jennings, 1968), обратимое формирование синцитиального кишечника есть нормальная физиологическая фаза, связанная с внутриклеточным пищеварением
Рис.
44. Dugesia
dorotocephala
(Tricladido,).
Кишечный
эпителий в
разных
физиологических состояниях. (По:
Willier,
Hyman a. Rifenburgh, 1925).
А
— через три дня после кормления бычьей
печенью, все пищеварительные вакуоли
достигли стадии эозинофильных шаров,
видны территории отдельных клеток; Б
— через 6 часов после кормления,
синцитиальное состояние эпителия, п
— ядра, v
—
пищеварительные вакуоли в различных
физиологических состояниях, vl
—
жировые включения.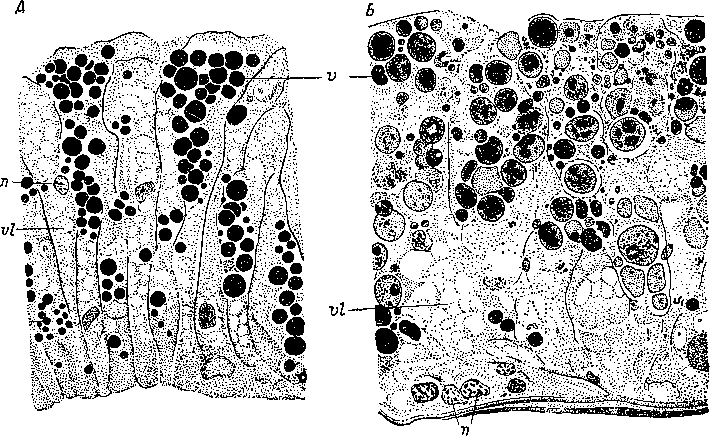
турбеллярий. У трикладид, например, клетки кишечного эпителия сначала обогащаются водой, сильно разбухают, затем переходят в напоминающее паренхиму состояние амебоидной активности и фагоцитоза и, наконец, сливаются в синцитий (рис. 44,
А, Б). Далее, по окончании пищеварения, эпителиальное строение кишки восстанавливается. Очевидно, смена эпителиальной и паренхиматозной или синцитиальной фаз пищеварения, так же как и продолжительность и устойчивость одной и другой, в сильной степени зависят не только от систематического положения данной формы, но и от режима питания.
При неустойчивой эпителизации кишечника, однако, внутриклеточное пищеварение обычно комбинируется с полостным. Так, у Mesostoma (Neorhabdocoela), у которой еще И. И. Мечников наблюдал внутриклеточное пищеварение, добыча, заглатываемая целиком или разорванная и размятая глоткой, сначала перева
ривается в полости кишки (Jennings, 1968). У планарий пищеварение также начинается как полостное. Секрет глоточных желез и зернистых железистых клеток кишки содержит эндопептидазы, вызывающие протеолизис (у Polycelis, Orthodemus и Bdelloura, по: Jennings, 1962, 1963).
Итак, неустойчивая эпителизация кишечника свойственна преобладающему большинству турбеллярий, в том числе всем Neo- ophora, несмотря на то что в других отношениях, например по строению половой системы, эти формы стоят на высокой ступени развития. Полного одновременного прогрессивного развития всех систем и органов ни в одной группе мы никогда не наблюдаем. Неудивительно поэтому, что среди Neoophora имеются отдельные виды и группы с примитивной дифференциацией кишечника. Обычно это формы, питающиеся мелкой пищей, подходящей для фагоцитоза, обладающие почти исключительно внутриклеточным пищеварением. К ним относятся многие Prolecithophora, Proxenetidae и Kalyptorhynchia из Neorhabdocoela, у которых кишка сохранила еще признаки пищеварительного синцития.
Некоторые определенные сдвиги от ацельного типа пищеварительного аппарата к оформленному кишечнику проявляются прежде всего у самих Acoela. Так, у Nemertoderma в центральной пищеварительной паренхиме, довольно явственно отличимой от периферической паренхимы, имеются уже железистые зернистые клетки, чрезвычайно напоминающие одноклеточные железы — так называемые Kornerkolben, или железы Мино, весьма характерные для самых различных турбеллярий с эпителизованным кишечником. Кроме того, у Nemertoderma небольшие пищеварительные полости имеют тенденцию сливаться в единую кишечную полость (рис. 36), что, впрочем, свойственно и ряду других Acoela (рис. 45; Westblad, 1948; Riedl, 1959а; Мамкаев, 1967). У ближайшего родича Nemertoderma — Meara stichopi, паразита трепанга, имеется уже эпителиальный кишечник (Westblad, 1949b). Это неоспоримый пример возникновения настоящей кишки среди Acoela. Кишечный эпителий Меага слагается из двух сортов клеток — амебоидных пищеварительных, способных к фагоцитозу, и зернистых клеток Мино. Некоторые черты настоящего кишечника обнаруживаются и в пищеварительном аппарате Hofsteniidae. Hofstenia atroviridis, Н. giselae и в меньшей степени Hofsteniola pardii в отличие от других членов этого семейства обладают обширной кишечной полостью, однако ни клеточных границ, ни резкого отграничения кишки от периферической паренхимы Hofsteniidae еще не имеют (Воск, 1923; Papi, 1957; Steinbock, 1966).
Наиболее резко выраженная эпителизация кишечника свойственна лишь немногим отрядам из Archoophora, а именно Polycladida, Macrostomida и частью Catenulida. У этих форм кишечный эпителий несет покров ресничек (рис. 46), а полостное пищеварение явно превалирует над внутриклеточным. Так, у Stenostomum и Macrostomum пища обволакивается секретом глоточных желез
и сначала переваривается в полости кишки. Здесь железистые зернистые клетки продуцируют эндопептидазу, вызывающую в кислой среде расщепление белков и распадение пищевых кусков
ей
ст
/\
Рис.
45. Actinoposthia
beklemischevi
(Acoela).
Поперечный разрез. (По:
Мамкаев,
1965).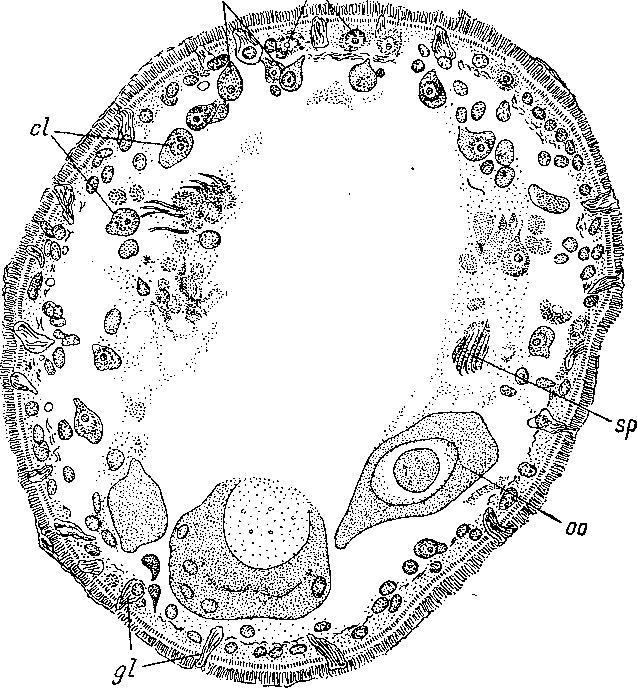
ed — клетки, дифференцирующиеся в эпидермальный синцитий, cl — свободные клетки паренхимы, cm — мигрирующие клетки, gl — железистые клетки, оо — ооциты, sp — спермии. В центре обширная пищеварительная вакуоль.
на частицы, подходящие для захвата эпителиальными клетками кишки (Westblad, 1922; Jennings, 1968). У Leptoplana tremellaris (Polycladida Acotylea) наблюдалась такая же смена полостного пищеварения внутриклеточным, тогда как Cyclophorus papillosus (Polycladida Cotylea) свойственно только полостное пищеварение (Jennings, 1968). Большой интерес для выяснения вопросов эволюции кишечника представляют Catenulida. Большинство катеиу- лид обладает хорошо эпителизированным ресничным кишечником. Однако в пределах рода Rhynchoscolex мы встречаемся с очень примитивными формами пищеварительного аппарата. Вспомним, что именно у некоторых представителей этого рода проявляется и архаическая структура покровов и кожно-мускульного мешка. Rhynchoscolex simplex имеет кишечный синцитий ацелоидного типа (Reisinger, 1924), так же как и виды смежного рода Chordarium (Ch. evelinae и Ch. leucantum no: Marcus, 1945a). У Rhynchoscolex re- manei кишке свойственно эпителиальное строение, но реснички
in
Рис.
46. Macrostomum
thermale
(Macrostomida).
Сагиттальный разрез. (По: Reisinger,
1933).
bs
—
семенная сумка, с — мозг, in
—
ресничный эпителий кишки, р
— стилет пениса, pf
—
женское половое отверстие, ph
—
глотка, рт
— мужское половое отверстие, рг
— наконечник семенной сумки с клетками,
о — ротовое отверстие, оо — ооцит.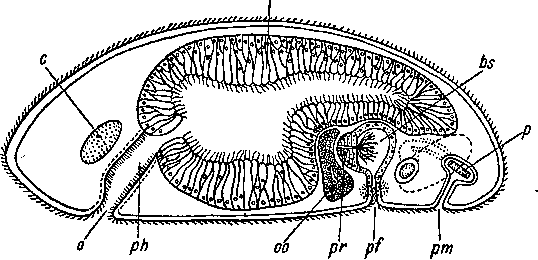
отсутствуют (Rixen, 1961), тогда как Rh. evelinae обладает мерцательной эпителиальной кишкой.
У некоторых турбеллярий из разных отрядов описаны вторичные анальные отверстия, которые по своей природе не имеют ничего общего с порошицей кольчатых червей.
Так, у Polycladida Cotylea (например, у Cycloporus, Yungia, Thysanozoon) многочисленные разветвления кишечника заканчиваются «анальными камерами», которые открываются наружу мелкими порами (рис. 47), расположенными вдоль краев тела. Функция этих образований неизвестна, но, так как в камерах никогда не находили частиц пищи, можно догадываться, что через них выводится избыток воды, заглатываемой вместе с добычей (Jennings, 1968). У Leptoteredra maculata, которая тоже принадлежит к этому же подотряду поликладид, центральный отдел кишечника открывается на спинной стороне коротким каналом, похожим на заднюю кишку (рис. 48; Gemmill u. Leiper, 1907). Такое же положение занимает вторичный анус у четырех видов Archimonocelis (Proseriata) (Karling, 1966b). Наконец, Haplopharynx rostratus (Ma- crostomida) обладает анальной порой на заднем конце тела. Интересно, что у этого же вида на переднем конце тела развит длинный хобот, очень похожий на таковой у немертин. Ввиду наличия этих двух особенностей Haplopharynx, по мнению Карлинга, больше, чем какая-либо другая турбеллярия, напоминает Nemer- tini (Karling, 1965).
У турбеллярий, как и у других плоских червей, степень разветвленное™ кишечника в сильной мере зависит от размеров тела.
Рис.
47. Cycloporus
papillosus
(Polycladida).
Фронтальный разрез края тела. (По:
Lang,
1884).
ас
— «анальные камеры», in
—■
ветвь кишечника, подразделяющаяся
на четкообразно расположенные участки,
разделенные мускульными сфинктерами,
р
— поры.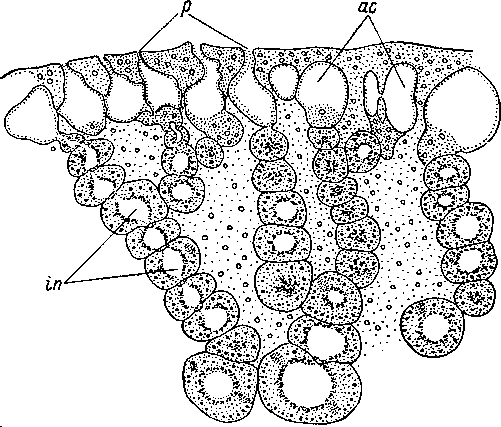
Эта связь объясняется тем, что функции распределения питательных материалов берет на себя кишечник с его ветвями (Беклемишев, 1964).
Кишечник у поликладид состоит из центрального отдела, иногда называемого желудком, и многочисленных, отходящих от него во все стороны ветвей. Непарная передняя ветвь проходит над мозгом (рис. 48). Ланг считал ее гомологом акрогастера ктено- фор. Разветвления кишечника поликладид нередко анастомози- руют друг с другом (рис. 22). У Seriata кишка большей частью имеет три главные ветви -=- одну переднюю и две задние, которые в свою очередь более или менее ветвятся. У очень мелких поликладид и трикладид кишечник значительно упрощается, прини мая подчас почти «рабдоцельный» характер. G другой стороны,у крупных представителей Macrostomida кишка ветвится как у трикладид.
Наконец, заметим, что у ряда Seriata, обитающих в песке, имеется хордоидный опорный орган энтодермального происхождения (Ах, 1957, 1960, 1966а), напоминающий нотохорд Enteropneusta и опорный энтодермальный клеточный стержень в щупальцах Hydrozoa. Это плотный непарный вырост кишки, состоящий из крупных, вакуолизированных клеток, простирающийся над мозгом вперед до переднего конца тела. Он был обнаружен у видов Otoplana, Nematoplana, Coelogynopora и Polystyliphora. В самое же последнее время у Nematoplana nigrocapitula, кроме
ain
ph vo in
Рис.
48.
Leptoteredra
maculata
(Polycladida).
Сагиттальный
разрез. (Из: Bres-
slau,
1928—1933).
ain
— передняя
ветвь кишки, an
— анальная
пора, bp
—
мешок пениса, с — мозг, со — присоска,
df
—
женский половой канал, in
—
кишка, ph
—
глотка, pf
—
женское половое отверстие, pin
—
задняя ветвь кишки, рт
— мужское половое отверстие, о — ротовое
отверстие, vg
—
пузырек вернистого секрета, vs
—
семенной пузырек.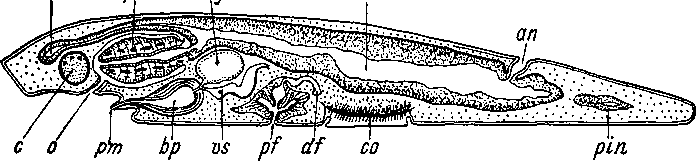
нотохордоподобного органа, была описана и кишечная хорда — chorda intestinalis, продольная опорная полоска хордоидных клеток, тянущаяся в спинной части кишки до самого заднего конца тела (Ах и. Ах, 1969).
Морфологическое значение структуры кишечника
Среди авторов, выступавших против развиваемых здесь представлений, прежде всего следует назвать П. Акса и Н. А. Ливанова.
Акс (Ах, 1961, 1963а) принимает однослойный клеточный кишечный эпителий, покрытый ресничками, за исходное состояние, а особенности пищеварительного аппарата Acoela рассматривает как вторичные его изменения. Приведенные выше уклонения аце- лоидного пищеварительного аппарата в сторону эпителизованного кишечника Акс считает отдельными примерами регрессивной эволюции кишки. Так как подобные случаи упрощенного строения кишки рассеяны спорадически у высших форм, то их, по мнению Акса, нельзя считать проявлением примитивности.
Этот довод нам уже знаком, он основан на ложном представлении о том, что всегда любой примитивный признак может прояв-
пяться только у форм, примитивных во всех отношениях. Между тем о том, что эволюция кишечника действительно шла от аморфной пищеварительной паренхимы Acoela к эпителизованному кишечнику, а не наоборот, ярко свидетельствуют некоторые особенности развития паренхимной мускулатуры. Так, у Phaenocora polycirra (NeorhabcLocoela) дорсо-вентральные мышечные пучки, как уже отмечалось, пронизывают амебоидный эпителий кишки (рис. 43, А) совершенно так же, как они пересекают аморфный центральный фагоцитобласт у Acoela (например, у Convoluta convolnta; рис. 42). У Pteraslericola fedotovi (Neorhabdocoela), паразита морских звезд, регулярно происходит физиологическая регенерация кишечного эпителия за счет клеток паренхимы (рис. 43, Б; Беклемишев, 1916). Аналогичные превращения клеток- паренхимы в кишечные клетки описал Бёмиг (Bohmig, 1886), причем кишечник Graffila muricicola он считал связующим звеном между состоянием у Acoela и Coelata. Алле (Hallez, 1910) наблюдал замещение эпителиальных клеток кишки блуждающими клетками паренхимы у другой прямокишечной турбеллярии — Paravortex cardii. Возникновение этих особенностей понятно только при допущении эпителизации центрального фагоцитобласта и совершенно необъяснимо с точки зрения концепции вторичного упрощения кишки.
Главный же свой аргумент Акс выразил следующими словами: «В генеалогической схеме Бресслау (Bresslau, 1928—1933) Мас- rostomida, Polycladida и Catenulida выводятся раздельно от первичных ацелоидных турбеллярий. Однако было бы в высшей степени невероятно и методически необоснованно считать, что столь идентичные структуры, как кишка, в этих отрядах возникли независимо» (Ах, 1961,, стр. 12). Это рассуждение неизбежно вытекает из постулатов теории Гастреи.
\
Вслед за Аксом и мы считаем кишку Macrostomida, Polycladida и Catenulida гомологичной, имеющей общее происхождение, но за анцестральное состояние принимаем пищеварительную паренхиму, или фагоцитобласт (Иванов, 1952а, 1968, 1971а; Мамкаев, 1967). Мы не усматриваем ничего невероятного или «методически необоснованного» в независимой эпителизации первоначально аморфной паренхимы в разных филогенетических ветвях. Этот переход в сущности не так уж сложен и, как мы видели, фактически совершается многократно в течение жизни одной и той же особи у громадного большинства турбеллярий. Напротив, нам представляется нелогичным отрицание возможности такого сравнительно простого конвергентного процесса особенно потому, что автор в тех же статьях (Ах, 1961, 1963а) охотно допускает независимое возникновение таких сложных органов, как pharynx plicatus и ph. bulbosus doliiformis.
Аналогичные рассуждения о невозможности независимого возникновения эпителиальной кишки в разных группах (книдарий и турбеллярий) заставляют иН. А. Ливанова (1955) отрицать примитивность организации Acoela. Ливанов решительно высказы
вается против учения В. Н. Беклемишева о первичности смешанной паренхимы, утверждая следующее: «С этой точки зрения совершенно необъяснимы нахождение в паренхиме Acoela рассеянных железистых, мышечных, нервных и т. д. элементов, их первичная дифференцировка и дальнейшее объединение в органы — ткани. Создается впечатление об их спонтанном возникновении -в однородной паренхиме, что совершенно несовместимо с основными установками научной материалистической мысли. Напротив, все факты получают вполне четкое объяснение, если в его основу будет положен факт развития амебоидности у клеток кишечника, связанной с особенностями питания исходных форм Acoela» (1955, стр. 116).
Заметим прежде всего, что идея о «спонтанном возникновении» клеток целиком остается на совести Н. А. Ливанова. У В. Н. Беклемишева и его последователей на этот счет нигде ничего не говорится.
Далее ясно, что перечисленные Ливановым вопросы о причинах разнородности смешанной паренхимы, о происхождении первоначальной дифференциации клеток Metazoa и о причинах образования тканей и органов представляют собой общебиологические проблемы, которые «развитием амебоидности у клеток кишечника» объяснить невозможно.
Недавно Н. А. Ливанов (1970) вновь обсудил вопрос о происхождении отряда Acoela и о природе их смешанной паренхимы. Причиной деградации, или вторичной «специализации», этих тур- беллярий Ливанов по-прежнему считает приспособление к «специальному способу питания», именно к фагоцитированию пищевых частиц отдельными клетками кишечника, которые стали амебоидными и подвижными. Далее, говорит Ливанов, развился пищеварительный синцитий. «Амебоидизм клеток кишечника нарушил целостность всех клеточных образований1стенки тела, превращая их в разнородную паренхиму В. Н. Беклемишева» (Ливанов, 1970, стр. 285).
Однако утверждение, что внутриклеточное пищеварение и «амебоидизм» кишечных клеток Acoela выработались вторично, более чем сомнительно. Как хорошо известно еще со времен И. И. Мечникова (1883, 1886), внутриклеточное пищеварение, широко распространенное особенно у низших Metazoa, представляет собой самый примитивный, протозойный по своей природе способ питания. Вряд ли в этом отношении Acoela служат исключением из общего правила. У Porifera — второй группы низших Metazoa с разнородной паренхимой — имеет место исключительно внутриклеточное пищеварение. Несмотря на широчайшее распространение в животном мире, фагоцитоз никогда нигде не приводит к сколько-нибудь заметной перестройке организации или к деградации.Таким образом, утверждение, что внутриклеточное пищеварение Acoela представляет собой некий особый, только им свойственный способ питания, да еще вызвавший коренную перестройку их организации (замену тканевого и органного типа организации нетканевым состоянием смешанной паренхимы), не подтверждается фактическими данными.
Вопреки мнению Н. А. Ливанова не представляет ничего исключительного или особенного и способ питания, или поглощение пищи, у Acoela. Они питаются в сущности так же, как и другие турбеллярии, — активно разыскивая пищу и заглатывая более или менее крупную животную добычу (среди которой могут быть различные небольшие беспозвоночные, чаще всего другие турбеллярии и ракообразные) или диатомовые водоросли. Сравнительно крупный (до 12 мм) Anaperus sulcatus пожирает даже моллюсков.
Далее очень важно, что по гистологическому строению пищеварительного аппарата между Acoela и большинством других отрядов нет резкой границы, как это было ясно показано выше (стр. 71— 76). С одной стороны, среди Acoela имеются формы с временно эпителизирующейся (в зависимости от фазы пищеварения) кишкой или с временной кишечной полостью (Nemertoderma, Меага). С другой стороны, у большинства остальных турбеллярий, в том числе у многих Prolecithopkora, Proseriata и Tricladida, а также у Neorhabdocoela, эпителий кишки периодически подвергается распадению на слой амебообразных клеток или синцитированию. Эти факты также ясно показывают, что ни в питании, ни в пищеварительном аппарате Acoela нет ничего такого, что отличало бы их принципиально от большинства ресничных червей.
Наконец, пресловутый «амебоидизм», захватывающий якобы многие другие системы органов у Acoela, и «специфическая установка на фагоцитоз», о которой говорит Н. А. Ливанов (1970, стр. 528), в действительности не существуют. Кроме пищеварительных фагоцитов, которые, как мы отмечали выше, свойственны далеко не всем Acoela, амебоидными элементами представлены только некоторые клетки периферической паренхимы и молодые ооциты. Эпидермальные, железистые, чувствительные, нервные, мышечные клетки, клетки статоциста и органов копулятивного аппарата — это нормальные клеточные элементы, дифференцированные, но отнюдь не амебообразные и не блуждающие клеточные элементы, ничем особенным не отличающиеся от подобных им клеток других турбеллярий и большинства остальных Metazoa. Эпидермис (см. стр. 22—23) иногда, по-видимому, может становиться синцитиальным, часто бывает погруженным, может иметь и растрепанные базальные концы клеток (как у молодых Oligochoerus erythro- phthalmus), но все это, разумеется, ничего общего не имеет с «амебоидизмом».
Амебообразные ооциты свойственны не только Acoela, но встречаются у всех наиболее примитивных Metazoa, а именно у Pori- fera и Hydrozoa, следовательно, их «амебоидизм» первичен.
g Д. р. Иванов и Ю. Б. Мамкаев
То же самое справедливо и для немногих амебоидных клеточных форм периферической паренхимы, несущих защитную, санитарную или экскреторную функцию. Гомологичные им блуждающие фагоцитарные клетки соединительной ткани и крови широко распространены у Metazoa, в том числе свойственны и позвоночным.
Таким образом, утверждение Н. А. Ливанова о том, что Acoela — животные резко дезинтегрированные, проделавшие глубокую регрессивную эволюцию только потому, что у них развился «более простой способ питания путем захвата находящихся на субстрате мелких пищевых частиц», не может быть принято.
Учение о смешанной паренхиме Ливанов называет «формальной, чисто конструктивной схемой», не имеющей экологического обоснования. При этом он забывает о той широкой физиологической, цитологической и экологической аргументации, которая лежит в основе теории Фагоцителлы И. И. Мечникова и его учения о фагоцитобласте, т. е. в основе концепций, служащих базой учения о смешанной паренхиме.
Органы выделения
{Важнейшими источниками, на которых основаны современные представления о строении и эволюции выделительных органов плоских червей, являются исследования Вестблада по физиологии турбеллярий (Westblad, 1922), сравнительно морфологические работы Рейзингера (Reisinger, 1928—1933, 1968), Кюммеля (Kiimmel, 1958, 1962) и В. Н. Беклемишева (1944, 1964).
Атроциты
Прежде всего следует отметить, что первичные формы экскреции у турбеллярий, как и вообще у Scolecida, выражаются в деятельности отдельных экскреторных клеток фагоцитобласта — не- фроцитов, рассеянных в паренхиме. Это так называемые атроциты, или клетки-экскретофоры.
Все Acoela находятся на этой первой ступени развития функции экскреции. Как показал Вестблад, блуждающие - нефроциты бес- кишечных турбеллярий постепенно накапливают в цитоплазме экскреты в виде нерастворимых гранул пигмента и мочевой кислоты и, следовательно, играют роль крошечных рассеянных почек накопления. Вместе с экскретами они могут выводиться из тела через центральную пищеварительную паренхиму и ротовое отверстие заодно с фекальными остатками, но частью остаются в организме на всю жизнь, участвуя в формировании окраски и рисунка животного.
По существу так же происходит выделение у большинства других турбеллярий. У трикладид, например, несмотря на их сравнительно высокую организацию, экскрецию выполняют отдельные клетки кишечника, а протонефридии лишены выделительной функции; у рабдоцелид основная роль тоже принадлежит нефроцитам, которые или выносят экскреты наружу через кишку или превращаются в постоянные почки накопления (Westblad, 1922; Беклемишев, 1964).
Протонефридии
Протонефридии развились у турбеллярий первоначально как органы осморегуляции, но затем в процессе эволюции к ним присоединились нефроциты, и тогда протонефридии тоже приобщились к выделительной функции (Westblad, 1922). Однако у Xenoturbel- lida и у низших турбеллярий — Acoela и Gnathostomulida — про- тонефридиев еще нет. У Polycladida они, по-видимому, слабо развиты и, возможно, имеются не у всех форм. У представителей всех остальных отрядов турбеллярий протонефридии большей частью хорошо развиты.
|Протонефридии — это водоносная «дренажная система» из одного или нескольких разветвленных каналов, пронизывающих паренхиму и кажущихся при изучении под световым микроскопом замкнутыми на внутренних концах. Стенки протонефридиев могут состоять из многих клеток, расположенных эпителиеобразно (как это особенно характерно для немертин), или же отдельные клетки образуют значительный участок канала, который в этом случае представляется внутриклеточным.
Первоначальная и основная функция протонефридиев заключается в регуляции осмотического давления внутри организма, т. е. эти органы выполняют ту же работу, что и их аналоги у простейших — сократительные вакуоли. Через каналы протонефридиев избыточная вода непрерывно выводится из организма. В связи с этим протонефридии обладают специальными гидрокинетическими приспособлениями, эволюция которых была освещена Рей- зингером, Кюммелем и Бранденбургом (Reisinger, 1928—1933; Ktimmel, 1958, 1962; Kiimmel u. Brandenburg, 1961; Brandenburg, 1966).
В простейшем случае стенки крупных каналов одеты сплошным покровом ресничек, как это наблюдается у отдельных Polycladida и у Rhynchoscolex (Catenulida), отчасти у Xenoprorhynchus (Lecitho- epitheliata), особенно у Protomonotresis centrophora, у Plagiostomum lemani (Prolecithophora) и у Tricladida Maricola (Forel et Du Ples- sis, 1874; Lang, 1884; Reisinger, 1923, 1928—1933, 1968; Meixner, 1938). У Baikalarctia (Prolecithophora) произошла уже значительная редукция ресничного покрова, реснички развиты в каналах не сплошь, а расположены тремя продольными рядами (Фридман, 1933). Далее, по мысли Рейзингера, происходила еще большая редукция ресничек на небольшом протяжении каналов, которая сопровождалась одновременным усилением и дифференциацией оставшихся отдельных групп длинных ресничек, спаянных вместе в виде мощного пучка или мембранеллы, обычно называемой мерцательным пламенем. Различаются два типа мерцательного пламени —
Treibenwimperflammen, которые по-русски можно именовать «проталкивающими», или «прогоняющими», вододвижущими аппаратами, и терминальные аппараты (рис. 49). Первые, по мнению Рейзингера, возникли раньше вторых и развиваются непосредственно на стенке протонефридиального канала то тут, то там; их ресничный пучок торчит в просвет протонефридия и своим биением гонит воду вдоль сосуда наружу. Возле него может лежать ядро, как например у Protoplanella simplex (Prolecithophora). Смещение такого пучка на конец ветви приводит к образованию типичной терминальной клетки. Нередко, однако, проталкивающие пучки ресниц не имеют собственного ядра, и тогда развивающиеся из них терминальные аппараты, естественно, безъядерны. В этом случае они представляют собой колпачковидные или колбовидные цитоплазматические образования, со дна которых в просвет канала вдается мерцательное пламя (у многих турбеллярий, так же как у Schistosomum среди трематод, у Giganto- rhynchus из скребней, у га- стротрих и киноринхов).

Таким образом, по первоначальной концепции Рейзингера, вододвижущие приспособления протонефридиев — это дифференцированные остатки общего ресничного, покрова протонефридиального канала. Новые электронномикроскопические исследования не подтвердили эти предположения. Кюммель и Бранденбург (Ktimmel, 1958, 1962; Brandenburg, 1966) изучили ультраструктуру терминальных клеток некоторых сколецид, в том числе турбелля- рии Stenostomum (Catenulida) и соленоциты протонефридиев по- лихет и ланцетника. Они пришли к выводу, что все эти клетки представляют собой только варианты определенного морфологического типа жгутиковой клетки, первичные модели которой воплощаются в хоаноцитах губок или в клетках воротничковых жгутиконосцев (Protomonadida, Craspedomonadina). Кюммель назвал эти клетки циртоцитами, или вершеобразными жгутиковыми клетками (Reusengeisselzellen), однако по-русски их лучше именовать корзинчатыми, или фильтрующими, жгутиковыми клетками. Их общая характерная особенность заключается в развитии вокруг жгута (или пучка ресниц) нежной воронковидной трубочки с ча-а— Naegleria (Protozoa, АтоеЪЫа), Ъ— Craspedomonadina (Protozoa, Mastigopkora), с — хоаноциты Porifera, d — исходная схема циртоцита, е — циртоцит Macrostomum (Macrostomida), f — то же у Xenoprorhynchus (Lecithoepitkeliata), g — то же у мирацидия Fasciola (Trematoda), h — то же у Urnatella (Катр- tozoa), г — то же у Stenostomum (Catenulida), j — соленоциты Phyllodoce (Polychaeta), ft — соленоцит Glycera (Polychaeta), I — соленоциты Branchiostoma (Chordata, Acrania), прилегающие к кровеносному сосуду, m — боуменова капсула ската, ?1 — (го же у других позвоночных.
Рис. 49. Гидрокинетические приспособления протонефридиев различных турбеллярий. С живых животных. (По: Reisinger, 1928—1933).
А — равномерно одетый ресничками выделительный канал Protomonotresis centrophora (Prolecithophora), В — проталкивающее мерцательное пламя у Typhlopianella haleziona (Neorhabdocoela), В — то же у Protoplanella simplex (Prolecithophora) , Г — терминальный мерцательный аппарат Phaenocora unipunctata (Neorhabdocoela), Д — то же у Mesostoma productum (Neorhabdocoela).
Рис. 50. «Генеалогическое древо» циртоцитов по Кюммелю с дополнениями Рейзингера (Kiimmel, 1962;
Reisinger, 1968).
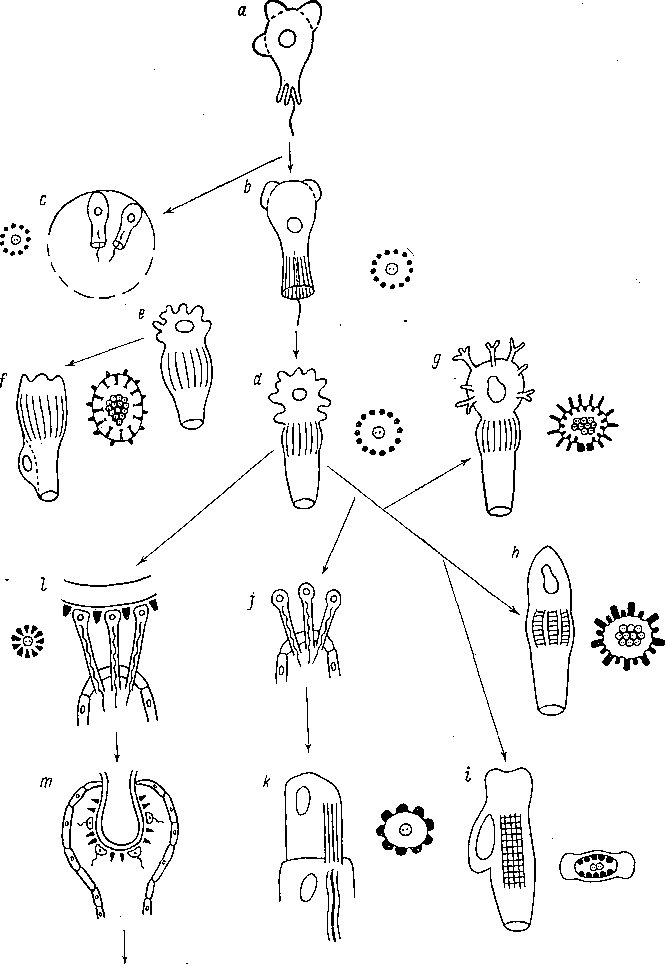
стично решетчатыми стенками, через которые фильтруется жидкость, всасываемая внутрь трубочки при работе жгута (рис. 50, d).
Несмотря на различия в деталях, план строения циртоцитов оказался единым у всех изученных объектов. Функция их всегда сходна. Сравнение же нефридиев ланцетника с боуменовыми капсулами позвоночных позволило установить гомологию между их компонентами и объяснить эволюционный переход между ними (рис. 50, I—п). Поэтому циртоциты во всех группах животных были признаны гомологичными образованиями, и Кюммель предложил единое «генеалогическое древо» циртоцитов для всего животного мира (Kiimmel, 1962). Его схема затем была дополнена Р’ейзингером (рис. 50), изучившим ультраструктуру терминальных органов у Macrostomum, Xenoprorhynchus и Bothrioplana (Reisinger, 1968, 1970).
Совершенно ясно, что «генеалогическое древо» циртоцитов Кюммеля, как, впрочем, и сам он об этом пишет (Kiimmel, 1962), не выражает собой истинных филогенетических взаимоотношений между группами животных. Однако оно хорошо иллюстрирует на отдельных примерах-моделях, откуда и каким образом могли возникнуть в филогенезе конкретные специализированные формы циртоцитов. Во всяком случае в пределах групп, обладающих протонефридиями, сравнение ультраструктуры их терминальных корзинчатых клеток позволяет сделать определенные филогенетические выводы. Трудно поэтому согласиться с Ремане, еще недавно допускавшим (Remane, 1967) независимое возникновение протонефридиев в разных группах животных.
Итак, терминальные клетки ныне изучены с помощью электронного микроскопа в четырех отрядах турбеллярий — Масго- stomida, Catenulida, Lecithoepitheliata и Seriata. У Macrostomum tuba (рис. 51) и Bothrioplana semperi мерцательное пламя представлено 20—30 рыхло соединенными друг с другом жгутами, а решетка жгутиковой трубочки образована двумя венчиками продольных палочек — внутренним и наружным, причем палочки обоих венчиков связаны одной фильтрационной мембраной (Reisinger, 1968, 1970). Интересно, что такое же строение имеют и циртоциты протонефридиев мирацидия печеночной двуустки — Fasciola hepatica (Kiimmel, 1958) и редии трематоды Petasiger пео- commense (судя по электронномикроскопической фотографии, опубликованной Т. А. Гинецинской (1968)), тогда как у Xenoprorhynchus steinbocki внешний венчик палочек отсутствует (рис. 52; Reisinger, 1968). Таким образом, у Macrostomum, мира- цидиев и редий трематод и Xenoprorhynchus из-за развития фильтрационной мембраны полость жгутиковой трубочки не сообщается непосредственно с окружающим терминальный орган пери- висцеральным пространством, что, вероятно, следует рассматривать как вторичную особенность всех этих циртоцитов.
У Stenostomum (Catenulida) корзинчатые клетки имеют ряд интересных особенностей (рис. 53). Ядро лежит не терминально,
как обычно, а сбоку, в утолщении жгутиковой трубочки. Мерцательное пламя состоит лишь из двух жгутов. Наконец, фильтрационное приспособление представлено двумя прямоугольными окошечками, снабженными поперечными (по 20—25 в каждом) и продольными (по 8—10) перекладинами, которые, перекрещиваясь, создают настоящее сито (Kiimmel, 1962). Примитивными особенностями этой терминальной клетки, по-видимому, следует считать, во-первых, наличие всего двух жгутов, во-вторых, отсут-
е i
Рис.
51. Macrostomum
tuba
(Macrostomida).
Поперечный разрез циртоцита в области
жгутиковой трубочки.
С
электронномикроскопической фотографии.
(По: Reisinger,
1968).
е
— наружные опорные палочки, f
—
пучок жгутов, г
— внутренние палочки.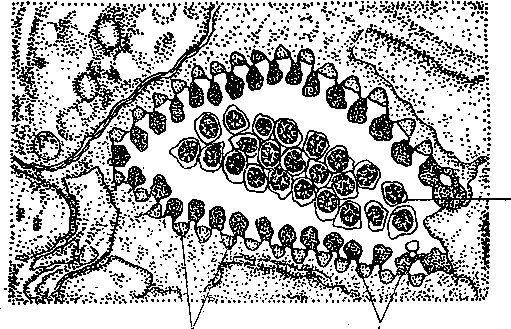
ствие фильтрационной перепонки, т. е. прямое соединение полости жгутиковой трубочки с лакунарным пространством паренхимы. К явно вторичным чертам относится своеобразное устройство решетчатой (корзинчатой) части трубочки.
Итак,
особенности терминального органа
Catenulida
вполне
согласуются с нашими
представлениями как о большой
примитивности этого отряда, так и об
очень ранней его специализации. Очевидно,
терминальные клетки типа Macrostomum,
гораздо
ближе стоящие к исходной гипотетической
стадии эволюции циртоцита (см.
«генеалогическое древо» циртоцитов
Кюммеля), широко распространены среди
других турбеллярий. Кроме Macrostomida
и
Lecithoepitheliata,
они
должны быть характерны для Neorkabdocoela.
Об
этом можно судить по наличию именно
этого типа циртоцитов у трематод,
происхождение которых от Dalyel-
lioidea
не
вызывает сомнений.
трубочки. С электронномикроскопической фотографии. (По: Reisin- ger, 1968).
Схема Кюммеля позволяет сделать еще один важный вывод. Соленоциты протонефридиев полихет представляют собой результат вторичного видоизменения очень примитивной стадии развития диртоцита плоских червей (рис. 50, /, к), а не наоборот, как требуют того положения гипо-
Рис. 52. Xenoprorhynchus steinbocki Рис. 53. Stenostomum sp. (Catenulida).
(Lecithoepitheliata). Поперечный раз- Циртоцит. Реконструкция по элек-
рез циртоцита в области жгутиковой тронномикроскопическим срезам.
(По: Kiimmel, 1962).
f — жгуты, I — продольные перекладины, п — ядро, tr —■ поперечные перекладины.
t — пучок жгутов, г — внутренние палочки.
покровов, о чем прежде всего свидетельствуют упомянутые выше случаи примитивного развития сплошного ресничного покрова в их главных стволах. Прямые эмбриологические наблюдения, несмотря на их скудность, также подтверждают эктодермальную природу протонефридиев (Lang, 1884; Bresslau, 1904). Поэтому, вероятно, В. Н. Беклемишев (1964) прав, утверждая, что первичным типом протонефридиев было множество неправильно рассеянных^ эктодермальных водоносных трубочек, открывавшихся самостоятельными порами. Однако среди плоских червей протонефриди
и
такого типа нам неизвестны.* Впрочем, для некоторых Tricladida характерна множественность протонефридиальных стволов. Так, у пресноводных планарий имеются 2—4 пары сетеобразно анасто- мозирующих друг с другом главных каналов и много протонефридиальных пор (рис. 54), причем число их возрастает по мере индивидуального роста животного и иногда достигает нескольких сотен. Нередко поры расположены попарно и метамерно на спинной и брюшной стороне.
Среди
Tricladida
Paludicola
молочно-белая
планария Dendrocoelum
lacteum
имеет
8—9,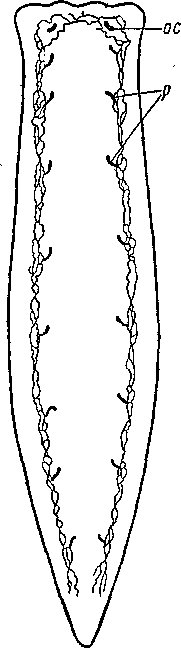
Polycelis nigra — 15—16, a Euplanaria poly- chroa — 127—145 парных отверстий (Wilh,el- mi, 1909).
Далее, по мнению Беклемишева, в процессе эволюции происходила олигомеризация главных протонефридиальных стволов, поперечных комиссур между ними и наружных пор. У Prolecithophora встречаются формы уже не с 4, а с 2 парами главных каналов и с 3—4 парами отверстий (например, Baikalarctia, по: Фридман, 1933).
У Neorhabdocoela и Macrostomida сохраняется всего два ствола, а у Catenulida даже один.
Соглашаясь с соображениями В. Н. Беклемишева о первоначальной множественности протонефридиальных каналов, мы тем не менее думаем, что в отношении Tricladida более правильна точка зрения, высказанная Бресслау (Bresslau, 1928—1933) и поддержанная Мейкснером и Аксом (Meixner,
1938; Ах, 1961). Эти авторы полагают,- что в данном случае имеет место вторичное умно-
Рис. 54. Dendrocoelum lacteum (Tricladida). Схема выделительной системы. (По: Wilhelmi, 1906). ос — глаз, р — выделительные поры.
жение органов и отверстий, связанное с потребностью усиления функции осморегуляции в пресной воде (Meixner, 1938) или с увеличением размеров тела (Ах, 1961). В последнем случае предполагается, что полимеризация протонефридиев имеет такую же природу, как характерные для планарий разветвления кишечника и расчленение семенников и желточников. Важно отметить, что увеличение количества продольных стволов и пор среди Prolecithophora и Proseriata наблюдается как раз у тех видов, которые перешли к жизни в солоноватой или пресной воде, например у Baikalarctia gulo, Plagiostomum lemani и Otomesostoma auditivu
m
(Фридман, 1933; Meixner, 1938). Существенно также, что среди Proseriata и морских трикладид преобладающее большинство имеет только одну пару главных протонефридиальных стволов (Meixner, 1938).
Рис.
55. Протонефридиальная система
Neorhabdocoela.
(Из:
Bres-
slau, 1928-1933).
А
— Gyratrix
germaphroditus (Kalyptorhynchia), В
—
Mesostoma
ehrenbergi (Typhloplanoida).
am
—
ампула,
с —
мозг,
ex
—■
ствол
цротонефридия, in
—
кишка, ос — глаз, р
—
выделительная пора, ph
—
глотка, рп
—
паранефроциты, рг
— отверстие хоботка, г — хоботок, st
—
стилет пениса.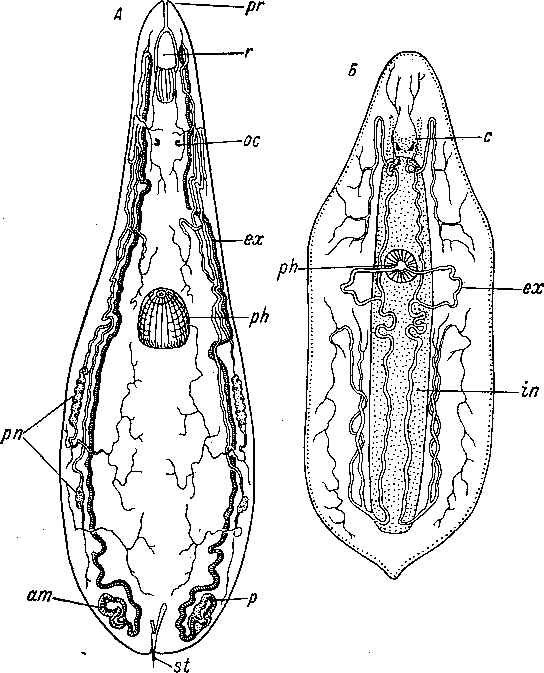
зующийся впячиванием эпидермиса (пресноводные Kalyptorhyn- chia — Koinocystis neocomensis, Opisthocystis goettei; см., например* Bresslau, 1906). Иногда непарный мочевой пузырек открывается в области полового отверстия (Rhyncho- mesostoma из Neorhabdocoela).
Наконец,
следует отметить, что у многих
турбеллярий, например у Catenulida
и
некоторых Neorhabdocoela
(Stenostomum,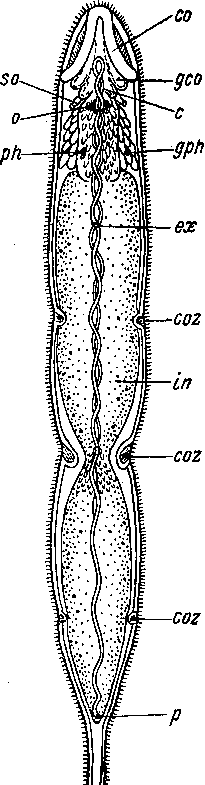
Gyratrix, Acrorhynchus), эпителиальные стенки самих протонефридиев на большем или меньшем протяжении приобретают собственные экскреторные функции.
Паранефроциты
Уже упоминалось, что высшие формы выделительного аппарата у Turbellaria представляют собой сочетание осморегу- ляторных сосудов протонефридиальной системы с атроцитами. Такие атроциты, связанные с протонефридиями, известны у представителей Lecithoepitheliata, Neorhabdocoela, Temnocephalida, Udonellida и Tricladida. Полнее всего и к тому же экспериментальным путем на живых червях они были изучены у Neorhabdocoela Рейзингером (Reisinger, 1922—1923), от которого получили наименование пара- нефроцитов. У Kalyptorhynchia (Gyratrix germaphroditus — рис. 55, A; Opisthocystis goettei) — это точно локализованные ги- ею. Продолжение его по выходе из паранефроцита дает разветвления—капилляры, заканчивающиеся терминальными клетками (Reisinger, 1922—1923). Как показал Рейзингер методом прижизненной окраски, паранефроциты Neorhabdocoela — настоящие атроциты, т. е. экскреторные клетки, извлекающие из окружающей паренхимы экскреты и выделяющие их затем в протонефридиальный
канал.
Недавно Рейзингер (Reisinger,
1968)
"изучил (паранефроциты
Xenoprorhynchus
с
помощью электронного микроскопа. У
этой турбелля- рии на?латеральных стенках
протонефридиев имеется 8—
10
пар паранефроцитов (рис. 57). В каждом
находится система внутриклеточных
лакун, стоящих в широком сообщении с
полостью про- тонефридиального канала.
Плазматические промежутки между лакунами
содержат многочисленные митохондрии
с ясными кристами (рис. 58). На основании
экспериментов с прижизненным окрашиванием
нейтральротом и ализарином Рейзингер
считает
Рис. 57. Xenoprorhynchus stein- bocki (Lecithoepitheliata). Выделительный аппарат. (По: Reisinger, 1968).
се — мозг, со — ресничная ямка, gl — клубочек протонефридиального канала, о — ротовое отверстие, р — пора протонефридия, par — паранефроциты, ph — глотка, рг — каналы протонефридия, st — стилет, vo — ядовитый орган.
паранефроциты Xenoprorhynchus чрезвычайно активно действующими экскреторными органами. Прямое соответствие их паране- фроцитам Neorhabdocoela по функции и по общему топографическому сходству почти не вызывает сомнений. Неясно, однако, ограничивается ли роль паранефроцитов у Xenoprorhynchus только экскрецией, или они имеют еще значение и как фильтрационные приспособления. Рейзингер думает, что последнее не исключено, так как обнаруживается некоторое сходство в развитии лакунарной системы паранефроцита и сети протоков в подоцитах целомического пузырька выделительных органов у Crustacea Decapoda, где эта функция доказана (см.: Kiimmel, 1964).
Крупные паранефроциты, тесно соединенные с выделительной системой, известны у Temnocephalida (Haswell, 1893; Merton, 1914; Baer, 1929, 1931). Правда, относительно них существуют большие разногласия. Мертон склонен предположить, что эти клетки обладают многими мерцательными пучками, расположенными вокруг ядра, и сравнивает паранефроцит Temnocephala с терминальной клеткой Amphilina, снабженной, как известно, несколькими ресничными пучками. Бэр считает даже, что пара-
Рис.
58. Xenoprorhynchus
steinbocki
(Lecithoepitheliata).
Разрез через паранефроцит. С
электронномикроскопической фотографии.
(По: Reisinger,
1968).
f—
пучок жгутов, I
— внутриклеточные лакуны, mt
—митохондрии,
рс
— протонефри-
диальный
канал.
нефроциты не клетки, а лишь местные вздутия экскреторного канала с дополнительными радиальными канальцами в стенке и отрицает наличие в них ядра. Точка зрения Мертона кажется более убедительной; на его рисунках (Merton, 1914, табл. III, рис. 34) в паранефроцитах видно отчетливое ядро. Каждый паранефроцит одет тонкой оболочкой и связан с экскреторным каналом, который, возможно, пронизывает его насквозь (Merton, 1914; Bresslau u. Reisinger, 1928—1933).
Наконец, очень своеобразные паранефроциты в том же приблизительно числе, как у Xenoprorhynchus и Temnocephalida (И пар), и с тем же характерным метамерным расположением были описаны у Udonella caligorum (рис. 59, А) А. В. Ивановым (1952в). Это очень крупные клетки со слабозернистой цитоплазмой и крупным ядром (рис. 59, Б). Каждый паранефроцит тесно
связан с двумя тонкими каналами. Один начинается в цитоплазме паранефроцита широкой воронкой, заполненной, как и просвет этого канала, гомогенным веществом, и соединяется с главным протонефридиальным стволом. На первый взгляд паранефроцит напоминает крупную железистую клетку, проток которой открывается в нефридиальный ствол и заполнен свернувшимся секретом. Второй канал, отходящий недалеко от первого, начинается в глубине паранефроцита более узкой воронкой, в которой отчетливо виден густой и длинный, торчащий в просвет канала пучок жгутов. Таким образом, оба канала, связанные с паранефроцитом, не со-
сех
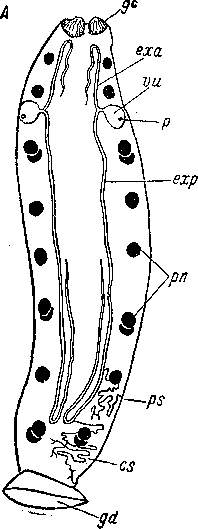
А — общий вид выделительной системы, Б — паранефроцит на разрезе, сех — ветвь протонефридиального канала, ведущая к паранефроциту, cs — вторичный канал, отходящий от паранефроцита, еха — передний цротонефридиальный канал, ехр — задний протонефридиальный канал, f — пучок жгутов, gc — железистая ямка, gd — железистый диск, п — ядро, р — выделительная пора, рп — паранефроциты, ps — вторичная выделительная пора, m — мочевой пузырек.
Рис. 59. Udonella caligorum (Udonellida). Выделительная система. (По: Иванов, 19526).
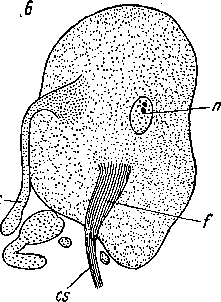
общаются друг с другом, как показывает световой микроскоп, их воронки разделены толстым слоем цитоплазмы. Канал, содержащий в своем начале пучок жгутов, разветвляется на капилляры с терминальными клетками и дает неправильные ветвящиеся протоки, которые открываются наружу многочисленными мелкими вторичными порами, рассеянными по всей поверхности тела (рис. 60).
Таким образом, паранефроциты Udonella обнаруживают известное общее морфологическое сходство с таковыми Neorhabdocoelayнапример с Polycystis, но отличаются существенно, во-первых, невакуолизированной цитоплазмой, во-вторых, тем, что полностью разделяют протонефридиальный канал на две части, и, в-третьих, наличием мощного пучка жгутов. Однако в общей гомологии паранефроцитов Udonella таковым Neorhabdocoela и Temnocephalida сомневаться не приходится.
Рис.
60. Udonella
caligorum
(Udonellida).
Выделительные каналы, связанные с
паранефроцитом. Реконструкция по
нескольким срезам. (По: Иванов, 19526).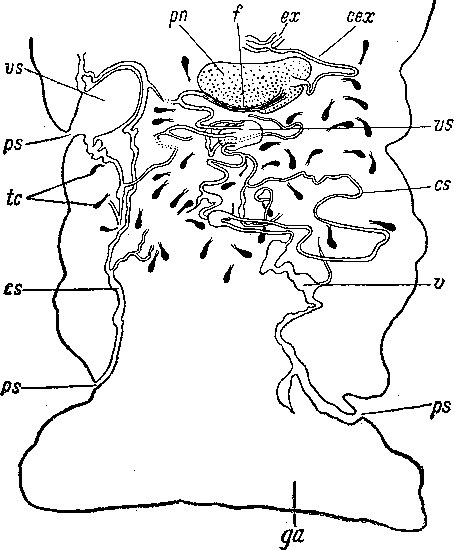
сех — ветвь протонефридиального канала, ведущая к паранефроциту, се — вторичные выделительные каналы, ех — главный протонефри- диальныи канал, f — пучок жгутов, ga — железистый прикрепительный диск, рп — паранефроцит, ps — вторичные выделительные поры, tc — терминальные клетки, и, us — неправильные расширения вторичных каналов.
Можно допустить, что паранефроциты Udonella сформировались из атроцитов, похожих на паранефроциты Polycystis. Сужение канала, проходящего внутри клетки, описанное у Polycystis, усиливалось и привело к полному перегораживанию клеткой экскреторного канала. Однако это стало возможным только после того, как протонефридиальная ветвь, снабженная паранефроцитом, стала сообщаться с наружной средой посредством одной или нескольких вторичных пор.
В результате у Udonella паранефроциты делят весь выделительный аппарат на две физиологически самостоятельные части.
Одна часть представлена главными стволами и теми их ветвями, которые лишены паранефроцитов. Их терминальные клетки гонят экскреты в главные стволы и наружу через пару латеральных мочевых пузырьков. К этой части системы должны быть, по-видимому, отнесены и каналы, соединяющие паранефроциты с главными стволами, а частью и самые паранефроциты. Другая часть представлена всеми теми ветвями, на которых сидят паранефроциты и которые в сущности отрезаны от главных стволов. Эти ветви обладают собственным гидрокинетическим аппаратом в виде мерцательного пучка паранефроцита и терминальных клеток, собственной системой протоков и наружных отверстий. Экскреторная жидкость течет по этим протокам в направлении, обратном току в системе главных стволов и независимо от него, двигаясь от паранефроцитов и терминальных клеток к вторичным порам. По-видимому, две упомянутые физиологические системы отличаются не только различным направлением тока экскретов, но между ними имеется и разделение экскреторных функций, т. е. одна из них выделяет одни вещества, другая — другие.
Наконец, отметим еще, что в экскреторном аппарате Udonella вторичны не только многочисленные выделительные поры, рассеянные по всему телу, но и прилегающие к ним периферические части капилляров. Крайнее непостоянство в числе, расположении и размерах, причудливость формы всех этих образований говорят об их относительной филогенетической молодости. В данном случае явно подтверждается правило большого числа новообразую- щихся органов, обоснованное В. А. Догелем (1936, 1947). По этому правилу появляющиеся впервые в филогенезе морфологические образования чаще всего многочисленны, непостоянны в числе и отличаются беспорядочным расположением.
Вторичные выделительные поры и выводные протоки не представляют исключительной принадлежности Udonellida. Вспомним их новообразование у Tricladida, связанное с полимеризацией выделительного аппарата, и аналогичные образования у ленточных червей (многих Tetraphyllidea и некоторых Pseudophyllidea), у которых, однако, вторичные поры (foramina secundaria) располагаются с большой правильностью на сколексе, шейке и в особенности на проглоттидах (Fuhrmann, 1930, 1931).
Особая структура паранефроцитов и наличие системы вторичных каналов и отверстий — черты несомненно весьма своеобразные, но недостаточные, чтобы отделять Udonellida от всех остальных турбеллярий.
Первичное отсутствие протонефридиев
у Acoela
В заключение рассмотрим вопрос о природе отсутствия протонефридиев у Acoela. Из всего изложенного выше уже ясно, что естественнее всего эту черту бескишечных турбеллярий считать изначальной, связанной с их общей низкой организацией. Однако
Хаджи (Hadzi, 1944, 1963), Акс (Ах, 1961), а в последнее время и Рейзингер (Reisinger, 1968) считают, что протонефридии у Acoela исчезли вторично как следствие общей физиологической и морфологической деградации. Все эти авторы связывают предполагаемую редукцию протонефридиев также с морским образом жизни Acoela. Действительно известно, что морские турбеллярии гораздо меньше нуждаются в механизме осморегуляции, чем пресноводные, и что более мощное развитие протонефридиев у пресноводных турбеллярий — несомненный факт. Однако сейчас мы имеем очень интересный «модельный» случай — полное отсутствие нефридиального аппарата у Oligochoerus limnophilus, недавно открытого в Средней Европе пресноводного представителя бескишечных турбеллярий (Ах u. Dorjes, 1966). По поводу этой замечательной формы Рейзингер пишет, что поскольку в этом случае «нет никаких намеков на проявление типичной потенции к дифференциации протонефридиальной системы, то, очевидно, у Acoela вместе с протонефридиями были утрачены и соответствующие гены» (Reisinger, 1968, стр. 20). Нам представляется, что пример Oligochoerus limnophilus, напротив, служит прекрасным свидетельством в пользу первичности отсутствия протонефридиев у бескишечных турбеллярий. Сам по себе один этот случай, конечно, не решает вопроса, но он очень хорошо согласуется со всем, что мы знаем об организации Acoela.
97
Мнение о вторичном отсутствии протонефридиев, кроме Хаджи и Акса, поддерживается еще Н. А. Ливановым (1955). Никаких фактов в пользу этой идеи привести невозможно, и она принимается им только как логическое следствие из сомнительного постулата о вторичной упрощенности организации Acoela. Впрочем, недавно Ливанов (1970) указал на так называемые мерцательные тельца Acoela как на рудименты протонефридиев. «Характерные осморегуляторы — концевые клетки с мерцательным пламенем, — пишет он, — сохранились как рудимент протонефридиев. Они настолько типичны, что трудно не узнать их в „мерцательных тельцах11 Acoela» (1970, стр. 258).
Однако, как мы видели выше, наши представления о концевых (терминальных) клетках значительно расширились и изменились в результате электронномикроскопических исследований Кюммеля и Рейзингера. Ныне уже невозможно сравнивать терминальные клетки — циртоциты — с их частью решетчатой воронковидной трубочкой, развитой вокруг жгутикового аппарата клетки, с такими простыми ресничными клетками, как мерцательные тельца.1
У нескольких видов Acoela Ю. В. Мамкаев (1967) наблюдая эмиграцию мерцательных телец из эпидермиса, уход их в глубь паренхимы. Нередко мерцательные тельца содержат пигмент и нерастворимые зерна экскрета и обладают пикнотическим ядром, что, как правильно отметил Мамкаев, указывает на их экскреторную функцию. Через посредство мерцательных телец эпидермис освобождается от экскретов, которые выводятся затем наружу через паренхиму и рот. Между тем накопление экскретов несвойственно чисто моторным по функции осморегуляторным терминальным клеткам протонефридиев.
Мерцательные тельца, следовательно, присоединяются к блуждающим в паренхиме Acoela экскреторным клеткам — атроцитам, с которыми, возможно, несут сходные функции. Следовательно, вопреки предположению Н. А. Ливанова их скорее можно трактовать как первый зачаток экскреторной системы атроцитов, а не как рудименты осморегуляторного протонефридиального аппарата.
Нервная система
Представлениями о начальных этапах эволюции нервной системы у турбеллярий мы обязаны Рейзингеру (Reisinger, 1925, 1972), Вестбладу (Westblad, 1948), В. Н. Беклемишеву (1937, 19636) и Н. А. Ливанову (1941). Недавно стали известны новые факты, касающиеся в основном Acoela (Dorjes, 1968), которые подтверждают выводы этих авторов.
Примитивные формы нервного аппарата
Самые примитивные турбеллярии обладают нервным аппаратом, стоящим почти на уровне такового кишечнополостных, а именно сплетением нервных клеток, лежащим в толще эпидермиса. Диффузный нервный плексус образует более или менее сплошной слой ганглиозных клеток и нервных волокон, занимающий базальную часть эпидермиса и обычно граничащий со слоями кожно- мускульного мешка. Такая нервная система свойственна Хепо- turbellida и некоторым низшим турбелляриям — части Gnathosto- mulida и некоторым Acoela. Среди последних ею обладают Nemer- todermatidae, большая часть Hofsteniidae, все Nadinidae и некоторые Haploposthiidae, Otocelididae, Childiidae и Mecynostomidae.
Наиболее примитивными отношениями безусловно отличается Xenoturbella bocki (рис. 4, Б; 5, А), так как у этой турбеллярие- образной формы ни о каких нервных элементах, погруженных в паренхиму, еще не может быть и речи (Westblad, 1949а). Ее статоцист лежит на переднем конце тела в базальном нервном слое. Это первая его примитивная особенность, так как у Metazoa орган равновесия большей частью (исключение представляютCtenophora) образуется как более или менее отшнуровивающееся впячивание покровов.
Вторая примитивная черта статоциста у Xenoturbella — его многоклеточность (рис. 6, А), у Acoela стенка этого органа слагается всего из двух специализированных клеток. Наконец, стато- цист Xenoturbella содержит несколько статолитов, что тоже следует считать его первичной особенностью.
Что касается турбеллярий с эпителиальным нервным плек- сусом, то ни в одном случае мы не можем быть уверены, что весь нервный аппарат у них ограничивается только интраэпителиаль- ными элементами. По описанию Акса (Ах, 1956,1960), у Gnathosto- mula paradoxa нервная система лежит целиком в эпидермисе. На переднем конце тела кожный эпителий утолщается в мощную «головную шапочку», вся базальная часть которой превращена в объемистый нервный центр (рис. 38, А). Сильное развитие последнего, как нам кажется, может быть объяснено наличием на переднем конце тела многочисленных мощных осязательных пучков жгутов (рис. 2, А) и связанных с ними чувствительных клеток. В остальных местах тела нервная ткань прослеживается лишь как тонкий слой базальной части эпидермиса. Однако, по описанию Штерера (Sterrer, 1969), у Pterognathia имеется уже внутренняя нервная система ортогонального типа.
У всех Nemertodermatidae (Nemertoderma и Меага) однослойный эпидермис отличается значительной высотой. Нейропиль и нервные клетки занимают его базальную часть, образуя заметное утолщение — род главного нервного центра у переднего конца тела (рис. 36). Nemertoderma bathycola, кроме того, имеет небольшое рыхлое внутреннее скопление ганглиозных клеток близ статоциста. Это зачаточный церебральный ганглий — эндон (Reisinger, 1925), возникающий у Acoela в связи с углублением под кожу органа равновесия; он отделяется от эпителиального нервного плексуса и погружается вместе со статоцистом (Steinbock, 1930-1931, 1938; Westblad, 1937, 1948; Reisinger, 1972).
У Hofsteniidae (Hofstenia, Hofsteniola) мы находим сходные отношения (Bock, 1923; Papi, 1957, Steinbock, 1966). Однако у Marcusiola tinga произошли уже полное погружение переднего нервного центра под кожу и концентрация остального нервного плексуса с образованием продольных нервных стволов. Интересно, что последние еще не полностью залегают в паренхиме, из трех пар стволов две спинные пары проходят в толще эпидермиса, тогда как вентральная пара занимает субэпителиальное положение (рис. 61; Du Bois-Reymond Marcus, 1957). В данном случае процесс погружения остановился как бы на полпути. Дальнейшее формирование внутренней нервной системы в этой филогенетической линии мы видим у низших Lecithoepitheliata, связанных родством с Hofsteniidae (Steinbock, 1966; Reisinger, 1968).
В настоящее время известно около 20 видов Acoela, не считая Nemertodermatidae и Hofsteniidae, у которых нервная система интраэпителиальна. Неизвестно, имеют ли эти виды зачаточный эндон, подобный таковому Nemertoderma bathycola, но для многих из них это очень вероятно. Все эти формы можно разделить на две группы: 1) виды с более примитивным состоянием нервной системы, полностью лежащей в толще эпидермиса, и 2) виды, у которых началось уже погружение нервной ткани в паренхиму и часть ее занимает субэпителиальное положение. У последних эпители-
Рис.
61. Marcusiola
tinga.
Схема
поперечного разреза в области глотки.
(По: Du
Bois-Reimond Marcus, 1957).
dn
ph
-par
on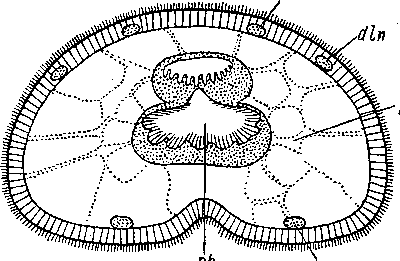
dn — спинной нервный ствол, din — внешний спинной нервный ствол, par — паренхима, ph — глотка, vn — брюшной нервный ствол .
альный мозг пересекается слоями кожно-мускульного мешка.
Ниже мы приводим список Acoela с интраэпителиальной нервной системой в соответствии с новой классификацией Дорьеса-
(Dorjes, 1968).
Формы с полностью эпидермальным нервным плексусом
Nemertodermatidae
Nemertoderma bathycola Steinbock, 1930—1931; Westblad, 1937 (рис. 36) Meara stichopi Westblad, 1949b
Hofsteniidae
Hofstenia atroviridis Bock, 1923 H. giselae Steinbock, 1966 H. beltagii Steinbock, 1966 Hofsteniola pardii Papi, 1957
Haploposthiidae
Haploposthia brunea An der Lan, 1936 H. albiventer Marcus, 1954
Haplogonaria (=Mecynostomum) pellita (Marcus, 1951) Pseudohaplogonaria (—Convoluta) viridipunctata (Westblad, 1946)
P. (=Convoluta) stylifera (Westblad, 1946)
P. (—Convoluta.) sutcliffei (Hanson, 1961)
P. (= Convoluta) macnei (Du Bois-Reymond Marcus, 1957)
Childiidae
Tetraposthia colymbetes An der Lan, 1936 Philactinoposthia helgolandica Dorjes, 1968
Mecynostomidae
Pseudomecynostomum (=Mecynostomum) evelinae (Marcus, 1948) Nadinidae
Nadina pulchella Uljanin, 1870; Riedl, 1954 N. (=Hallangia) evelinae (Marcus, 1952)
Otocelididae
Philocelis (=Convolu.ta) Jcarlingi (Westblad, 1946)
Формы с нолупогруженным нервным плексусом
Haploposthiidae
Haplogonaria sinubursaria Dorjes, 1968 Parahaploposthia cerebroepilheliata Dorjes, 1968 (рис. 62).
Рис.
62.
Parahaploposthia
cerebroepitheliata (Acoela). Сагиттальный
разрез передней части тела. (По:
Dorjes,
1968).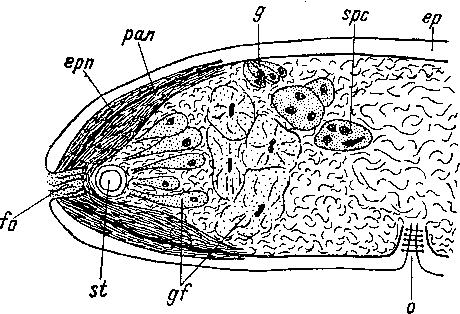
ер — эпидермис, ерп — эпидермальная часть нервной системы, fo — фронтальный орган, g — половой зачаток, gf — фронтальные железы, о — ротовое отверстие, pan — часть нервной системы, лежащая в паренхиме, spc — сперма- тоциты, st — статоцист.
Childiidae
Philactinoposthia viridorhabditis Dorjes, 1968 Paraproporus diovatus, D5rjes, 1968
Otocelididae
Archocelis macrorhabditis Dorjes, 1968
Наконец, существует ряд видов, у которых центральная часть нервного плексуса погружена целиком в паренхиму, но все еще прилегает к покровам. Между ними и большинством Acoela с внутренним мозгом, окружающим статоцист, нет резкой границы.
Формы, у которых погруженный нервный плексус еще прилегает изнутри к кожно-мускульному мешку
Наploposthiidae
Adenocauda helgolandica Dorjes, 1968 (рис. 63)
Haplogonaria simplex Dorjes, 1968 Simplicomorpha gigantorhabditis Dorjes, 1968
Childiidae
Philactinoposthia avesicula Dorjes, 1968 Mecynostomidae
Pseudomecynostomum fragilis Dorjes, 1968
Otocelididae
Philocelis cellata Dorjes, 1968
Notocelis (= Otocelis) gullmarensis (Westblad, 1946)
N. subsalina (Ax, 1959)
Погруженная нервная система
Таким образом, весьма существенным и к тому же одним из первоначальных процессов в эволюции нервного аппарата турбеллярий следует считать погружение его в паренхиму (Reisinger,' 1925, 1972; Hans- trom, 1926, 1928; Ливанов,
of-
Рис. 63. Adenocaudahelgolandica (Acoela). Сагиттальный разрез передней части тела. (По: Dorjes, 1968).

. 1941; Беклемишев, 1944). У большинства Acoela и у всех других турбеллярий (кроме Лот части Gnathostomulida) мы видим уже внутреннюю нервную систему; на поверхности тела — в толще эпидермиса — остаются только эпителиальные чувствительные нервные клетки и периферические отростки ганглиозных двигательных и чувствительных клеток.
dvrn — дорсо-вентралышй мускул, ер — эпидермис, gc — железистые клетки, gf — фронтальные железы, of — отверстие фронтального органа, п — нервная система, st — статоцист.
Вместе с погружением, то отставая от него, то опережая его, происходит и второй очень характерный процесс — концентрация нервной системы (Reisinger, 1925, 1972; Hanstrom, 1928; Догель, 1940; Ливанов, 1941; Беклемишев, 1944). Он выражается в том, что нервные и ассоциативные клетки с их отростками собираются в несколько пар продольных тяжей, или стволов, соединенных многими поперечными комиссурами. Образуется более или менее правильная нервная решетка, или ортогон, по терминологии Рейзингера (Reisinger, 1925). В промежутках ортогона остаются только периферические элементы нервного аппарата — чувствительные клетки с их отростками и отростки двигательных клеток. В результате центральные связи между клетками ортогона сильно укорачиваются, тогда как связд центра
С периферией удлиняются. Однако у многих турбеллярий (Acoela, Polycladida, Prolecithophora, некоторые Neorhabdocoela, Tricla- dida) наряду с ортогоном существует более или менее густой нервный плексус, расположенный в периферических слоях паренхимы.
При
дальнейшей эволюции турбеллярий
централизация ортогона возрастает.
Это выражается в уменьшении числа
продольных и поперечных стволов, т.
е. в их олигомеризации (Догель, 1954).
Замечательно, что такая централизация
совер-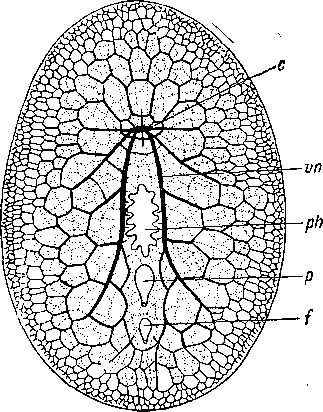
Рис. 64. Planocera graffi (Polycladida).
Нервная система. (По: Lang, 1884).
с — мозг, f — женский копулятивный аппарат, р — мужской копулятивный аппарат, ph. — глотка, vn — брюшной нервный ствол.
шается легче и быстрее у мелких форм и отстает у крупных (Беклемишев, 1964). Поэтому централизация нервного аппарата
СС
Рис.
65. Thysanozoon
brochi
(Polycladida).
Мозг
на поперечном разрезе. (По: Lang,
1884).
сс
— капсула мозга, сот
— внутренняя комиесура, gc
—
две крупные симметрично лежащие клетки
в брюшной части мозга, рп
— главный задний нервный ствол.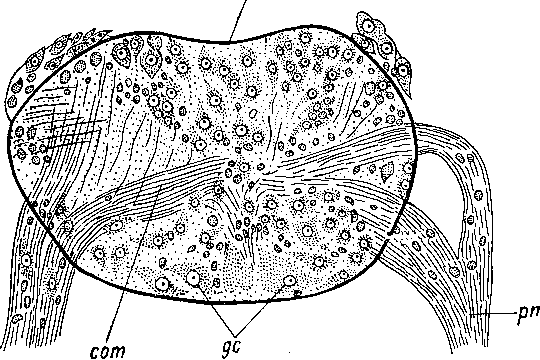
достигает своего максимума у мелких видов, занимающих высокое систематическое положение.Рис. 66. Anaperus biaculeatus. Нервная система, окрашенная методом Жеребцова (путем обнаружения холинэстераз в нервной ткани). (Ориг. рис. Е. А. Котиковой).
с — мозг, сh — скопление холинэстераз в области мужского совокупительного органа, сот — комиссуры и их разветвления, din — дорсолатеральный нервный ствол, dn — спинной нервный ствол, In — боковой нервный ствол, тп — краевой нервный ствол, нерв краевого мускула, па — передние нервы, phn — глоточный кольцевой нерв, st — статоцист, vn — брюшной нервный ствол.Действительно, у крупных и сравнительно примитивных Polycladida ортогон отличается очень большим количеством радиальных и поперечных нервных стволов, особенно на брюшной стороне тела, вследствие этого он очень слабо централизован (рис. 64). У поликладид, впрочем, это компенсируется очень высокой дифференциацией эндонального мозга, заключенного в соединительнотканную капсулу (рис. 65); его прогрессивная эволюция скорее всего обусловлена развитием мозговых глаз и щупалец. У более крупных Acoela, например у Anaperus biaculeatus (рис. 66), который достигает 5 мм, и у A. sulcatus (до 12 мм'в длину), имеется сложный ортогон с многими продольйыми и поперечными стволами, тогда как мелкие виды обладают как бы упрощенным ортогоном с 3—4 парами продольных стволов (Беклемишев, 1937; Мамкаев и Котикова,
1972).
Крупные Tricladida
также
характеризуются сравнительно сложным
ортогоном; у более мелких морских
форм ортогон сильнее централизован,
чем сравнительно диффузная нервная
решетка у наземных планарий. Наибольшей
централизации достигает нервная
система у большинства мелких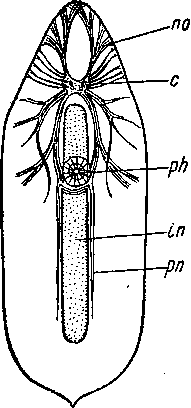
Рис. 67. Mesostoma ehrenbergi (Neorhabdocoela). Пищеварительная и нервная системы. (По: Bresslau и.
Voss, 1913).
с— мозг, in — кишка, па — передние нервы, ph — глотка, рп — задний нервный ствол.
Neorhabdocoela — здесь остаются только два продольных нервных ствола (например, у Mesostoma (рис. 67) или у Proxenetes). Впрочем, мелкие Macrostomida, несмотря на большую примитивность этого отряда, им не уступают; они также сохранили лишь пару боковых нервных стволов.
Третий важный процесс заключается в формировании и развитии внутреннего эндонального мозга. Начало его мы отметили уже у Nemertoderma. Однако дальнейшее развитие эндона наблюдается лишь у немногих Acoela, а максимальное его выражение мы находим в других отрядах. Среди Acoela хорошо развитый эндон описан, например, Вестбладом (Westblad, 1940, 1942, 1945, 1948) у Proporus brochi, Diopisthoporus longitubus и Childia groenlandica. У этих форм моэг окружает более или менее плотно статоцист. От мозга в разные стороны к стенкам тела расходятся нервные тяжи, которые у Diopisthoporus имеют правильное шестилучевое расположение (рис. 68). Интересно, что внутри этих тяжей проходят радиальные мускульные волокна, на которых подвешен статоцист; снаружи тяжи соединяются с продольными стволами
ортогона. Обычно, однако, статоцист так плотно окружен нервной тканью, что только его шесть мускулов, пронизывающих мозг, указывают на первоначальные отношения эндона к передней части ортогона (Westblad, 1948).
У
преобладающего большинства Acoela,
однако,
эндональный мозг не развивается. Вместо
него формируется более или менее
кольцевидный ортогональный мозг,
возникающий как местное утолщение
продольных стволов и связывающих их
комиссур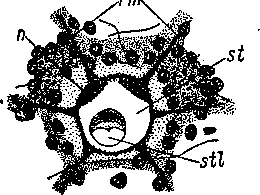
Рис. 68. Diopisthoporus longitubus (Acoela). Поперечный разрез мозга. (По: Westblad, 1940).
п — ядро клетки стенки статоциста, гт — радиальные мускульные волокна, st — полость статоциста, stl — статолит.
(рис. 66, 69; Беклемишев, 1937; Иванов, 1952а). Как полагает
В. Н. Беклемишев, это происходит за счет увеличения объема нейропиля в передних участках ортогона в связи с возрастанием количества кожных чувствительных клеток на переднем конце тела.
Другие
турбеллярии, возможно кроме Macrostomida,
обладают
эндональным мозгом, a
Catenulida
и
все Proseriata
имеют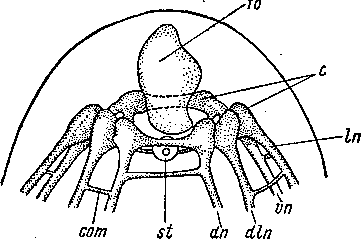
Рис. 69. Convoluta sagittifera (Acoela). Ортогональный мозг. Реконструкция по срезам. (По: Иванов,
1952а).
с — мозг, сот — комиссура ,/о — фронтальные железы, din — дорсо-лате- ральный нервный ствол, dn — спинной нервный ствол, In — боковой нервный ствол, st — статоцист, vn — брюшной нервный ствол.
и статоцист, лежащий или внутри мозга, или возле него. В отличие от Acoela у представителей других отрядов чувствительные клетки переднего конца тела посылают свои отростки не в ортогон, а в мозг, который развивается в высокодифференцированный, мощный церебральный ганглий с несколькими парами чувствительных нервов. Именно мозг иннервирует глаза, обонятельные ямки и кожные чувствительные клетки. Посредством радиальных коннективов эндональный мозг связан со стволами ортогона. Итак, мозг большинства турбеллярий представлен эндоном, воз
никновение которого в филогенезе определялось наличием органа равновесия (Беклемишев, 1964). Соответственно прототип турбеллярий должен был обладать, кроме нервного плексуса, ста- тоцистом и зачаточным эндональным мозгом.
сот
сот
Рис.
70. Bothrioplana
semperi
(Prose-
riata).
Нервная
система. (По: Reisinger,
1925).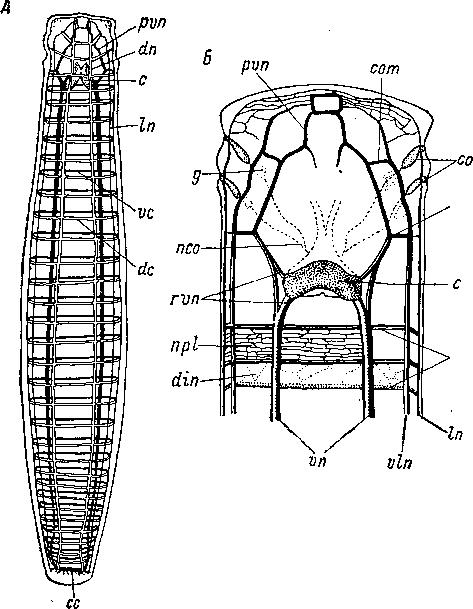
А — общий вид нервной системы, В — брюшная часть нервной системы переднего конца тела, с — мозг, сс — каудальная комиссура, со — ресничные ямки, сот — комиссуры, dc — спинная часть комиссуры, din — диагональные нервные волокна, dn — спинной нервный ствол, g — железы ресничной ямки, In — боковой нервный ствол, псо — нерв ресничной ямки (обозначен пунктиром), npl — нервный плексус, pvn — прецеребральная часть брюшного нервного ствола, пт — коннективы, соединяющие брюшные стволы с мозгом, vc — брюшная часть комиссуры, vln — вентро- латеральный нервный ствол, vn — брюшной нервный ствол.
У сравнительно примитивных турбеллярий мозг не оказывает большого влияния на ортогон. Так, у Proseriata (рис. 70) или у Lecithoepitheliata (Geocentrophora, по: Steinbock, 1927) стволы ортогона проходят, минуя мозг, с которым они соединены лишь коннективами.
Однако у высокоразвитых турбеллярий мозг приобретает господствующую роль, так как становится посредником между многочисленными периферическими чувствительными клетками —
рецепторами, посылающими отростки в мозг, и мускулатурой всего тела. Отростки ассоциативных клеток мозга, входя в состав продольных стволов ортогона, устанавливают связь с самыми удаленными уголками тела. Поэтому вначале слабые коннективы между мозгом и ортогоном значительно утолщаются и превращаются как бы в основания главных продольных стволов (рис. 71; Ливанов, 1941; Беклемишев, 1964).
Наконец,
очень важную роль в прогрессивной
эволюции турбеллярий играют процессы
усложнения внутренней архитектоники
нервной системы, дифференциация
нейрональных отношений и связей,
обеспечивающие возрастающую сложность
и пластичность поведения животных.
Морфологическое значение нервной системы
Подводя итоги, мы можем сказать, что у турбеллярий налицо все основные этапы эволюции нервной
Рис. 71. Xenoprorhynchus steinbocki (Led- thoepitheliata). Нервная система. (По: Reisinger, 1968).
ао — уховидный чувствительный вырост головного конца тела, со — мерцательная ямка, сот — комиссура, dn — спинной нервный ствол, In — боковой нервный ствол, ph — глотка, st — стилет ядовитого органа, vln — вентро-латераль- ный нервный ствол, vn — брюшной нервный ствол.
системы Protostomia. Самым примитивным состоянием следует, разумеется, считать интраэпителиальный диффузный нервный плексус Xenoturbellida, Gnathostomulida и Acoela.
Известно, что очень примитивная нервная система, залегающая в толще эпидермиса, встречается и у низших представителей других Metazoa (например, у части немертин и у некоторых ан- нелид) и характерна для нескольких групп беспозвоночных высокого систематического ранга (Phoronidea, Brachiopoda, Hemichor- data, Pogonophora, отчасти Echinodermata).
В начальных стадиях эволюции нервного аппарата у турбеллярий имеют место три более или менее параллельных процесса — централизация системы (т. е. дифференциация ортогона из однородного плексуса), погружение его в паренхиму и образование эндона в области статоциста. Различные этапы этих процессов мы видим у разных представителей Acoela, но прогрессивная эволюция эндона разыгрывается уже за пределами этого отряда.
Примитивность кожного нервного плексуса у Acoela признается почти всеми зоологами, изучавшими нервную систему турбел-
Яярий (Рейзингер, Штейнбек, Ан дер Лан, Ёестблад, Гайман, Папи, Ридль, Беклемишев, Иванов, Мамкаев). Исключение составляют Бок (Воск, 1923), допускавший возможность вторичного упрощения нервного аппарата у описанной им Hofstenia atrovi- ridis, а также Акс (Ах, 1961) и Н. А. Ливанов (1970), исходившие из априорного представления об Acoela как о животных, претерпевших сильные регрессивные изменения.
По мнению Акса, общая картина распределения видов Acoela, обладающих поверхностной нервной системой, говорит против первичности этого признака. «У явно естественных родов — Нар- loposthia, Mecynostomum, Otocelis и Convoluta — имеются как виды с поверхностным нервным плексусом, таки виды с высокоразвитой внутренней системой». «Методически невозможно, — говорит Акс, — чтобы все эти беспорядочно рассеянные виды имели общего предка с эпителиальной нервной системой» (Ах, 1961, стр. 28).
Действительно, вряд ли можно соединять в один род виды с нервной системой столь различного типа; с нашей точки зрения, существование таких родов неоправданно. Даже по новой, усовершенствованной системе Acoela, предложенной Дорьесом (Dorjes, 1968), четыре рода — Iiaploposthia (7 видов), Haplogonaria (8 видов), Philactinoposthia (8 видов) и Pseudomecynostomum (13 видов) — представляются нам по этой причине искусственными. В каждом из них имеется по два вида с эпителиальной нервной системой, которые должны быть удалены из этих родов. Даже если согласиться с Аксом и считать поверхностную нервную систему вторичным упрощением (для чего нет никаких серьезных оснований), даже в этом случае нельзя найти достаточных оправданий для сохранения этих «вторично измененных» форм в составе упомянутых родов. При любом решении вопроса о природе эпителиального нервного плексуса эти роды следует считать искусственными.
Таким образом, мы полагаем, что, во-первых, не может быть речи о «явно естественных родах» и что, во-вторых, впечатление о «беспорядочном распределении» видов с эпителиальной нервной системой есть результат несовершенства современной систематики Acoela.
Остальные Acoela с интраэпителиальным нервным плексусом образуют естественные систематические единицы. Таковы все Nemertodermatidae, Nadinidae и роды Tetraposthia, Philocelis, Notocelis и Archocelis. Среди четырех видов Paraproporus нервная система достаточно известна только у P. diovatus. Что касается Hofstenia tinga, которая, по мнению Акса, нарушает единство рода Hofstenia, то ныне эта форма выделяется в самостоятельный род Marcusiola, который по ряду признаков, и в том числе по нервной системе, сближает Hofsteniidae с Lecithoepitheliata (Steinbock, 1966).
Далее все виды Convoluta с эпителиальным нервным плексусом, упоминаемые Аксом, уже изъяты из этого рода и частью отнесены к другим семействам. Convoluta thauma (Marcus, 1952) попала в род Haplogonaria\ Convoluta viridipunctata и С. stylifera (Westblad, 1946) причислены к роду Pseudohaplogonaria, а С. agi- lis (An der Lan, 1936) признана формой неясного систематического положения. Convoluta karlingi (Westblad, 1952) помещена в семейство Otocelididae под названием Philocelis karlingi (см.: Dorjes, 1968).
Наконец, нужно сказать, что убеждение о невозможности проявления очень примитивных признаков в изолированных и в общем высокоразвитых группах основано на ложном представлении об обязательно равномерной параллельной эволюции всех систем органов. Такой эволюции в действительности никогда не было.
По мнению Н. А. Ливанова (1970), Acoela свойствен тот же план строения нервной системы, что и другим турбелляриям, а именно в состав ее входят головной мозг и связанные с ним нервное сплетение эпидермиса, а также (у Convoluta) 4 пары продольных нервных стволов. Формирование мозга у турбеллярий Ливанов связывает с развитием у них «головного комплекса органов чувств», т. е. глаз, осязательных чувствительных клеток, диффузных или сосредоточенных на щупальцах, хеморецепторов — ресничных ямок, аурикулярных органов и иногда статоциста (Ливанов, 1955, 1970). Поскольку же все эти органы, за исключением статоциста и, как правило, глаз, у Acoela отсутствуют, то, по мнению Ливанова, у них нет базы для формирования мозга. «Для образования сенсорного центра, даже самого незначительного, нет необходимой, достаточно чувствительной периферии, если даже включить сюда тактильные клетки переднего конца». Далее автор делает вывод: «Раз имеется чувствительный центр при отсутствии типовой чувствительной периферии, он представляет лишь сохранившийся остаток при общем упрощении организации, в данном случае при редукции типового головного комплекса органов чувств, имеющегося у турбеллярий» (Ливанов, 1970, стр. 527).
В этих рассуждениях много упрощений и весьма уязвимых мест.
В самом деле, нервный аппарат Acoela гораздо разнообразнее, чем представляет себе Н. А. Ливанов. При сравнительном его изучении ясно вырисовываются прогрессивные, а не регрессивные пути его эволюции. Как мы могли убедиться, у Acoela развит преимущественно ортогональный мозг, образующийся путем разрастания передних частей ортогона, а у большинства остальных турбеллярий •— негомологичный ему (в строгом смысле термина) эндональный мозг, первично возникающий вокруг статоциста. Сопоставляя головной мозг первых и вторых, Н. А. Ливанов сравнивает негомологичные органы. Из этого сравнения нельзя извлечь никаких филогенетических выводов.Утверждение, что развитие мозга связано с наличием органов чувств, справедливо лишь в общей форме (Hanstrom, 1928; Reisinger, 1972). Однако совершенно произвольно предположение о том, что минимальной базой для возникновения мозга могла служить только та совокупность органов чувств, которая свойственна высшим турбелляриям (очевидно, Seriata, Neorhabdocoela и отчасти Polycladida). Разумеется, этот набор органов появился отнюдь не сразу. В процессе эволюции, очевидно, существовали какие-то формы, у которых головной комплекс органов чувств не был еще развит в полной мере, но уже существовал эндональный мозг, который, как мы знаем, возникает в связи со статоци- стом.
Известно множество примеров (гребневики, пелагические личинки различных Metazoa), когда на переднем (анимальном) конце тела развивается сгущение нервных клеток, нервный центр, связанный с чувствительным аборальным органом, теменной пластинкой, или с султаном чувствительных жгутов, или просто с системой чувствительных клеток эпидермиса. Нет оснований считать, что Acoela, всегда обладающие статоцистом и очень часто многочисленными кожными чувствительными клетками или многоклеточными сенсиллами на переднем конце тела, в этом отношении представляют исключение. Это было бы очень странное и непонятное исключение
Рассматривая далее состояние ортогональной нервной системы у Acoela, Н. А. Ливанов по существу считает ее рудиментом, лишенным какого-либо важного физиологического значения. Этот парадоксальный вывод строится на двух очень сомнительных положениях. Во-первых, утверждается, что у турбеллярий роль продольных нервных стволов сводится в основном к иннервации мускулатуры; во-вторых, признается отсутствие у Acoela кожномускульного мешка и другой более или менее «нормальной» мускулатуры. «При отсутствии мускулатуры кожно-мышечного мешка, при разбросанном состоянии типичных мышечных клеток в разнородной паренхиме. . . существование и развитие продольных стволов понятны и возможны лишь при одном допущении: имевшаяся когда-то нормальная мускулатура стенки тела значительно редуцировалась, а моторная часть нервной системы еще сохранилась как остаток былого» (Ливанов, 1970, стр. 527).
Невозможно, однако, принять продольные стволы ортогона за исключительно моторную часть нервного аппарата, так как этому противоречат многие хорошо известные факты. Так, у Tricladida брюшные и спинные стволы принимают отростки многочисленных чувствительных клеток и нейронов, дендриты которых заканчиваются на поверхности тела, особенно на боковых краях тела (например, у Bdelloura). У Tricladida Maricola имеются 3 пары продольных нервных стволов, из них латеральные состоят только из сенсорных нейронов и их аксонов и не имеют ганглиозных промежуточных и моторных клеток (HanstrOm, 1926). У Geoplana pulla и многих других наземных планарий органы чувств иннервируются от ортогона, а не от мозга (Bullock a. Horridge, 1965).' У Mesostoma (Neorhabdocoela) чувствительные клетки — реоре- цепторы, определяющие направление и силу токов воды, посылают свои аксоны в продольные вентральные стволы (Gelei, 1930). Подобные отношения имеются и у Acoela, например у Oxyposthia praedator и Convoluta sagittifera, у которых многочисленные многоклеточные осязательные сенсиллы в передней половине тела иннервируются от продольных стволов ортогона (Иванов, 1952а). У бескишечных турбеллярий, по-видимому, ортогон вообще выполняет все основные функции нервного аппарата,, как моторные, так и сенсорные (Беклемишев, 1964; Иванов, 1971а).
Что касается предполагаемого отсутствия кожно-мускульного мешка, то, вероятно, это заключение делается Н. А. Ливановым только на том основании, что у Acoela часто не бывает настолько развитых мускульных слоев, чтобы можно было рассматривать их как настоящую мускульную ткань. Однако еще со времен Граффа (Graff, 1882, 1891, 1904—1908) хорошо известно, что мускулатура бескишечных ресничных червей не отличается в принципе от таковой остальных турбеллярий. У Acoela имеются как паренхимные мускульные волокна, так, разумеется, и настоящий кожно-мускульный мешок. Эта истина остается, конечно, справедливой и ныне, когда мы знаем, что у ряда форм кожно-мускульный мешок состоит из более или менее изолированных миоци- тов или из миофибрилл эпителиально-мускульных клеток.
Итак, нет никаких фактических оснований видеть в продольных нервных стволах Acoela всего только «остаток былого». Чтобы быть последовательным, Н. А. Ливанову следовало бы признать их рудиментами, как вообще и принято именовать подобного рода «остатки». Пикантность этой ситуации усугубляется еще и тем, что многие Acoela обладают ортогоном, наиболее полно развитым по сравнению с большинством других турбеллярий. В действительности они имеют не только четыре, а порой пять и даже шесть пар продольных нервных стволов, соединенных многочисленными комиссурами. Именно из такого полноценного ортогона ацельного типа, как мы видели выше, путем олигомеризации большей части нервных стволов и концентрации нервных клеточных элементов сформировались нервные аппараты Macrostomida, Seriata, 'Neorhabdocoela.
Органы чувств
Статоцист
Об органе равновесия турбеллярий и его роли в эволюции нервной системы уже была речь,- Напомним, что, кроме Acoela и Proseriata, статоцист свойствен некоторым примитивным Catenulida, именно Catenula, Dasyhormus, Suomina, Chordarium и
Rhynchoscolex (Marcus, 1945a). Некоторые Proseriata утратили статоцист, таковы, например, Bothrioplana, Nematoplana, Tabaota, P olystyliphora (Ax, 1961).
Все случаи, когда внутри статоциста находится не один, как обычно у турбеллярий, а несколько статолитов, Акс рассматривает как примеры вторичного умножения. Нам кажется, что для этого заключения нет серьезных оснований, гораздо естественнее принять, что сперва было несколько статолитов, как у Xenotur-
Рис.
72. Схема осязательных жгутиковых клеток
и их постепенного погружения под
эпителий и концентрации у Acoela,
составленная
по данным Лютера (Luther,
1912,
из: Bresslau
1928—1933).
а — реснички, сер — погруженная эпидермальная клетка, cm — коль- цевой слой кожно-мускульного мешка, f — осязательные жгуты, im — интраэпителиальная продольная миофибрилла, 1т — продольный слой кожно-мускульного мешка, п — ядра эпидермиса, sc — погруженная чувствительная клетка, see — то же в составе эпидермиса, sen — сенсилла из трех клеток.
bella, затем произошла их олигомеризация — сначала до двухтрех у Nemertodermatidae и Rhynchoscolex (Rh. diplolithicus Reisinger, 1924; Rh. evelinae Marcus, 1945; Rh. remanei Rixen, 1961), а затем до одного.
Замечателен случай наличия типичного статоциста с двумя статолитами у Lurus — одного морского рода из подотряда Da- lyellioida (Neorhabdocoela) (Marcus, 1950). Очевидно, этот изолированный случай сохранения очень древней особенности организации легко объясняется, если допустить, что первобытные примитивные Neoophora, давшие начало Neorhabdocoela и Seriata, обладали статоцистом. Что это так и было, доказывает наличие статоциста у большинства Proseriata. Затем статоцист сохранялся некоторое время у вымерших форм, представлявших главную линию эволюции Neorhabdocoela. У большинства современных раб- доцелид этот орган, однако, редуцировался. Нет никаких причин отказываться от этого вполне естественного объяснения. Предпо-
А. В. Иванов и Ю. В. Мамкаев
ложение Акса о появлении у Lurus «независимого новообразования» кажется нам маловероятным.
По наблюдениям Рейзингера (Reisinger, 1924), у очень молодых Rhynchoscolex статоцист открывается наружу особой порой на спинной стороне «головы», т. е. находится на более примитивном
уровне развития, чем у дру- §■• щ & гих турбеллярий, и пред-
^ ,,л % ‘а ' Щ ставляет по сравнению с
v ф !^‘ % # / эпителиальным статолитом
/ “ф Xenoturbella как бы пер-
л ^
*•' вый шаг по пути к форми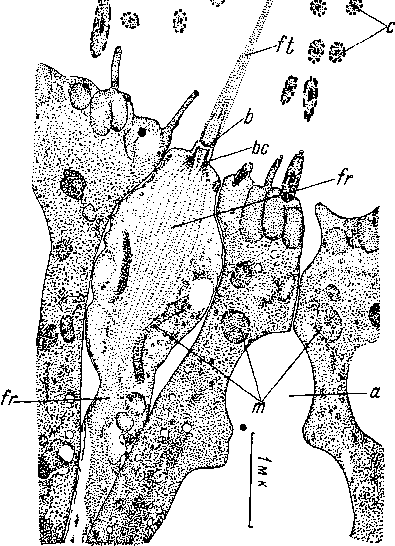
рованию погруженного замкнутого статоциста.
Осязательные сенсиллы
В состав эпидермиса турбеллярий входят чувствительные клетки, снабженные рецепторным аппаратом в виде жгута или щетинки и дающие отросток к центральной нервной системе (рис. 72). У многих турбеллярий упругие осязательные щетинки
Рис. 73. Bothrioplana semperi. Ультраструктура осязательного рецептора. (По: Reisinger, 1968).
а — «прозрачная вакуоль», Ъ — перетяжка, создающая способность жгута перегибаться у основания, Ьс — базальное зерно жгута, с — реснички, т — митохондрии, fr — корневые нити, ft — осязательный жгут.
торчат в большом числе на краях головного участка. Строение клеток, которым они принадлежат, было изучено недавно с помощью электронного микроскопа у Bothrioplana (рис. 73) и Xenoprorhynchus и у обеих форм оказалось сходным (Reisinger, 1968). Оказалось, что щетинка есть видоизмененный жгут, обнаруживающий типичную «структуру 9+2». У основания его лежит типичная кинетосома, заканчивающаяся базальной пластинкой. Имеется мощный пучок корневых нитей, проникающий глубоко в цитоплазму веретеновидной клетки. Замечательно, что у самого своего основания жгут подвижно сочленен с клеткой. Способность жгутаДвигаться представляет собой механическую основу для функционирования клетки в качестве осязательного рецептора. Бросается в глаза и замечательное конвергентное сходство этого одноклеточного осязательного органа с некоторыми типами осязательных щетинок у членистоногих (Reisinger, 1968).
У
многих форм в разных отрядах подобные
осязательные клетки группируются в
особые комплексы — многоклеточные
сенсиллы, причем жгуты соединяются в
более или менее мощные пучки. Такие
сенсиллы, по-видимому, характерны для
Gnathostomulida