
- •2. Химическая кинетика – изучает скорость хим реакций. Количественно скорость оценивают по изменении концентрации в ед времени.
- •Vt1(t2) – скорость реакции при соответствующих температурах
- •3. Состояние равновесия характерно для обратимых химических реакций.
- •10. Гальванический элемент (Даниэля Якоби). Служит для превращения химической реакции в электрическую.
- •11. Коррозия Ме – процесс разрушения Ме под воздействием окр.Среды.
- •12. Электро́лиз — окислительно-восстановительный процесс, который происходит на электродах во время прохождения электрического тока через расплав или раствор.
- •Взаимодействие с неметаллами
10. Гальванический элемент (Даниэля Якоби). Служит для превращения химической реакции в электрическую.
(-) Zn|ZnSO4||CuSO4|Cu (+)
←SO42-
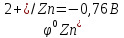 ;
;
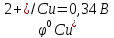
(-) На Аноде электроды с меньшим алгебраическим значением Е, всегда идет процесс окисления.
(+) На Катоде электроды с большим алгебраическим значением Е, всегда идет восстановление.
(-) Анод (Zn): Zn – 2e = Zn2+
(+) Катод (Cu): Cu2++ 2e = Cu
Е
= φок
– φвосст
=
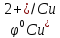 -
-
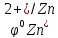 = 0,34 + 0,76 = 1,10В
= 0,34 + 0,76 = 1,10В
Е > 0, он работает
Электролиз
(+) Анод: Сu – 2e = Cu2+
(-) Катод: Zn2++ 2e = Zn
ГЭ Даниэля Якоби – обратимый элемент, т.к. при смене направления тока на электроды идут процессы в обратном направлении.
Обратимые ГЭ представляют интерес в качестве аккумуляторов (хим источники тока).
11. Коррозия Ме – процесс разрушения Ме под воздействием окр.Среды.
Хим суть коррозии – окисление Ме.
Ме – zе = Меze
А) Хим коррозия – в газах и неэлектролитов
Б) Электрохим коррозия – при контакте 2-х Ме в среде электролита.
Основной ущерб наносит электрохим коррозия. Любой технический Ме содержит примеси др. Ме, и поэтому в среде электролита возникает большое кол-во микрогальванических элементов.
Их работу можно объяснить пользуясь значениями стандартных потенциалов.
Коррозия подвергает хим более активные Ме, т.е. тот Ме, Е которого меньше по алгебраическому значению.
HCl
= H+
(ок)
+
Cl-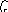

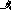
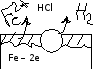
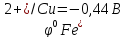 ;
;
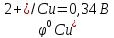
(-) Анод (Fe): Fe – 2e = Fe2+
(+) Катод (Cu): 2Н+ + 2е = Н2
[H+]↓, [Fe2+]↑ φок↓ φвосст↑
Е = φок – φвосст↓ - Поляризация – Е < 0
Обратное явл наз Деполяризацией
Частицы среды разряжающиеся на катоде наз деполяризаторами (H+)
Деполяризаторами м.б. разные окислители, но на практике чаще встречаются с кислородной и водородной деполяризацией, т.к. это самые доступные в природе окислители, т.к. О2 содержится в воздухе, а Н+ в Н2О и её растворах.
Если О2 присутствует, то коррозия всегда идет с кислородной деполяризацией, т.к. независимо от характера среды, кислород более сильный окислитель, чем водород (по табл).
В зависимости от характера среды и природы деполяризатора на катоде, т.е менее активные Ме, идут след реакции:
- коррозия с водородной деполяризацией
рН < 7 (кисл среда) : 2Н+ + 2e = H2
pH ≥ 7 (нейтр/щел среда) : 2Н2О + 2е = Н2 +2ОН-
- коррозия с кислородной деполяризацией
рН < 7: О2 + 4e + 4H+ = 2H2O
pH ≥ 7: О2 + 4е + 2H2O = 4ОН-
Защита Ме от коррозии: Защитные покрытия неМе (краски, лаки, резина, пластмасса), Ме (анодные)
12. Электро́лиз — окислительно-восстановительный процесс, который происходит на электродах во время прохождения электрического тока через расплав или раствор.
Электролиз - это ещё один способ получения чистых металлов и неметаллов. Кроме того, электролиз можно провести и в домашних условиях. Нужен источник тока, два электрода и, конечно, электролит. Электролит - это раствор, который проводит электрический ток.
Различают электролиз растворов и электролиз расплавов. Оба эти процесса существенно отливчаются друг от друга. Отличие - в наличии растворителя. При электрролизе растворов кроме ионов самого вещества в процессе учавствуют ионы растворителя. При электролизе расплавов - только ионы самого вещества. Для того, чтобы получить нужный продукт (газ, металл или неметалл), нужно правильно выбрать электрод и раствор электролита.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создается электродами — проводниками, соединёнными с полюсами источника электрической энергии. Анодом при электролизе называется положительный электрод, катодом — отрицательный. Положительные ионы — катионы — (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы — (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
1 закон Фарадея
Масса
M вещества, выделившегося на электроде,
прямо пропорциональна электрическому
заряду q, прошедшему через электролит:
![]() если
через электролит пропускается в течение
времени t постоянный ток с силой тока
I. Коэффициент
пропорциональности
если
через электролит пропускается в течение
времени t постоянный ток с силой тока
I. Коэффициент
пропорциональности ![]() называется электрохимическим
эквивалентом вещества.
Он численно равен массе вещества,
выделившегося при прохождении через
электролит единичного электрического
заряда, и зависит от химической природы
вещества.
называется электрохимическим
эквивалентом вещества.
Он численно равен массе вещества,
выделившегося при прохождении через
электролит единичного электрического
заряда, и зависит от химической природы
вещества.
![]()
2 закон Фарадея записывается в следующем виде:
![]()
где ![]() — молярная
масса данного вещества,
образовавшегося (однако не обязательно
выделившегося — оно могло и вступить
в какую-либо реакцию сразу после
образования) в результате
электролиза, г/моль;
— молярная
масса данного вещества,
образовавшегося (однако не обязательно
выделившегося — оно могло и вступить
в какую-либо реакцию сразу после
образования) в результате
электролиза, г/моль; ![]() — сила
тока, пропущенного через вещество
или смесь веществ (раствор, расплав), А;
— сила
тока, пропущенного через вещество
или смесь веществ (раствор, расплав), А; ![]() —
время, в течение которого проводился
электролиз, с;
—
время, в течение которого проводился
электролиз, с; ![]() — постоянная
Фарадея, Кл·моль−1;
— постоянная
Фарадея, Кл·моль−1; ![]() —
число участвующих в процессе электронов,
которое при достаточно больших значениях
силы тока равно абсолютной величине
заряда иона (и его противоиона), принявшего
непосредственное участие в электролизе
(окисленного или восстановленного).
—
число участвующих в процессе электронов,
которое при достаточно больших значениях
силы тока равно абсолютной величине
заряда иона (и его противоиона), принявшего
непосредственное участие в электролизе
(окисленного или восстановленного).
13. В химическом отношении железо, кобальт и никель относятся к металлам средней активности. В электрохимическом ряду напряжений металлов они располагаются левее водорода, между цинком и оловом. Чистые металлы при комнатной температуре довольно устойчивы, их активность сильно увеличивается при нагревании, особенно если они находятся в мелкодисперсном состоянии. Наличие примесей значительно снижает устойчивость металлов.
