
Азот
.pdf
скую связь по донорно-акцепторному механизму за счет неподеленной элек-
тронной пары атома N.
Ni2+ + 6NH3 = [Ni(NH3)6]2+
Если катион металла образует с аммиаком прочные комплексы, то при
действии избытка аммиака на осадок гидроксида металла или на его оксид происходит их растворение.
Cu(OH)2 (т.) + 4NH3 = [Cu(NH3)4](OH)2 (р.)
Подобные реакции иногда используют в металлургии для перевода в рас-
твор оксидных минералов некоторых металлов, в частности, оксидов Cu.
CuO(т.) + 4NH3 + H2O = [Cu(NH3)4](OH)2 (р.)
Cu2O(т.) + 4NH3 + H2O =2 [Cu(NH3)4](OH)2 (р.)
Амминые комплексы разрушаются под действием киcлот из-за вы-
соких акцепторных свойств NH3.
[Cu(NH3)4](OH)2 + 3H2SO4 = CuSO4 + 2(NH4)2SO4 + 2H2O
Реакции присоединения, в которых NH3 выступает как донор электрон-
ной пары, рассмотренные выше, относятся к самым распространенным реакци-
ям, характерным для аммиака. Меньше распространены реакции замещения
H в молекуле NH3 на другие элементы – металлы и галогены. Степень окисле-
ния N, при этом, не изменяется, так как N – третий по электроотрицательности
элемент.
Аммиак при нагревании и жидкий аммиак взаимодействует со щелочны-
ми металлами, а также металлами IIА -группы, |
образуя амиды – соединения, |
|||||||||||||||||
содержащие анион NH2–, например, NaNH2, Ca(NH2)2. |
||||||||||||||||||
|
|
2NH3 + 2Na = 2NaNH2 + H2 |
||||||||||||||||
Амиды находит применение в органических синтезах. В водных раство- |
||||||||||||||||||
рах амиды полностью гидролизуются. |
|
|
|
|
|
|
|
|
||||||||||
|
NaNH2 + Н––ОН = NH3 + NaOH. |
|||||||||||||||||
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
2 |
7 |
1 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

При замещении в двух атомов H образуются имиды – соединения, со-
держащие имино-группу (= NH).
Нитриды можно рассматривать как продукт замещения трех атомов H в
аммиаке. Многие нитриды получаются при прокаливании металла в аммиаке. 2Аl+2NH3 = 2AlN + ЗН2
Реакции, в которых водород замещается на металл, являются ОВР, –
окислительные свойства проявляет водород из молекулы NH3.
Существует большое число органических соединений – аминов, типа
RNH2 , R2NH, R3N, которые можно рассматривать как продукты замещения Н в молекуле NH3 на органический радикал.
Продукты замещения Н в аммиаке на галоген – хлористый и иоди-
стый азот. Хлористый азот NCl3 , маслянистая желтая жидкость, образующая-
ся при действии Cl2 на концентрированный раствор NH4Cl: NH4Cl + 3Cl2 = 4HCl + NCl3.
При нагревании выше 90°С (или ударе) NCl3 с сильным взрывом распа-
дается на простые вещества. При действии концентрированного аммиака на I2
образуется темно-коричневый осадок так называемого йодистого азота NI3 . nNH3. Йодистый азот крайне неустойчив и в сухом виде взрывается от ма-
лейшего прикосновения.
Хлорамин NH2Cl – сильный окислитель.
Аммиак вступает в окислительно-восстановительные реакции, в
которых азот повышает степень окисления, т. е. аммиак проявляет вос-
становительные свойства. Аммиак способен восстанавливать оксиды неко-
торых металлов.
3CuO + 2NH3 = 3Cu + N2 + 3H2O
При добавлении аммиака к бромной воде происходит ее обесцвечивание.
6NH3 + 3Br2 = N2 + 6NH4Br
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

При взаимодействии водного раствора аммиака с NaClO получают гидразин N2H4:
2NH3 + NaClO = N2H4 + NaCl + H2O
Газ NH3 воспламеняется в атмосфере F2 и Cl2, горит в чистом кислороде.
2NH3 + 3Сl2 = N2 + 6HCl
4NH3 + 3O2 = 2N2 + 6H2O
Каталитически (на платине) NH3 окисляется до NO. 4NH3 + 5O2 = 4NO + 6H2O
Эта реакция лежит в основе промышленного способа получения азотной кислоты.
Общая схема превращения аммиака в азотную кислоту может быть
представлена так:
|
|
+O2 |
|
+O2 |
|
+ O2 + H2O |
|
|
NH3 |
|
NO |
|
NO2 |
|
HNO3 |
|
|
[Pt] |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Азотная кислота и нитраты
Чистая азотная кислота HNO3 – бесцветная жидкость с плотностью 1,50
г/см3. При температуре - 42оС она застывает в прозрачную кристаллическую массу, а при 84оС кипит. С водой HNO3 смешивается в любых отношениях. В
качестве концентрированной азотной кислоты обычно используют 68% рас-
твор с плотностью 1,40 г/см3.
Азотная кислота под влиянием света медленно разлагается
4HNO3 = 4NO2 + O2 + 2H2O.
Чем выше температура и чем концентрированнее кислота, тем быстрее идет разложение. Выделяющийся диоксид азота растворяется в кислоте и при-
дает ей бурую окраску.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Азотная кислота принадлежит к числу наиболее сильных кислот. В
разбавленных растворах она полностью распадается на ионы. Азотная кислота вступает в реакции, характерные для кислот, т.е. реагирует с акцепторами про-
тонов: основными оксидами и гидроксидами, солями слабых кислот и т. п., но
наиболее характерны для азотной кислоты окислительно-
восстановительные реакции.
Азотная кислота – сильный окислитель. Присоединение Н+ к аниону
NO3– способствует разрыву связи N––O, поэтому, чем выше концентрация
HNO3, тем быстрее идет ее восстановление.
Многие неметаллы легко окисляются концентрированной азотной кислотой до высших степеней окисления. Например:
S +2HNO3 = H2SO4 + 2NO,
3P +5 HNO3 + 2 H2O= 3H3PO4 + 5 NO,
3C + 4 HNO3 = 3CO2 + 4 NO + 2 H2O.
Большинство металлов растворяются в азотной кислоте с образова-
нием нитратов.
Устойчивы к окислению концентрированной азотной кислотой такие ме-
таллы, как: Au, Pt, Rh, Os, Ir, Ta, Nb, W.
Некоторые металлы, например Fe, Al, Cr, пассивируются концентриро-
ванной азотной кислотой (по-видимому, в результате образования труднорас-
творимых оксидных пленок).
Важно отметить, что при взаимодействии металлов с НNO3 крайне редко выделяется H2. Это указывает на то, что металл окисляется не H+-ионами, а бо-
лее сильным окислителем NO3–. Возможно, что если водород и образуется, то он расходуется на восстановление ионов NO3–. При окислении металлов азот-
ной кислотой, как правило, идет несколько параллельных реакций, и образуется смесь продуктов ее восстановления. Относительное содержание их в смеси за-
висит от восстановительной активности металла, температуры и концентрации
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

кислоты. Концентрированная кислота обычно восстанавливается металлами до
NO2.
HNO3 (конц.) + Me NO2 + нитрат металла Разбавленная кислота реагирует по более сложной схеме:
HNO3 (разб.) + Me NO, N2O, N2, NH4+ + нитрат металла
При взаимодействии разбавленной азотной кислоты с металлами чаще всего среди продуктов восстановления преобладает NO.
HNO3 (разб.) + Me NO + нитрат металла
Сильно разбавленная кислота взаимодействует с очень активными ме-
таллами с образованием NH4+.
В присутствии веществ, способных к образованию комплексов металлов,
азотная кислота может окислять и те металлы, которые одной HNO3 не окисля-
ются. Так, например, смесь одного объема азотной и трех объемов концен-
трированной соляной кислоты – "царская водка"- окисляет даже золото и платину:
Au + HNO3 + 4 HCl = H[AuCl4] + NO + 2 H2O
3Pt + 4HNO3 + 18 HCl = 3 H2[PtCl6] + 4NO + 8 H2O
Азотная кислота действует как окислитель на многие органические веще-
ства. При этом один или несколько атомов водорода в органическом соедине-
нии замещаются нитрогруппами (–NO2). Этот процесс называется нитрованием
(в качестве нитрующего агента используют смесь концентрированных кислот
HNO3 и H2SO4). Продуктами нитрования являются широко известные
взрывчатые вещества: нитроглицерин (динамит), тринитротолуол (тол) и
др.
Отнимая воду от азотной кислоты, получают ее ангидрид N2O5.
2HNO3 = N2O5 + H2O.
В качестве водоотнимающего средства используют оксид P4O10.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Нитраты – соли азотной кислоты. Они хорошо растворяются в воде.
В водных растворах нитраты не проявляют сильных окислительных свойств,
но при высоких температурах они становятся энергичными окислителями, так как разлагаются с выделением кислорода по одной из следующих схем:
2KNO3 = 2KNO2 + O2 (соли большинства щелочных и щелочно-земельных ме-
таллов).
2Cu(NO3)2 = 4NO2 + O2 + 2CuO (соли большинства переходных металлов) 2AgNO3 = 2NO2 + O2 + 2Ag (при неустойчивых оксидах металлов)
Растворимые нитраты используются в качестве удобрений, но если в почве имеется их избыток, то они переходят в плоды в таком количестве, что ими можно даже отравиться, так как нитраты в организме восстанавливаются до более ядовитых нитрозаминов R2N––N=O.
В природе в небольших количествах встречаются соли KNO3 и NaNO3,
называемые селитрами. Латинское название элемента N– «nitrogenium» пере-
водится, как «рождающий селитру», или «рожденный из селитры». Очень ма-
ленькие природные запасы селитры, необходимой, прежде всего, для произ-
водства пороха, толкали ученых к поиску метода, позволяющего атмосферный водород преобразовывать в азотную кислоту. Первым промышленный процесс связывания атмосферного азота в NH3 разработал немецкий химик Габер пе-
ред первой мировой войной.
Оксиды азота
В оксидах азот проявляет положительные степени окисления, так как он связан с более электроотрицательным элементом.
+1 |
+2 |
+3 |
+4 |
+5 |
N2O, NO, |
N2O3, |
NO2, N2O5 |
||
Все эти оксиды (кроме N2O5) – эндотермические соединения. Это зна-
чит, что их образование из прочных молекул N2 и O2 требует затрат энергии.
Непосредственное образование этих оксидов из азота и кислорода невоз-
можно. Единственный оксид, который в природе в небольших количествах об-
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

разуется из простых веществ – NO. Это происходит при грозовых разрядах.
Все оксиды азота можно получить косвенными методами. Некоторые из окси-
дов являются довольно прочными соединениями. Это обусловлено наличием в
их молекулах прочных кратных связей: |
N=O и N=N. |
||
|
|
газ со слабым приятным запахом, об- |
|
|
Оксид диазота N2O |
– бесцветный |
|
ладает наркотическим действием, – раньше использовался в медицине для ане-
стезии.
Ему часто приписывают структуры: 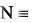
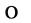 или N = N = O.
или N = N = O.
Его можно получить осторожным нагреванием нитрата аммония. NH4NO3 = N2O + 2H2O.
Оксид диазота является сильным, но кинетически инертным окис-
лителем. При нагревании он разлагается: 2N2O = 2N2 + O2. Смесь N2O и NH3
при воспламенении взрывается.
3N2O + 2NH3 = 4 N2 + 3H2O
Оксид N2O не может быть непосредственно окислен до других оксидов
азота.
Оксид NO – бесцветный газ, нерастворимый в воде. В промышленности его получают при каталитическом окислении аммиака (первая стадия получе-
ния HNO3.) В лаборатории получают взимодействием меди с разбавленной азотной кислотой.
Молекула NO интересна тем, что содержит один неспаренный электрон.
. ..
:N = O:
Оксид NO – реакционноспособное соединение. На воздухе он очень бы-
стро превращается в бурый газ NO2.
2NO + O2 = 2NO2.
Моноксид проявляет также окислительные свойства, реагирует с H2S, SO2.
2NO +2H2S = N2 +2S;
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

2NO + SO2 + H2O = N2O + H2SO4.
Оксид NO2 (бурый газ) очень ядовит. В его молекуле, как и в NO, име-
ется один неспаренный электрон.
O
N 
O
Благодаря неспаренным электронам две молекулы NO2 легко объединя-
ются в бесцветный димер N2O4
2NO2 N2O4; К = 0,115 при 25оС
При комнатной температуре оксиды NO2 и N2O4 находятся в равновесии.
С повышением температуры равновесная смесь обогащается продуктом эндо-
термической реакции, т.е. NO2. При понижении температуры смесь обесцвечи-
вается, так как бурый газ NO2 превращается в бесцветный димер. Димер при температуре ниже +21оС переходит в желтую жидкость, а при температуре ни-
же –11оС – в бесцветные кристаллы.
Оксид NO2 – сильный окислитель. В атмосфере NO2 горят графит, бе-
лый фосфор и сера, при смешении газов NO2 и HI возникает фиолетовое пламя.
2NO + 8HI = N2 +4I2 +4H2O
2NO2 + 2C = N2 +2CO2
При растворении в воде N2O диспропорционирует с образованием
двух кислот – азотной и азотистой |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
+4 |
|
|
+3 |
|
+5 |
|
|
|
|
|||||||
|
|
|
|
|
2NO2 + H2O = HNO2 + HNO3 |
|||||||||||||||
|
|
(азотистый ангидрид) нестойкое соединение, образуется |
||||||||||||||||||
|
Оксид N2O3 |
|
||||||||||||||||||
при низких температурах при соединении оксидов NO и NO2, молекулы кото- |
||||||||||||||||||||
рых имеют неспаренные электроны |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
NO + |
NO2 N2O3. |
|
|
|
|
|
|
||||||||
|
Оксид N2O3 |
существует при температуре ниже – 40оС в виде синей жид- |
||||||||||||||||||
кости, которая при нагревании начинает разлагаться по реакции: |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Исполнитель: |
|
|
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

N2O3 NO + NO2
Растворяясь в воде, этот оксид образует слабую азотистую кислоту HNO2
(К= 5.10-4).
Азотистая кислота – нестойкая и существует только в разбавленных растворах. С повышением концентрации легко подвергается диспропорциони-
рованию
+3 +5 +2
3HNO2 = HNO3 + 2NO +H2O
В щелочной среде образуются соли азотистой кислоты – нитриты.
Нитриты вполне устойчивые соединения, хорошо растворимые в воде.
В реакциях нитриты проявляют как окислительные, так и восстано-
вительные свойства. Для азотистой кислоты более характерны окислитель-
ные свойства с восстановлением до NO.
Оксид N2O5 (азотный ангидрид) – неустойчивое бесцветное кристал-
лическое вещество, которое возгоняется при 3 оС и при этом разлагается на
азот и кислород.
2N2O5 =4NO2 +O2
Втвердом виде состоит из ионов NO2+ и NO3–.
Вводе азотный ангидрид хорошо растворяется с образованием азотной кислоты.
Азотный ангидрид очень сильный окислитель. Многие органические вещества при соприкосновении с ним воспламеняются, металлы переходят в оксиды, H2S и SO2 окисляются до серной кислоты.
2N2O5 + 2H2S = 2N2 + O2+ 2 H2SO4
В промышленности N2O5 получают окислением жидкого оксида N2O4
озонированным кислородом:
N2O4 (ж.) + O3 = N2O5 (ж.) + O2
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

В лаборатории получают, отнимая воду от азотной кислоты с помощью
P4O10.
Другие соединения азота
Такие соединения азота, как гидразин N2H4 и гидроксиламин NH2OH
можно рассматривать как производные аммиака, в которых один атом Н заме-
щен, соответственно, на группу – NH2 или – ОН.
Гидразин N2H4 - бесцветная жидкость, с неприятным запахом, ядовит,
взрывчат; кипит при 113,6оС. В гидразине N проявляет степень окисления (–2).
Структурная формула гидразина имеет вид:
H H
 N = N
N = N 
H H
Гидразин является донором электронных пар. Подобно аммиаку гидра-
зин хорошо растворяется в воде и акцептирует Н+, образуя соединения гидра-
зония: гидразин–гидрат N2H5OH (N2H4 . H2O) , хлористый гидразин N2H5Cl (N2H4 . HCl) и гидросульфат N2H5(HSO4). Большинство солей гидразония рас-
творимы в воде.
Также подобно аммиаку гидразин способен образовывать комплексы с катионами некоторых d-металлов.
Гидразин менее устойчив и является более слабым основанием, чем ам-
миак.
Гидразин - сильный восстановитель. Восстановительные свойства сильнее проявляются в щелочных растворах. В водном растворе он чаще всего
окисляется до N2.
Гидразин горит на воздухе: N2H4 + O2 = N2 + 2H2O. При горении гидра-
зина на воздухе или в кислороде выделяется большое количество тепла, поэто-
му гидразин или его органические производные, например, 1,1– диметилгидра-
зин (CH3)2N––NH2 (гептил) |
используется как компонент ракетного топлива, |
|||||||||||||||||
другим компонентом (окислителем) может выступать N2O4. |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Исполнитель: |
|
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
