
Кислород
.pdf
Модуль V
Химия неметаллов
Лекция 1. Основные вопросы, рассматриваемые в лекции
Кислород
Элемент кислород занимает особое место среди всех химических
элементов. Берцелиус отмечал: "Кислород является центром, вокруг
которого вращается вся химия".
При обсуждении химии любого элемента особое внимание уделяют его соединениям с кислородом.
Кислород является элементом VIА-подгруппы. Химия неметаллов этой подгруппы рассматривается в отдельной лекции №2. А химии кислорода посвящена первая лекция модуля «Химия элементов».
В лекции рассматриваются:
 Причины особой роли кислорода в химии и характеристики кислородного атома.
Причины особой роли кислорода в химии и характеристики кислородного атома.
 Строение молекулы дикислорода обсуждается с точки зрения метода молекулярных орбиталей.
Строение молекулы дикислорода обсуждается с точки зрения метода молекулярных орбиталей.
Подробно рассматриваются свойства простых веществ кислорода.
 Среди соединений кислорода особое внимание уделено важнейшему классу неорганических соединений – оксидам. Рассматривается классификация оксидов по типу химической связи и кислотно-основным свойствам.
Среди соединений кислорода особое внимание уделено важнейшему классу неорганических соединений – оксидам. Рассматривается классификация оксидов по типу химической связи и кислотно-основным свойствам.
 Обсуждаются окислительные свойства пероксидов, супероксидов и озонидов.
Обсуждаются окислительные свойства пероксидов, супероксидов и озонидов.
Исполнитель: |
|
Да |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
та: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Кислород
8 |
O |
Кислород занимает особое место среди других |
|||
|
|||||
|
химических |
элементов. |
Как отмечал |
Берцелиус: |
|
кислород |
"Кислород |
является |
центром, вокруг |
которого |
|
2s22p4 |
|
||||
|
вращается вся химия". |
|
|
||
15,999 |
|
|
|
||
|
|
|
|
|
|
|
|
Большая часть неорганической химии посвящена |
|||
|
|
||||
кислородсодержащим соединениям элементов.
Кислород образует соединения почти со всеми другими элементами,
кроме Не, Nе, Ar, Kr.
Высшие оксиды часто рассматривают, как характеристические
соединения элементов, и Д.И. Менделеев, помещая элемент в определенную группу периодической таблицы, ориентировался в первую на состав и свойства его высшего оксида.
Кислород – самый распространенный на Земле элемент. Наружный слой Земли, называемый Земной корой, образован соединениями кислорода с другими элементами, главным образом с кремнием и алюминием. Масса
атомов кислорода составляет почти 50% всей массы Земной коры. На долю
кислорода приходится 89% массы мирового океана. В атмосфере кислород содержится в виде двухатомных молекул О2. Массовый % кислорода в воздухе равен 23. В человеческом теле массовая доля кислорода превышает 50%.
Многие элементы в природе находятся в виде кислородсодержащих соединений, в том числе и важнейшие металлы – железо и алюминий. Всего известно более 1400 кислородсодержащих минералов. Важнейшее соединение кислорода – вода, она играет особую роль в жизни и в химических процессах;
водные растворы являются наилучшей средой для химических реакций.
Кроме того, что элемент O входит в состав множества окружающих нас веществ, кислород играет также особую роль в производстве
Исполнитель: |
|
Да |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
та: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

энергии. Основную часть энергии человечество получает за счет сжигания
(окисления кислородом воздуха) природного газа, нефти, угля. Часть полученного тепла преобразуют в другие виды энергии, например,
электрическую. За счет дыхания каждый человек обеспечивает себя необходимой жизненной энергией, – пока мы дышим, мы существуем.
Из-за особой роли кислорода целесообразно начать изучение химии элементов именно с кислорода.
Характеристики атома и характерные степени окисления |
|||||
|
Кислород – |
это p-элемент 6А-подгруппы. Электронная формула |
|||
2s |
|
2p |
|
атома О: 1s22s22p4. Атому кислорода не хватает всего |
|
|
|
|
|
||
|
|
|
|
двух электронов для создания устойчивой |
|
|
|
|
|
восьмиэлектронной оболочки. У кислородного атома |
|
всего два электронных слоя, и поэтому маленький орбитальный радиус |
(0,045 |
||||
нм). Эти особенности электронного строения делают кислород очень |
|||||
электроотрицательным элементом. Электроотрицательность кислорода |
|||||
равна 3,4, |
только фтор имеет большую электроотрицательность. |
|
|||
|
Наиболее устойчивой и самой распространенной степенью |
||||
окисления кислорода является (–2), кроме того, кислород проявляет степени |
|||||
окисления: |
-1, +1, |
+2. |
Положительные степени окисления проявляются только |
||
в соединениях с фтором: OF, OF2. |
|
||||
Простое вещество
Известны две модификации: дикислород О2, который мы называем просто "кислород", и озон О3. Кислород находится в воздухе в виде молекул О2. Мольная доля молекул О2 в воздухе составляет 21 %.
На расстоянии ~ 25 км от поверхности Земли существует так называемый озоновый слой. Озон образуется за счет поглощения молекулами кислорода ультрафиолетового излучения Солнца по эндотермической реакции:
Исполнитель: |
|
Да |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
та: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

3О2(г.) = 2О3(г.); Hо = 284 кДж/моль
Значение озонового слоя очень велико – он ослабляет поток ультрафиолетовых лучей, губительных для живых организмов.
Строение молекулы О2
Учитывая, что атом кислорода имеет два неспаренных электрона, можно предположить, что два атома кислорода могут объединяться между собой с образованием двухатомной молекулы со структурной формулой О=О.
Обсуждая химическую связь в молекуле О2, надо учитывать два факта:
связь в молекуле прочная, энергия связи равна 499 кДж/моль, и молекула О2
проявляет особые магнитные свойства, заставляющие ее втягиваться в магнитное поле. Такое свойство, называемое парамагнетизмом, проявляют молекулы, имеющие неспаренные электроны. Парамагнетизм О2 даже используют для аналитического обнаружения кислорода.
Наилучшим образом химическую связь в молекуле О2 объясняет метод молекулярных орбиталей. Два атома кислорода, сближаясь на
короткое межъядерное расстояние, преобразуют свои атомные орбитали в молекулярные. Молекулярные орбитали принадлежат сразу двум атомам, а
электроны, которые на них находятся, испытывают влияние двух ядер. Число
образовавшихся молекулярных орбиталей равно числу атомных орбиталей,
принимавших участие в их образовании. Таким образом, из восьми валентных атомных орбиталей, принадлежащих двум атомам кислорода, возникает восемь молекулярных орбиталей.
Половина молекулярных орбиталей будет иметь энергию более низкую,
чем исходные атомные орбитали. Эти орбитали называют связывающими.
Располагающиеся на них электроны находятся преимущественно в пространстве между ядрами. Другая половина молекулярных орбиталей имеет
энергию более высокую, чем исходные атомные орбитали. Их называют
разрыхляющими. |
Располагающиеся на |
|
них электроны |
находятся |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Исполнитель: |
|
|
Да |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
|
4 |
2 |
7 |
1 |
|
|
|
|
та: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
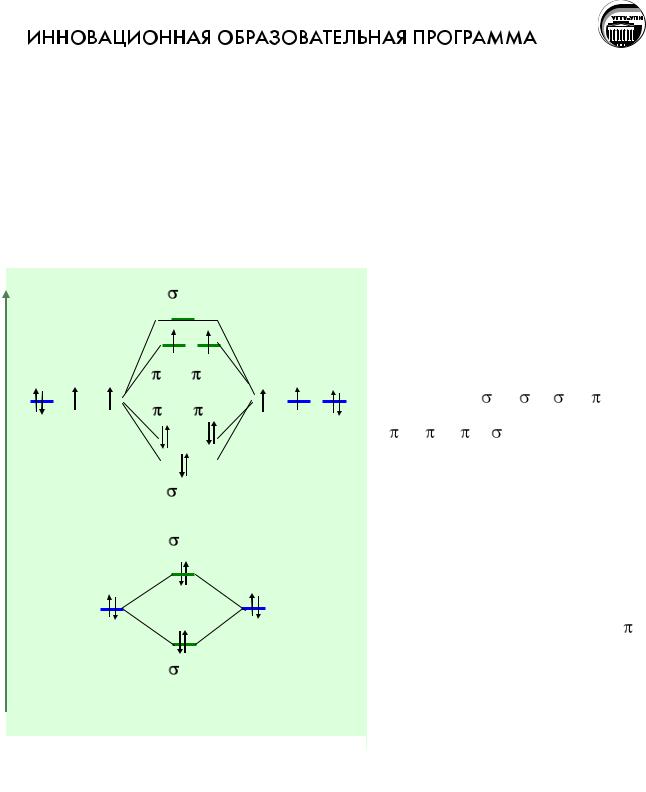
преимущественно в пространстве за ядрами. На молекулярных орбиталях размещаются 12 валентных электронов – по шесть от каждого кислородного атома. Электроны занимают молекулярные орбитали в соответствии с теми же принципами, по которым заполняются орбитали в атомах, а именно:
принципом наименьших энергий,
принципом Паули, правилом Гунда.
хр.
Е
2p |
р. |
|
р. |
2p |
|||||||
|
|
|
|
|
|
|
|||||
|
|
|
|
y |
|
z |
|
|
|||
|
|
|
|
св. |
|
св. |
|
|
|||
|
|
|
|
|
|
||||||
|
|
|
|
y |
|
z |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
св. x .
р. s
2s |
2s |
св. s
АО МО АО
Рис. Распределение электронов по молекулярным орбиталям в молекуле O2.
О2 происходит выигрыш энергии,
двойной связи.
На представленной
диаграмме показано распределение по энергии
восьми молекулярных
орбиталей: |
sсв., sр., xсв, |
yсв, |
zсв, yр., zр, |
xр., а также |
|
распределение электронов по молекулярным орбиталям
Из этой диаграммы
видно, что молекула О2 имеет два неспаренных электрона, они находятся на разрыхляющих -
орбиталях, на связывающих орбиталях находится на две электронных пары больше, чем на разрыхляющих, а это значит,
что при образовании молекулы отвечающий образованию
Исполнитель: |
|
Да |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
та: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Свойства кислорода
Кислород – бесцветный газ без запаха и вкуса, в воде растворяется в
ограниченном количестве (~ 0,001 моль/л). Маленькие молекулы О2 связаны между собой слабыми межмолекулярными связями и при обычных условиях
существуют как отдельные молекулы в газовой фазе. Требуются очень низкие
температуры и большие давления для того, чтобы превратить кислород в жидкость. Жидкий кислород имеет голубоватую окраску.
Кислород в промышленности получают фракционной перегонкой жидкого воздуха. Температура кипения О2 равна –183 оС, а температура кипения азота равна –196 оС. Таким образом, из сжиженного воздуха первым в газ переходит азот, имеющий межмолекулярные связи еще более слабые, чем
кислород. В мире ежегодно получают ~ 80 млн. т кислорода.
В лаборатории небольшие количества кислорода получают термическим
разложением солей или пероксида водорода: |
|
|
|
|
|
2KMnO4 O2 + K2MnO4 |
+ MnO2 |
|
|||
2KClO3 |
3O2 + 2KCl |
|
|
|
|
2KNO3 |
3O2 + 2KNO2 |
|
|
|
|
2H2O2 |
O2 + H2O |
|
|
|
|
Термическим разложением нитрата калия в 1773 г. |
кислород впервые |
||||
получил Шееле, назвав его «огненный воздух». |
Пристли, |
получивший |
|||
кислород разложением оксидов Hg и Pb, именовал |
его «дефлогисистированый |
||||
воздух». |
|
|
|
|
|
2HgO O2 + 2Hg |
|
|
|
|
|
2Pb3O4 O2 + 6PbO |
|
|
|
||
Имя «oxygenium» т.е. «рождающий кислоты» |
(от |
греч. |
«оксис» – |
||
кислый» и «геннао» – «рождаю»), было присвоено кислороду Лавуазье,
который первым включил кислород в список новых простых веществ.
Исполнитель: |
|
Да |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
та: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Озон – светло-синий газ с характерным запахом. В переводе с греческого
озон означает "пахнущий". В небольших количествах озон образуется в
электрических разрядах при грозе, и именно он придает воздуху после грозы приятную свежесть. Но уже при концентрации О3 в воздухе больше 0, 01% он
опасен для здоровья, так |
как разрушает ткани дыхательных |
путей. |
Озон |
|
получают в озонаторах, |
пропуская |
тихий электрический |
разряд |
через |
кислород. |
|
|
|
|
Учитывая высокую электроотрицательность кислорода и устойчивость
степени окисления (-2), и О2 и О3 должны быть окислителями. И это действительно так. Озон более сильный окислитель, чем кислород. Кислород
окисляет очень большое количество самых разнообразных органических и неорганических соединений и подавляющее большинство простых веществ,
кроме галогенов, азота, благородных газов и благородных металлов.
На высоком химическом сродстве элементов к кислороду основаны важнейшие промышленные процессы.
Большинство реакций окисления веществ кислородом сопровождается выделением тепла. Реакции окисления природного газа, нефти, угля используются для получения энергии. В металлургии очень распространены пирометаллургические процессы, которые, как явствует из их названия,
протекают при высоких температурах. Горение угля создает в металлургических печах высокие температуры. Очень большое количество тепла выделяется при горении ацетилена, создавая температуру до 3000оС,
при таких температурах большинство металлов плавится, – это позволяет использовать данную реакцию для резки и сварки металлов.
На высоком сродстве элементов к кислороду основан процесс преобразования чугуна в сталь. При продувании воздуха, обогащенного
кислородом, через расплавленный чугун |
примеси |
серы, фосфора, углерода |
||||||||||||||||
выгорают в результате окисления кислородом. На 1 |
т стали расходуется почти |
|||||||||||||||||
Исполнитель: |
|
Да |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
2 |
7 |
1 |
|
|||
|
|
та: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

1 т кислорода, поэтому на металлургических комбинатах строят собственные установки для получения кислорода. На производство стали расходуется почти половина производимого промышленным способом кислорода.
Реакции окисления проводят для производства многих важных веществ.
Для получении серной кислоты обычно окисляют пирит:
4 FeS2 + 11 O2 = 2 Fe2O3 + 8 SO2,
затем SO2 окисляют до SO3:
2 SO2 + O2 = 2 SO3
Для получения азотной кислоты аммиак окисляют кислородом:
4 NH3 + 5 O2 = 4 NO + 6 H2O
Затем оксид NO окисляют до NO2:
2NO + O2 = 2NO2
В приведенных выше примерах кислород играл положительную роль в получении веществ и в производстве энергии. Но с высоким сродством металлов к кислороду связаны и нежелательные процессы. Сродство металлов к
кислороду приводит к коррозии металлов, то есть к самопроизвольному их
окислению. За счет коррозии теряется почти 15 % ежегодно получаемого металла.
|
|
4Fe + 3 O2 + n H2O = 2Fe2O3 |
. nH2O |
|
|
|
|
|
ржавчина |
|
|
Способность кислорода взаимодействовать с простыми веществами |
|||||
оценивается количественно с помощью некоторой |
характеристической |
||||
функции G, называемой функцией (энергией) Гиббса. При |
самопроизвольном |
||||
протекании химических реакций эта функция уменьшается. Чем сильнее она |
|||||
уменьшается |
при |
образовании оксида |
из простых |
веществ, т.е. чем |
|
отрицательнее |
G, |
тем прочнее оксид, |
и тем труднее из него восстановить |
||
простое вещество.
Для реакций, протекающих в водных растворах, окислительная
способность веществ оценивается величинами электродных потенциалов |
Е, – |
|||||||||||||||||
Исполнитель: |
|
Да |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
2 |
7 |
1 |
|
|||
|
|
та: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

чем положительнее значение Е, тем сильнее окислительные свойства.
Восстановление О2 |
происходит в соответствии со следующей полуреакцией: |
||||||
|
O2 + 4e– + 4 H+ = 2 H2O; |
Ео = 1,23В. |
|
|
|||
Стандартный |
электродный потенциал О2 |
указывает на |
его |
высокие |
|||
окислительные свойства. Для озона Е |
о |
значительно положительнее, озон |
|||||
|
|||||||
является очень сильным окислителем. |
|
|
|
|
|
||
|
O3 + 2e– + 2 H+ |
= O2 |
+ H2O; |
Ео = 2,07 В. |
|
|
|
Хотя кислород – сильный |
окислитель, тем не менее, |
при |
обычных |
||||
температурах реакции с его участием часто проходят медленно. В значительной мере это обусловлено высокой энергией связи в молекуле О2. Если механизм окисления требует диссоциации О2 на атомы, то такие реакции имеют высокую энергию активации. Радикальный цепной механизм позволяет отчасти обойти активационные барьеры.
Соединения кислорода
Кислородные соединения многочисленны и разнообразны. Наиболее важным классом кислородных соединений являются оксиды.
Оксиды
Оксиды чаще всего классифицируют по составу, по типу связи между элементом и кислородом и в зависимости от кислотных или основных свойств.
В зависимости от состава различают бинарные (MgO, CO2) и смешанные оксиды (MgO . Al2O3  MgAl2O4), а также оксиды стехиометрические и нестехиометрические (фазы переменного состава).
MgAl2O4), а также оксиды стехиометрические и нестехиометрические (фазы переменного состава).
Бинарные соединения элемента с кислородом, в которых кислород имеет степень окисления (-2), называют нормальными оксидами или просто оксидами По характеру химической связи между элементом и кислородом оксиды
можно разделить на две большие группы:
оксиды с преимущественно ионным характером связи (ионные оксиды);
Исполнитель: |
|
Да |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
та: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

оксиды с преимущественно ковалентным характером связи
(ковалентные оксиды).
Ионные оксиды кислород образует с металлами, т.е. с элементами,
которые сильно отличаются от него по электроотрицательности. Ионная составляющая связи тем выше, чем меньше электроотрицательность металла.
Наиболее сильно выражен ионный характер связи в оксидах щелочных и щелочно-земельных металлов. В большинстве ионных оксидов металлы проявляют невысокие степени окисления: +1, +2. С повышением степени окисления растет вклад ковалентной составляющей.
По своей структуре ионные оксиды являются координационными кристаллами. В их кристаллической решетке нет отдельных молекул, а
каждый атом (ион) металла окружен определенным числом атомов (ионов)
кислорода. Чаще всего это число равно 4, 6 или 8.
Ковалентные оксиды, т.е. оксиды с преимущественно ковалентным характером связи, образуются неметаллами, а также металлами в высоких степенях окисления. В качестве примеров можно привести: CO2, SO3, OsO4.
Для таких оксидов наиболее характерна молекулярная структура, а также полимерные структуры с атомами кислорода в виде мостиков. В обычных условиях молекулярные оксиды являются либо газами, либо легко переходящими в газ жидкостями и твердыми веществами. По мере увеличения различия в электроотрицательности между неметаллом и кислородом появляется возможность образования координационных структур, например, в
кристаллической решетке SiO2.
Наиболее важной в неорганической химии является классификация
оксидов в зависимости от их кислотных или основных свойств.
Основные оксиды.
Их обычно образуют металлы в низких степенях окисления. В таких
оксидах значителен вклад ионной составляющей химической связи.
Исполнитель: |
|
Да |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
та: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
