
- •Оглавление
- •Раздел I. Общие сведения о высокомолекулярных соединениях
- •1.1. Особенности полимерного состояния вещества Введение
- •1.1.1. Полимеры, общие определения
- •1.1.2. Различия в свойствах высоко- и низкомолекулярных соединений
- •1.2. Образование, получение и распространение полимеров
- •Содержание различных веществ в теле человека
- •Некоторые аминокислоты, входящие в состав белков
- •Содержание различных оксидов в базальтовых породах, мас. %
- •1.3. Классификация полимеров
- •1.3.1. Принципы классификации полимеров
- •Типичные конденсационные полимеры
- •Типичные полимеризационные полимеры
- •Классификация, молекулярно-массовые характеристики и стереохимия полимеров
- •1.3.2. Тривиальная, рациональная и систематическая номенклатура полимеров
- •Названия некоторых линейных полимеров
- •1.3.3. Классификация и номенклатура сополимеров
- •Названия некоторых элементорганических и неорганических полимеров
- •Название основных типов сополимеров
- •1.4. Молекулярно-массовые характеристики полимеров
- •1.4.1. Распределение макромолекул по молекулярным массам
- •1.4.2. Моменты распределения и средние молекулярные массы
- •1.4.3. Параметр полидисперсности
- •1.4.4. Методы определения молекулярной массы полимеров
- •1.5. Стереохимия полимеров
- •1.5.1. Химическая изомерия звеньев
- •1.5.3. Стереоизомерия
- •Температуры кристаллизации и плавления полидиенов
- •Вопросы и упражнения к лекциям 1-2
- •Раздел II. Синтез полимеров методами цепной и ступенчатой полимеризации
- •2.1. Радикальная полимеризации
- •2.1.1. Инициирование радикальной полимеризации
- •Важнейшие инициаторы радикальной полимеризации
- •2.1.2. Элементарные реакции и кинетика полимеризации
- •1. Инициирование.
- •2. Рост цепи.
- •3. Обрыв цепи.
- •Вклад диспропорционирования в реакциях обрыва (λ) для различных мономеров
- •Относительные константы передачи цепи на инициатор Син при 60ºС
- •Относительные константы передачи цепи на мономер См
- •Значения относительных констант передачи цепи Сs·104 на некоторые соединения при 60-70ºС
- •Значения относительных констант передачи цепи на полимер Ср
- •Ингибиторы радикальной полимеризации.
- •Константы ингибирования Сz, 50-60ºС
- •Константы скоростей элементарных реакций роста и обрыва при радикальной полимеризации некоторых мономеров, 20-25ºС
- •2.1.3. Молекулярно-массовое распределение при радикальной полимеризации
- •2.1.4. Влияние температуры и давления на радикальную полимеризацию
- •2.1.5. Диффузионная модель обрыва цепи. Гель-эффект
- •Влияние степени превращения мономера q на полимеризацию метилметакрилата, 22,5ºС
- •2.1.6. Каталитическая передача цепи
- •2.1.7. Псевдоживая радикальная полимеризация
- •Константы обратимого ингибирования псевдоживой полимеризации стирола в присутствии темпо
- •2.1.8. Эмульсионная полимеризация
- •Эмульсионная полимеризация смеси стирола и бутадиена
- •Вопросы и упражнения к лекциям 3-5
- •2.2. Катионная полимеризация
- •2.2.1. Элементарные реакции. Кинетика
- •Константы скорости роста в катионной полимеризации
- •Константы передачи цепи на мономер при катионной полимеризации стирола
- •Константы передачи цепи на мономер при катионной полимеризации изобутилена в различных растворителях
- •Контсанты передачи цепи при катионной полимеризации стирола
- •2.2.2. Псевдокатионная и псевдоживая катионная полимеризация
- •2.2.3. Влияние реакционной среды
- •Влияние растворителя на катионную полимеризацию стирола, инициированную hClO4
- •2.3. Анионная полимеризация
- •2.3.1. Основные реакции инициирования
- •2.3.2. Кинетика анионной полимеризации с обрывом цепи
- •2.3.3. Живая полимеризация. Блок-сополимеры
- •2.3.4. Полимеризация с переносом группы
- •2.3.5. Влияние температуры, растворителя и противоиона
- •Влияние растворителя на анионную «живую» полимеризацию стирола, 25ºС, натрий-нафталиновый комплекс 3·10-3 моль/л
- •Кинетические и термодинамические характеристики реакции роста цепи при живой полимеризации стирола, инициируемой натрий-нафталином, 20ºС, тетрагидрофуран
- •2.3.6. Ассоциация
- •2.4. Ионно-координационная полимеризация
- •Примеры стереоспецифической полимеризации
- •2.4.1. Катализаторы Циглера-Натта. Исторический аспект
- •Компоненты катализаторов Циглера-Натта
- •2.4.2. Полимеризация на гетерогенных катализаторах Циглера-Натта
- •Влияние растворителя на анионную полимеризацию 1,3-диенов, инициируемую н-бутиллитием
- •2.5. Синтез гетероцепных полимеров ионной полимеризацией
- •2.5.1. Карбонилсодержащие соединения
- •Предельные температуры и концентрации мономеров при полимеризации альдегидов
- •2.5.2. Полимеризация эфиров и эпоксидов с раскрытием цикла
- •2.5.3. Полимеризация лактамов и лактонов
- •2.5.4. Другие гетероциклы
- •2.6. Общие вопросы синтеза полимеров
- •2.6.1. Термодинамика синтеза
- •Энтальпии и энтропии полимеризации некоторых мономеров, 25ºС
- •Энтальпии δн0, энтропии δs0, функции Гиббса δg0 и предельные температуры полимеризации Тп альдегидов, 25ºС
- •Энтальпии δн0, энтропии δs0, функции Гиббса δg0 полимеризации циклоалканов при 25ºС
- •2.6.2. Сопоставление ионной и радикальной полимеризации
- •2.6.3. Об общности процессов псевдоживой полимеризации
- •2.7. Ступенчатая полимеризация
- •2.7.1. Равновесная и неравновесная поликонденсация
- •Влияние константы равновесия к на степень завершенности реакции поликонденсации х и среднечисловую степень полимеризации
- •Влияние воды на степень полимеризации при поликонденсации
- •2.7.2. Кинетика поликонденсации
- •Константы скорости реакции этерификации в гомолитических рядах одно- и двухосновных кислот, 25ºС
- •2.7.3. Молекулярно-массовое распределение полимера при поликонденсации
- •2.7.4. Разветвленные и сшитые полимеры
- •2.7.5. Фенопласты, аминопласты
- •2.7.6. Полиамиды, полиэфиры, поликарбонаты
- •2.7.7. Полиуретаны. Полисилоксаны
- •2.7.8. Жесткоцепные ароматические полимеры
- •Свойства полиариленэфирсульфонов
- •2.7.9. Сверхразветвленные полимеры
- •Очистка — б — очистка — а — очистка и т. Д.
- •Вопросы и упражнения к лекциям 9-10
- •Раздел 3. Цепная сополимеризация
- •3.1. Количественная теория сополимеризации
- •3.1.1. Кривые состава сополимера и относительные активности мономеров
- •3.1.2. Состав и микроструктура сополимера. Статистический подход
- •Доля последовательностей различной длины из мономера 1 (q1n) в эквимолярных сополимерах различных типов
- •3.1.3. Многокомпонентная сополимеризация
- •Предсказанные и определенные экспериментально составы сополимеров, полученных радикальной тер- и тетраполимеризацией
- •3.1.4. Сополимеризации до глубоких конверсии
- •3.2. Радикальная сополимеризация
- •3.2.1. Скорость сополимеризации
- •Корреляция между и r1 · r2 при радикальной сополимеризации
- •3.2.2. Природа эффекта предконцевого звена
- •Относительные активности мономеров при сополимеризации стирола (1) с акрилонитрилом (2), определенные в рамках моделей концевого и предконцевого звена, 60°с
- •3.2.3. Влияние температуры и давления на радикальную сополимеризацию
- •Значения относительных активностей мономеров при разных температурах и отношения частотных факторов
- •Влияние давления на сополимеризацию некоторых мономеров
- •3.2.4. Чередующаяся сополимеризация
- •1 Бутилметакрилат - диметилбутадиен, 2 - бутилметакрилат - (с2н5)3АlСl - диме-тилбутадиен; f1 мольная доля бутилметакрилата в исходной мономерной смеси
- •3.2.5. Влияние реакционной среды
- •3.2.6. Связь строения мономера и радикала с реакционной способностью.
- •Сополимеризация винилацетата (1) с хлорзамещенными этилена (2)
- •Влияние резонансного фактора на величину константы скорости роста, 20-30°с
- •Эмпирические и расчетные квантово-химические резонансные параметры строения мономеров и радикалов
- •Значения константы скорости реакции роста и параметра е некоторых мономеров, 25-30°с
- •Значения константы скорости реакции роста и параметра е пара-замещенных стирола, 60°с
- •Значения параметров реакционной способности мономеров схемы q-e
- •Относительные активности при сополимеризации некоторых мономеров
- •3.3. Ионная сополимеризация
- •3.3.1. Катионная сополимеризация
- •Катионная сополимеризация некоторых мономеров
- •3.3.2. Анионная сополимеризация
- •Анионная сополимеризация стирола (1) с бутадиеном-1,3 (2), инициатор н-с4н9Li
- •Влияние растворителя и противоиона на состав сополимера при сополимеризации стирола с изопреном
- •3.3.3. Сополимеризация на катализаторах Циглера-Натта
- •Реакционная способность различных мономеров в сополимеризации Циглера-Натта
- •Раздел 4. Химические превращения полимеров
- •4.1. Характерные особенности макромолекул как реагентов
- •4.1.1. Влияние соседних звеньев
- •4.1.2. Макромолекулярные и надмолекулярные эффекты
- •4.1.3. Кооперативные взаимодействия7
- •4.2. Сшивание полимеров
- •4.2.1. Высыхание красок
- •4.2.2. Вулканизация каучуков
- •4.2.3. Отверждение эпоксидных смол
- •4.3. Деструкция полимеров
- •4.3.1. Термическая деструкция. Циклизация
- •Температуры начала разложения и энергии активации термического распада некоторых полимеров
- •Продукты термического распада некоторых полимеров
- •Выход мономера при термическом распаде различных полимеров
- •4.3.2. Термоокислительная деструкция. Горение
- •Ограниченный кислородный показатель для некоторых полимеров
- •4.3.3. Фотодеструкция. Фотоокисление
- •4.4 Полимераналогичные превращения
- •4.4.1. Поливиниловый спирт
- •4.4.2. Химические превращения целлюлозы
- •4.4.3. Структурная модификация целлюлозы
- •Вопросы и упражнения к лекциям 11-15
Константы ингибирования Сz, 50-60ºС
|
Ингибитор |
Мономер |
|
|
Нитробензол |
Метилметакрилат Стирол Винилацетат |
0,00464 0,326 11,2 |
|
Бензохинон |
Метилметакрилат Стирол |
5,7 518,0 |
|
CuCl2 |
Метилметакрилат Стирол |
1000 11000 |
|
Дифенилпикрилгидразин |
Метилметакрилат |
2000 |
|
Кислород |
Метилметакрилат Стирол |
33000 14600 |
Так, константа ингибирования нитробензолом радикальной полимеризации метилакрилата на два порядка меньше по сравнению с полимеризацией стирола. Радикал роста метилакрилата и нитробензол имеют электроноакцепторные заместители, а радикал роста стирола – электронодонорный. Это означает, что преимущественно взаимодействуют радикалы и ингибиторы, имеющие противоположную поляризацию активных центров. Аналогичны примеры с бензохиноном и CuCl2.
Большое влияние на константу ингибирования оказывает также активность радикалов. Так, нитробензол в 30 раз более активен в реакции с радикалом роста винилацетата по сравнению с радикалом роста стирола, реакционная способность которого снижена из-за сопряжения ненасыщенного углерода с ароматическим заместителем.
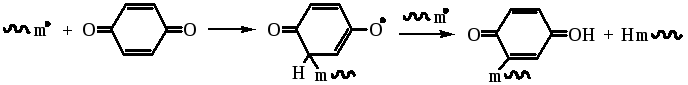
Для стабилизации мономеров часто используется гидрохинон, который активен лишь при наличии примесей кислорода: роль последнего заключается в окислении гидрохинона до хинона. Радикалы реагируют с хиноном по двум направлениям - путем атаки атомов кислорода:
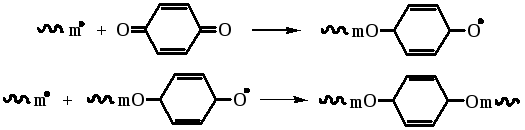
или ароматического кольца:
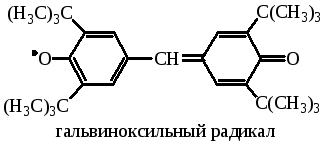
При определении скорости инициирования в качестве ингибитора обычно применяются стабильные радикалы, например:

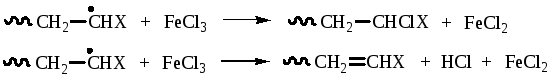
Для ингибирования полимеризации могут быть использованы соли металлов переменной валентности, например FeCl3, CuCl2. Последняя часто используется при очистке мономеров ректификацией для обработки элементов насадки - колец Рашига, спиралек и т.д. Реакция ингибирования с участием CuCl2 или FeCl3 является окислительно-восстановительной:
Определение абсолютных значений констант скоростей элементарных реакций. Рассмотренные представления и кинетические схемы позволяют определить лишь отношение констант элементарных реакций роста и обрыва цепи, что может быть сделано двумя способами. При радикальной полимеризации в массе с небольшим количеством инициатора, малоактивного в реакции передачи цепи, уравнение (2.21) с учетом механизма обрыва цепи сводится к уравнению:
![]() ,
(2.33)
,
(2.33)
г деλ
- доля
радикалов, участвующих в диспропорционировании.
Экспериментальные данные, представленные
графически в координатах
деλ
- доля
радикалов, участвующих в диспропорционировании.
Экспериментальные данные, представленные
графически в координатах
![]() ,
позволяют определитьСм
и
отношение
,
позволяют определитьСм
и
отношение
![]() (рис. 2.7).
(рис. 2.7).
В последнем случае необходимо знать значение λ. Оно может быть рассчитано исходя из данных по числу концевых групп, приходящихся на одну макромолекулу, согласно (2.8). В конечном итоге имеем:
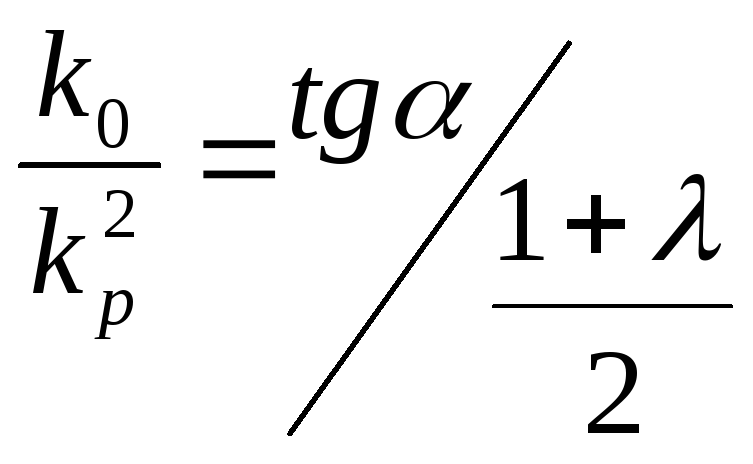 .
(2.34)
.
(2.34)
В
последнее время используют более
производительный метод, рассмотренный
выше, в основе которого лежит определение
скорости инициирования методом
радикальных ингибиторов. Зная скорость
инициирования, легко можно рассчитать
отношение
![]() через начальную скорость полимеризации:
через начальную скорость полимеризации:
![]() .
(2.35)
.
(2.35)
Для определения раздельных значений констант скоростей роста и обрыва необходимо новое уравнение, независимое от рассмотренных ранее. В качестве его обычно используется выражение, включающее среднее время жизни радикала τ, т.е. время от зарождения кинетической цепи до ее гибели в результате бимолекулярного обрыва. В стационарном режиме полимеризации:
![]() . (2.36)
. (2.36)
Выражая как обычно концентрацию радикалов, исходя из уравнения скорости роста, окончательно имеем:
![]() .
(2.37)
.
(2.37)
Таким образом, проблема определения раздельных значений констант скоростей роста и обрыва цепи сводится к определению τ. В течение длительного времени основным экспериментальным методом определения τ являлся метод «вращающегося сектора», в котором инициирование осуществлялось фотохимически, а световой поток периодически прерывался при вращении диска с вырезами. Найденные значения τ для различных мономеров и условий полимеризации находятся в интервале от 0,1 до 10 с. Это означает, что отрезок времени между двумя актами роста равен примерно 10- 4 с (с точностью до порядка).
В последние годы наиболее достоверным методом определения абсолютных констант скоростей роста и обрыва цепи был признан метод пульсирующей лазерной полимеризации (ПЛП). При облучении реакционного сосуда с мономером пульсирующим лазерным излучением достаточно большой мощности каждый импульс порождает огромное количество радикалов, которые «убивают» практически все предшествующие радикалы. Некоторая часть «уцелевших» новых радикалов инициирует полимеризацию, однако, макрорадикалы растут только до следующего импульса, после которого все повторяется сначала. Очевидно, что средняя длина цепи в таких условиях будет равна:
![]() ,
(2.38)
,
(2.38)
где
Δt
- время между импульсами. Для нахождения
kр
при
известных [М]
и
Δt
достаточно
определить среднечисловую молекулярную
массу полимера, что обычно делается с
помощью гель-хроматографии. Анализ
кривой молекулярно-массового
распределения, представленной на
хроматограмме, позволяет определить
также и k0.
Однако
проще и надежнее сделать это из отношения
![]() ,
зная
значение kр,
определенное
из (2.38). В табл. 2.8 приведены значения
констант скоростей роста и обрыва цепи
для наиболее распространенных
мономеров, а также значения
,
зная
значение kр,
определенное
из (2.38). В табл. 2.8 приведены значения
констант скоростей роста и обрыва цепи
для наиболее распространенных
мономеров, а также значения
![]() .
.
Таблица 2.8
