- •Момент инерции (определение, единицы измерения). Моменты инерции цилиндра, шара и стержня относительно оси вращения, проходящей через ось симметрии.
- •Вращательное движение твердого тела с закрепленной осью вращения. Основной закон динамики вращательного движения. Теорема Штейнера.
- •Криволинейное движение. Радиус кривизны траектории. Нормальное, тангенциальное, полное ускорение материальной точки.
- •Закон всемирного тяготения (формула Ньютона). Постоянная тяготения (величина, единицы измерения).
- •Связь линейной и циклической частоты. Связь периода гармонических колебаний с циклической частотой.
- •Центр масс системы материальных точек. Закон сохранения импульса системы материальных точек. Принцип реактивного движения.
- •Кинетической энергией системы называется скалярная величина w, равная арифметической сумме кинетических энергий всех точек системы
- •Математический маятник. Частота колебаний математического маятника (формула).
- •Линейная скорость материальной точки, линейное ускорение материальной точки, единицы измерения. Сложение скоростей.
- •Свободные колебания. Пружинный маятник. Частота колебаний пружинного маятника (формула).
- •Первый закон термодинамики для изобарного процесса.
- •Функция распределения физической величины. Распределение Максвелла для скоростей молекул газа.
- •Гармонические колебания. Амплитуда, фаза, циклическая частота гармонических колебаний, единицы измерения.
- •Работа постоянного тока на участке цепи. Закон Джоуля - Ленца.
- •Постоянная Больцмана, её величина, размерность, физический смысл.
- •Правила Кирхгофа. (для электрических цепей, содержащих несколько источников эдс)
- •Среднеквадратичная скорость молекул газа.
- •Колебательная система
- •Напряженность поля точечного заряда
- •Разность потенциалов между двумя точками электростатического поля.
- •Первый закон термодинамики для изотермического и адиабатического процессов.
- •Среднеквадратичная скорость
- •Электрический ток. Сила электрического тока, единицы измерения.
- •Эквипотенциальные поверхности. Эквипотенциальные поверхности для точечного электрического заряда.
- •Поляризация диэлектрика. Напряженность электростатического поля внутри диэлектрика.
- •Реакция деления ядра. Термоядерная реакция (реакция термоядерного синтеза).
- •Закон Ома для участка цепи:
- •Цепная ядерная реакция. Критическая масса радиоактивного элемента
- •Волновая функция (физический смысл).
-
Первый закон термодинамики для изобарного процесса.
В
изобарном процессе (P=const).
При изобарном расширении газа подведенное
к нему количество теплоты расходуется
как на увеличение его внутренней энергии
и на совершение работы газом:![]()
В изобарном процессе (p = const) работа, совершаемая газом, выражается соотношением
|
Первый закон термодинамики для изобарного процесса дает:
|
При изобарном расширении Q > 0 – тепло поглощается газом, и газ совершает положительную работу. При изобарном сжатии Q < 0 – тепло отдается внешним телам. В этом случае A < 0. Температура газа при изобарном сжатии уменьшается, T2 < T1; внутренняя энергия убывает, ΔU < 0.
-
Период колебательного процесса, частота колебательного процесса, единицы измерения.
Промежуток
времени, в течение которого тело совершает
одно полное колебание, называется
периодом колебаний. (в СИ-с)-
Т=1/![]()
Число
колебаний в единицу времени называется
частотой колебаний(в СИ-Гц)-
![]() =1/Т
=1/Т

-
Первый закон термодинамики для изохорного процесса. Внутренняя энергия идеального газа.
первый закон термодинамики, часто записывают так:
|
Q = ΔU + A. |
|
|
В изохорном процессе (V = const) газ работы не совершает, A = 0. Следовательно,
|
Здесь U (T1) и U (T2) – внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит только от температуры (закон Джоуля). При изохорном нагревании тепло поглощается газом (Q > 0), и его внутренняя энергия увеличивается. При охлаждении тепло отдается внешним телам (Q < 0).
При изохорном процессе объем газа остается постоянным, поэтому газ не совершает работу. Изменение внутренней энергии газа происходит благодаря теплообмену с окружающими телами.

Внутренняя энергия — это кинетическая энергия хаотического (теплового) движения частиц системы (молекул, атомов, ядер, электронов) и потенциальная энергия взаимодействия этих частиц.
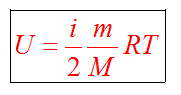

Внутренняя
энергия газа, содержащего ![]() частиц,
количеством
частиц,
количеством ![]() молей
и массой
молей
и массой ![]() :
:
![]()
Внутренняя энергия зависит от температуры. Если изменяется температура, значит изменяется внутренняя энергия.
-
Функция распределения физической величины. Распределение Максвелла для скоростей молекул газа.
Функция распределения-вероятность того, что величина x находится в промежутке от х0 до дельта х.
Закон распределения молекул идеального газа по скоростям, теоретически полученный Максвеллом в 1860 г. определяет, какое число dN молекул однородного (p = const) одноатомного идеального газа из общего числа N его молекул в единице объёма имеет при данной температуре Т скорости, заключенные в интервале от v до v + dv.
Если разбить диапазон скоростей молекул на малые интервалы, которые равны dν, то на каждый интервал скорости приходится число молекул dN(ν), имеющих скорость, которая заключена в этом интервале. Функция f(ν) задает относительное число молекул dN(ν), скорости которых находятся в интервале от ν до ν+dν, т. е.
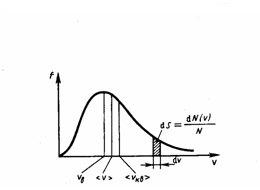
![]() откуда
откуда ![]()
f (v) - закон распределения молекул идеального газа по скоростям:
![]()
f (v ) зависит от рода газа (от массы молекулы) и от параметра состояния (от температуры Т)
f(v) зависит
от отношения кинетической энергии
молекулы, отвечающей рассматриваемой
скорости ![]() к
величине kT характеризующей
среднюю тепловую энергию молекул газа.
к
величине kT характеризующей
среднюю тепловую энергию молекул газа.
Скорости, характеризующие состояние газа:
![]()
-
Уравнение изохорного процесса. Его график в координатах PV, PT, VT.
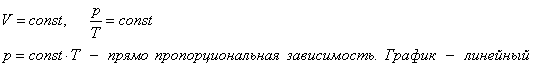
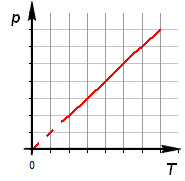
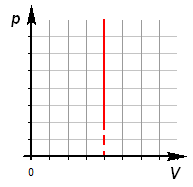
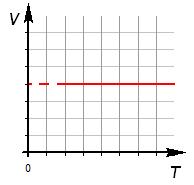
при
этих условиях давление газа p изменяется
прямо пропорционально его абсолютной
температуре: p ~ T или ![]()
Экспериментально зависимость давления газа от температуры исследовал французский физик Ж. Шарль (1787 г.). Поэтому уравнение изохорного процесса называется законом Шарля.
Уравнение
изохорного процесса может быть записано
в виде: 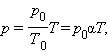
где p0 – давление газа при T = T0 = 273,15 К (т. е. при температуре 0 °С). Коэффициент α, равный (1/273,15) К–1, называют температурным коэффициентом давления.
-
Амплитудные характеристики вынужденных колебаний. Резонанс. Формула резонансной частоты.
Колебания, совершающиеся под воздействием внешней периодической силы, называются вынужденными.

-
Уравнение изобарного процесса. Его график в координатах PV, PT, VT.
Уравнение
изобарного процесса для некоторого
неизменного количества вещества ν имеет
вид: ![]()
где V0 – объем газа при температуре 0 °С. Коэффициент α равен (1/273,15) К–1. Его называют температурным коэффициентом объемного расширения газов.
Изобарный
процесс.
![]()
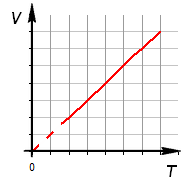
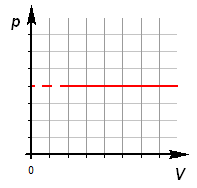
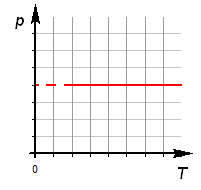
-
Потенциал электростатического поля, единицы измерения. Потенциал поля точечного заряда.
Потенциалом
электростатического поля называется
физическая величина, равная отношению
потенциальной энергии заряда qпр в
данной точке пространства, к величине
этого заряда
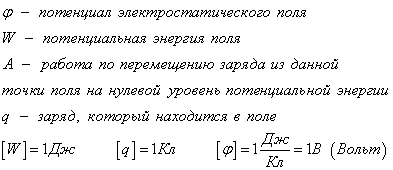
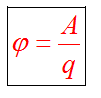
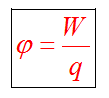
Потенциал
поля точечного заряда Q :
![]() ,
где
e0-диэлектрическая
постоянная 8,85*10-12
Кл2/Н*м2
Потенциал измеряется в Вольтах=Дж/Кл
,
где
e0-диэлектрическая
постоянная 8,85*10-12
Кл2/Н*м2
Потенциал измеряется в Вольтах=Дж/Кл
-
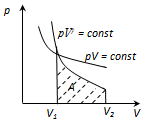
Адиабатический процесс. Уравнение Пуассона.
Адиабатическим называется процесс, при котором отсутствует теплообмен (δQ=0) между системой и окружающей средой. Адиабатическим процессами можно считать все быстропротекающие процессы. Таковым, например, можно считать процесс распространения звука в среде, так как скорость распространения звуковой волны настолько большая по значению, что обмен энергией между средой и волной произойти не успевает. Адиабатические процессы происходят в двигателях внутреннего сгорания (сжатие и расширение горючей смеси в цилиндрах), в холодильных установках и т. д.
первое начало термодинамики в этом случае приобретает вид
![]()
где ![]() —
изменение внутренней
энергии тела,
—
изменение внутренней
энергии тела, ![]() — работа,
совершаемая системой.
т.
е. внешняя работа совершается за счет
изменения внутренней энергии
системы.
Используя
формулы δA=pdV и CV=dUm/dT,
для произвольной массы газа перепишем
уравнение (1) в виде
— работа,
совершаемая системой.
т.
е. внешняя работа совершается за счет
изменения внутренней энергии
системы.
Используя
формулы δA=pdV и CV=dUm/dT,
для произвольной массы газа перепишем
уравнение (1) в виде
![]() (2)
применив
дифференцирование уравнение состояния
для идеального газа pV=(m/M)RT
получим
(2)
применив
дифференцирование уравнение состояния
для идеального газа pV=(m/M)RT
получим
![]() (3)
Исключим
из (2) и (3) температуру Т.
(3)
Исключим
из (2) и (3) температуру Т.
![]() Разделив
переменные и учитывая, что Сp/СV=γ
, найдем
Разделив
переменные и учитывая, что Сp/СV=γ
, найдем
![]() Проинтегрируя
это уравнение в пределах от p1 до
p2 и
соответственно от V1 до
V2,
и потенцируя, придем к выражению
Проинтегрируя
это уравнение в пределах от p1 до
p2 и
соответственно от V1 до
V2,
и потенцируя, придем к выражению
![]() или
или
![]() Так
как состояния 1 и 2 выбраны произвольно,
то можно записать
Так
как состояния 1 и 2 выбраны произвольно,
то можно записать ![]() (4)
Полученное
выражение есть уравнение
адиабатического процесса,
называемое также уравнением
Пуассона.
безразмерная
величина
(4)
Полученное
выражение есть уравнение
адиабатического процесса,
называемое также уравнением
Пуассона.
безразмерная
величина
![]() (7)
называется показателем
адиабаты (или коэффициентом
Пуассона).
Для одноатомных газов (Ne, He и др.),
достаточно хорошо удовлетворяющих
условию идеальности, i=3,
γ=1,67. Для двухатомных газов (Н2,
N2,
О2 и
др.) i=5,
γ=1,4.
(7)
называется показателем
адиабаты (или коэффициентом
Пуассона).
Для одноатомных газов (Ne, He и др.),
достаточно хорошо удовлетворяющих
условию идеальности, i=3,
γ=1,67. Для двухатомных газов (Н2,
N2,
О2 и
др.) i=5,
γ=1,4.