
- •Часть 2
- •1.Статистическая обработка экспериментальных
- •1 Этап: расчет линейной модели
- •2 Этап: оценка адекватности линейной модели.
- •Примеры нелинейных моделей Принцип линеаризации
- •Для облегчения расчета нелинейной модели заранее задаются два
- •2. Измерение расхода жидкостей и газов. Теория метода
- •Прямая задача не сложна; гораздо сложнее обратная задача.
- •Другие методы измерения расхода: счетчики количества скоростные
- •3.Измерение плотности и концентрации жидкости.
- •Величина n уменьшается с увеличением температуры:
- •4.Измерение состава газов. Основные методы
- •5.Измерение вязкости жидкостей. Основные методы.
- •Здесь f –Гц, ρ – кг/м³, с –м/с, μ-Па*с.
- •Примеры применения вискозиметров при автоматизации технологических процессов .
- •6.Измерение геометрических размеров. Типовые задачи измерения геометрических размеров
- •Ориентировочные значения массовой толщины r:
- •7.Измерительные системы в составе схем автоматизации типовых технологических объектов легкой
- •Часть 2
Другие методы измерения расхода: счетчики количества скоростные
и объемные, метод постоянного перепада (ротаметры).
3.Измерение плотности и концентрации жидкости.
Методы измерения концентрации, избирательность методов.
Кондуктометрические методы, оптические методы.
Плотномеры: поплавковые, весовые, гидростатические
![]() (37)
(37)
где βV – объемный коэф. расширения жидкости.
Для воды в диапазоне температур [+20 ÷ 40] oC βV =3.02*10-41/гр.,
[+60 ÷ 80] oC βV =5.87*10-41/гр.
Для других жидкостей βV =(2 ÷.15)*10-41/гр.
Анализ состава растворов: интегральные и избирательные методы,
Кондуктометрические концентратомеры: датчики,
уравнение Кольрауша, схемы замещения, поляризация электродов,
погрешности измерения, примеры измерительных схем –см.рис.4, 5:
- 19 –
Удельная электропроводность раствора χ:
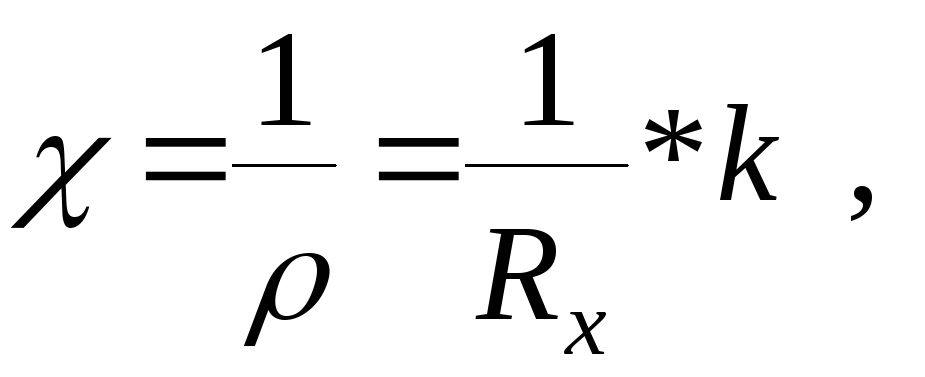 См/см
(38)
См/см
(38)
где R – сопротивление датчика с раствором;
k – постоянная датчика, k=l/S;
ρ – удельное сопротивление раствора, Ом*см.
Эквивалентная электропроводность λ=χ/Сэкв , мл*См/см*г-экв.
Здесь Сэкв - эквивалентная концентрация вещества , г-экв./мл
Для NaCl Сэкв =58.45 г-экв./л .
Теория электролитической диссоциации:
для однокомпонентного раствора степень диссоциации α= n/N, где
N – общее число молекул вещества в растворе, n – число молекул,
распавшихся на ионы. С увеличением концентрации α уменьшается.
Для растворов NaCl в дистиллированной воде (χ <1*10-6Cм/см) при
температуре 20 С удельная электропроводность χ:
-
С,мг/л
5
10
15
20
25
50
100
χ*106, См/см
10
19.6
28.4
38
46.6
90
180
Относительная электропроводность водных растворов различных
веществ χотн = χвещ/ χNaCl по отношению к раствору NaCl:
- 20 -
-
Вещества
NaCl
KCl
NaOH
Na2CO3
Na2SO4
χотн
1
0.939
2.8
1.12
0.83
Для разбавленных растворов справедливо уравнение Кольрауша:
![]() ,
(39)
,
(39)
где α – степень диссоциации; Сэкв – эквивалентная концентрация
растворенного вещества, г-экв/мл; z – валентность ионов растворенного
вещества; U+ , U-- -- подвижность анионов и катионов.
Для многокомпонентного раствора, состоящего из k -компонентов:
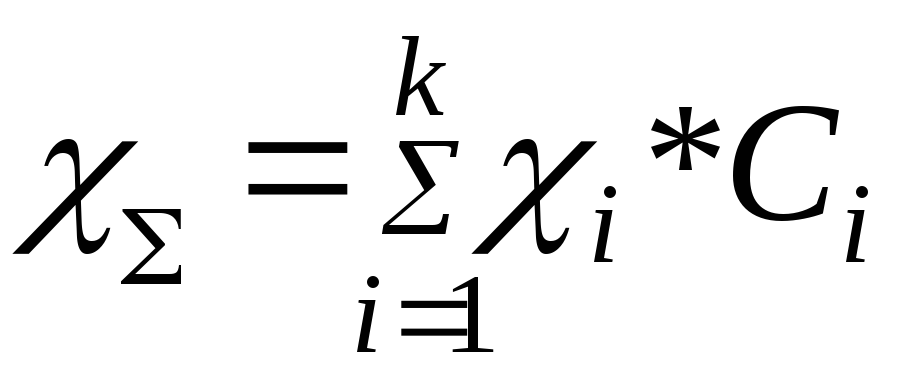 ,
(40)
,
(40)
где Сi – относительные объемные концентрации веществ.
Электропроводность растворов зависит от температуры:
![]() ,
(41)
,
(41)
где коэффициенты А,В определяются экспериментально, Т – в К.
В узком диапазоне температур (±20 С) эту зависимость можно представить в линеаризированном виде:
![]() ,
(42)
,
(42)
где α – линеаризированный температурный коэффициент
 -
21 -
-
21 -
электропроводности. Примерные значения α (в интервале Θ=20÷40 С):
кислоты α=13*10-3 1/град
щелочи α=19*10-3 1/град
растворы солей α=23*10-3 1/град
На рис.4, -схема замещения: Сдс – емкость двойного электрического слоя;
RS , CS – фарадеевский импеданс, а именно: RS -поляризационное сопротивление (активная составляющая); CS - псевдоемкость, обусловленная электрохимической реакцией; С – емкость, обусловленная диэлектрическими свойствами раствора.
Для уменьшения влияния фарадеевского импеданса на результаты измерения желательно увеличить частоту ( >103 Гц) и уменьшать
- 22 -
величину I тока, что уменьшает поляризационные процессы у электродов.
Оптические анализаторы: рефрактометры, фотометры,
нефелометры, поляриметры, погрешности измерения.
Для анализа состава используются оптические характеристики растворов.
Классификация:
1)Рефрактометры – используется зависимость коэфициента преломления раствора от его концентрации СХ
2) фотометры (Фотоколориметры) –используют зависимость оптической плотности раствора на длине волны от его концентрации СХ
3) Нефелометры ,турбидиметры – по степени рассеяния оптического
потока через взвеси.
4)Поляриметры – для измерения концентрации оптически активных
веществ (растворы сахара), у которых изменение концентрации вызывает изменение параметров поляризационного оптического луча.
РЕФРАКТОМЕТРЫ
 ,
(43)
,
(43)
где α – угол падения; β – угол преломления; n1, n2 – коэфициенты преломления; v1, v2 – скорости света в средах; N –абсолютный коэфициент преломления; с – 2.998*10^8 м/с, см. рис.6.
воздух – N= 1.003; вода - N= 1.333 (Θ=20°С, λ=0.59 мкм),
глицерин - N= 1.474(Θ=20°С, λ=0.59 мкм),
стекло - N= 1.515÷1.65(Θ=20°С, λ=0.59 мкм).
