
- •Часть 2
- •1.Статистическая обработка экспериментальных
- •1 Этап: расчет линейной модели
- •2 Этап: оценка адекватности линейной модели.
- •Примеры нелинейных моделей Принцип линеаризации
- •Для облегчения расчета нелинейной модели заранее задаются два
- •2. Измерение расхода жидкостей и газов. Теория метода
- •Прямая задача не сложна; гораздо сложнее обратная задача.
- •Другие методы измерения расхода: счетчики количества скоростные
- •3.Измерение плотности и концентрации жидкости.
- •Величина n уменьшается с увеличением температуры:
- •4.Измерение состава газов. Основные методы
- •5.Измерение вязкости жидкостей. Основные методы.
- •Здесь f –Гц, ρ – кг/м³, с –м/с, μ-Па*с.
- •Примеры применения вискозиметров при автоматизации технологических процессов .
- •6.Измерение геометрических размеров. Типовые задачи измерения геометрических размеров
- •Ориентировочные значения массовой толщины r:
- •7.Измерительные системы в составе схем автоматизации типовых технологических объектов легкой
- •Часть 2
Величина n уменьшается с увеличением температуры:
![]() ,
(44)
,
(44)
где αN – температурный коэф. преломления, для воды αN =8*10–5 1/град.
- 23 –
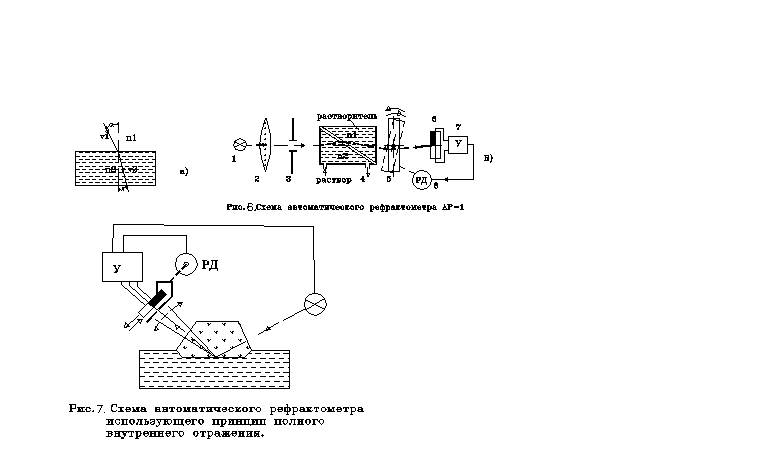
Для настройки рефрактометров часто используют растворы NaCl в воде
(при температуре =20С):
![]() ,
(45)
,
(45)
где А=1.76*10-3 [ 100мл/г ], В=8.8*10-6 [ 100мл/г ]2, СNaCl [г/100мл].
Формула (45) верна для диапазона СNaCl =[0 20] , г/100мл.
Схема рефрактометра АР-1.
Статическая характеристика:
![]() ,
(46)
,
(46)
где n0 – показатель преломления растворителя;
- 24 –
k – инкремент показателя преломления, k=( nВ - n0)/100,
nВ , СХ - показатель преломления и объемная концентрация вещества.
Cхема рефрактометра с эффектом полного внутреннего отражения, -
- см. рис.7.
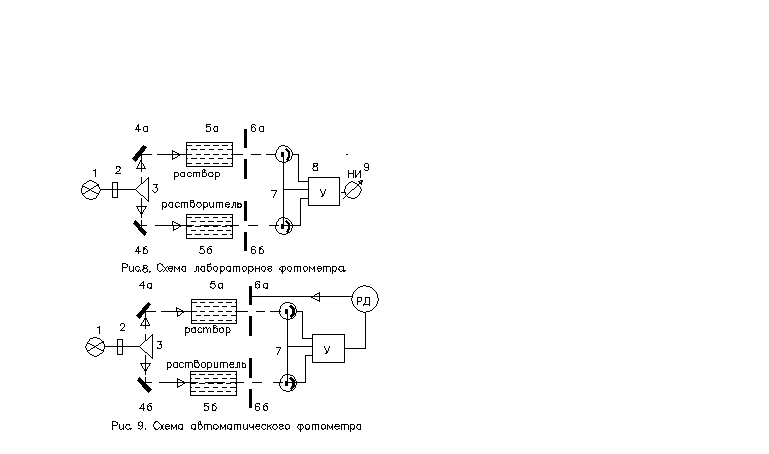
ФОТОМЕТРЫ (ФОТОКОЛОРИМЕТРЫ)
Применяется для окрашенных прозрачных растворов.
В основе лежит закон Бугера-Ламберта- Бера (см. рис. 8 ):
![]() ,
(47)
,
(47)

- 25 –
![]() ,
,
где Ф0 λ , Фλ –интенсивности световых потоков на входе и выходе из
слоя раствора толщиной b на длине ваолны λ; ελ – молярный коэфициент поглощения (молярная экстинкция), -является характеристикой вещества; СХ – концентрация вещества, моль/л; Dλ –оптическая плотность раствора;
τλ– коэффициент пропускания.
Для многокомпонентного раствора с «k» компонентов:
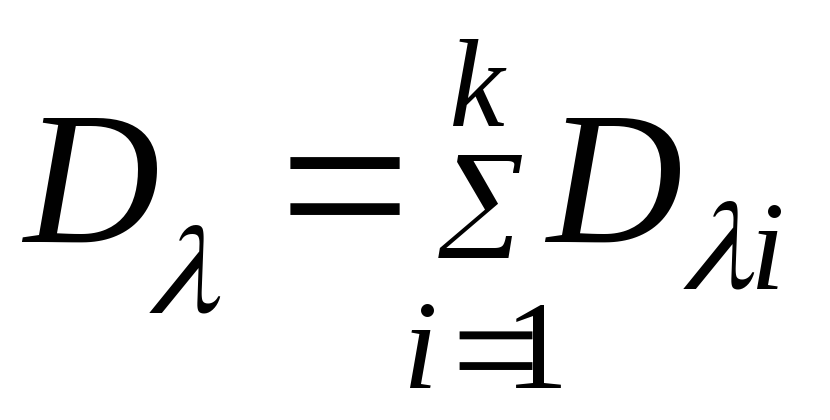 ,
( 48)
,
( 48)
Структурная схема автоматического фотометра – рис. 9 .
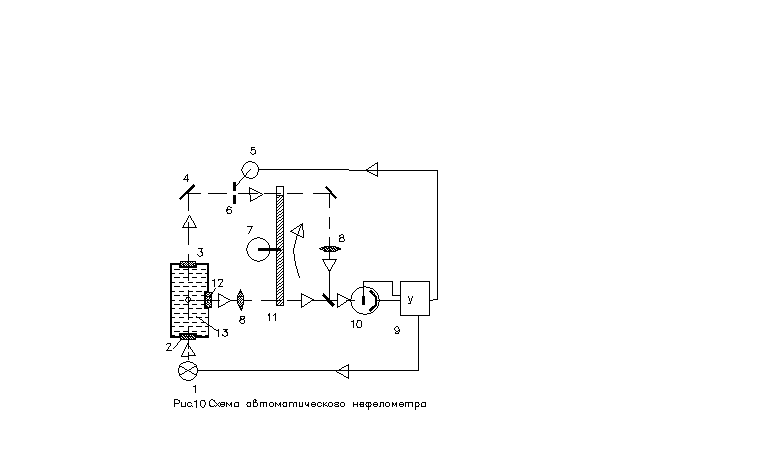
ТУРБИДИМЕТРЫ И НЕФЕЛОМЕТРЫ.
Применяются для измерение концентрации взвесей.
Общий световой поток можно разделить на проходящий ФПР и рассеяный ФРАС потоки – см. рис. 10 :
![]() ,
(49)
,
(49)
Поток ФПР регистрируется по основному направлению , - турбидиметрами.
В основе – закон Бера:
![]() ,
(50)
,
(50)
где k – коэфициент поглащения (экстинкция), зависит от среднего размера
частиц в взвеси;
СХ – объемная концентрация частиц в ед. объема раствора;
b – толщина слоя раствора.
Поток ФРАС регистрируется по направлению (углу) 90° по отношению к основному направлению светового потока – измеряется нефелометрами..
В основе – закон Релея:
 -
26 –
-
26 –
Закон Релея:
 ,
(51)
,
(51)
где Ф0 –падающий световой поток;
n1,n2 – относительные коэфициенты преломления вещества частиц и
растворителя;
СХ – объемная концентрация частиц в ед. объема раствора;
V – средний объем одной частицы;
λ –длина волны;
l- растояние до фотоэлемента;β –угол между основным направлением луча и расположением фотоэлемента.
- 27 -
Титрование растворов.
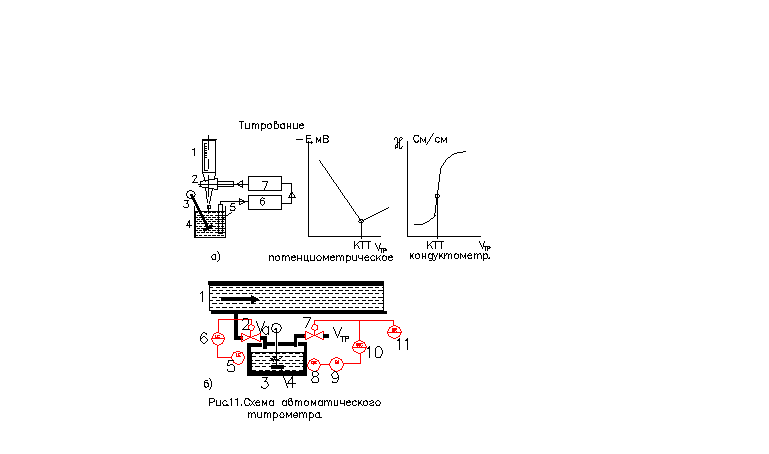
Титрование – метод количественного анализа для определения концентрации известного вещества А, находящегося в смеси с другими компонентами. Для титрования подбирают специальный реагент B, называемый титрантом, который избирательно реагирует с определяемым компонентом А по схеме (см. рис.11,а):
А + B = M + N , ( 52)
где M, N – продукты титрования.
Пример титрования:
HCl + KOH = KCl + H2O
(A) + (B) = (M) + (N)
Титрующее вещество B добавляют до тех пор, пока не прореагирует все количество определяемого вещества А, содержащегося в пробе. При этом количество QB титранта B эквивалентно количеству QA титруемого вешества А:
QA = kP* QA , (53)
где kP - стехиометрический коэффициент реакции титрования.
Количество титруемого вещества :
QA = CA * QПР , (54)
где CA - концентрация вещества А в анализируемой пробе; QПP =const -
- количество исходной пробы.
Эквивалентное количество титранта :
QB = CB * VB , (55)
где CB - концентрация титранта; VB - эквивалентный объем титранта.
Отсюда получаем зависимость искомой концентрации CA от эквивалентного объема VB титранта:
CA = kT * VB , (56)
 -28
–
-28
–
где kT = kP * CB/QПР=const.
Следовательно, мерой концентрации CA определяемого компонента А
является эквивалентный объем VB титранта В.
Момент эквивалентности, когда определяемое вещество А полностью прореагировало с титрантом В, называется конечной точкой титрования (КТТ). В этот момент в пробе присутствуют только продукты титрования M, N. Для определения КТТ (см. рис.11,а ) применяют различные методы: потенциометрический (по рН раствора), кондуктометрический (по электропроводности χ раствора) и т.п. В момент КТТ происходит резкое изменение измеряемого свойства раствора.
- 29 -
Схема автоматического объемного титрометра, - см. рис. 11,б.
Полярография растворов.
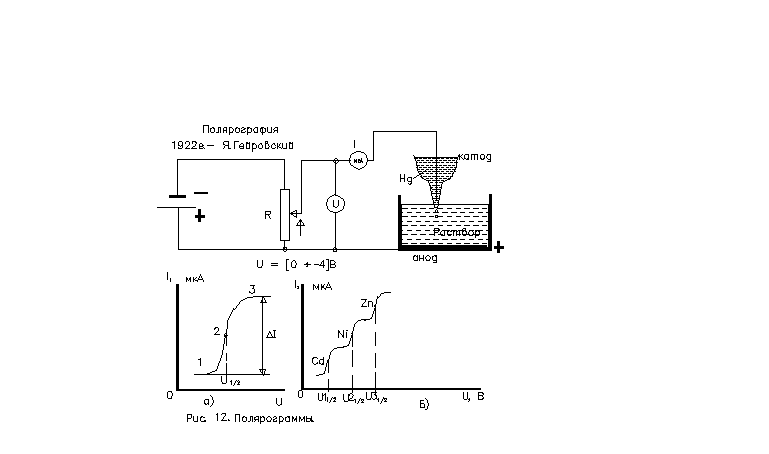
Метод повышенной избирательности, предложен в 1922г. Я.Гейровским, основан на зависимости ток-напряжение электродных процессов полярографической ячейки, -см. рис. 12.
В специальной воронке залита ртуть, из носика воронки равномерно в исследуемую пробу раствора вытекают капли ртути с периодом 2-4 сек.
Капля ртути имеет отрицательный заряд, в зависимости от положения движка потенциометра R. Вокруг капли ртути, при ее опускании через раствор, образуется слой ионов. Когда линейно возрастающее напряжение U (при передвижении движка потенциометра R вверх) становится равным напряжению восстановления определяемого компонента, через ячейку (катод – капля – анод) протекает ток I. Возрастание силы тока при увеличении напряжения имеет вид полуволны, см. рис.12, а.
Полярограмма однокомпонентного раствора состоит из трех характерных
участков:
начальный (нулевой, фоновый) ток; 2 – участок диффузионного тока
(электролиз); 3 –участок предельного тока (все определяемые катионы из пробы раствора связаны со ртутью). В этой кривой напряжение полуволны U1/2 – параметр определяемого компонента (имеются таблицы), а величина ΔI является функцией количества определяемого компонента. Для многокомпонентного раствора типичный вид полярограммы представлен на рис.12, Б.
Параметры полярографов:
чувствительность S– это минимальное количество компонента, которое может быть определено в растворе, S - до 10 –6 моль/л;
разрешающая способность К – отношение максимальной концентраций мешающего компонента к концентрации определяемого компонента, при
30 –
котором соблюдается оговоренная чувствительность S, К =50÷100.
Примеры применения анализаторов состава растворов в системах
очистки промышленных стоков
