
OBSchAYa_KhIMIYa
.pdf
7.3.3. Равновесия в растворах слабых электролитов
Поскольку процессы ионизации слабых электролитов обратимы, они подчиняются закону действующих масс и могут быть количественно охарактеризованы соответствующими константами равновесия. Остановимся на важнейших из них.
Константа ионизации. Константой ионизации электролита называют константу равновесия обратимой реакции распада электролита на ионы.
Пусть электролит XmYn ионизируется по уравнению:
XmYn  mXn+ + nYm-
mXn+ + nYm-
Константа ионизации этого электролита:
K [Xn ]m [Ym- ]n [XmYn ]
Например, для уксусной кислоты:
|
+ |
- |
|
[H ][CH3COO- ] |
1,74·10 |
-5 |
||
СН3СООН |
|
Н |
+ СН3СОО ; |
Ка = |
|
|
|
|
|
[CH3COOH] |
|
||||||
|
|
|
|
|
|
|
||
Если электролит ионизируется ступенчато, то каждой стадии процесса соответствует своя константа ионизации. Так, для ортофосфорной кислоты ионизация протекает в три стадии:
|
|
|
|
+ |
|
|
|
K |
[H ][H2PO4 ] |
|
-3 |
|
||||||||||
Н3РО4 |
|
|
|
|
|
Н + Н2РО |
4 |
; |
|
|
|
|
|
|
|
= 7,1·10 |
|
; |
||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
1 |
|
|
[H3PO4 ] |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
H2PO4- |
|
|
|
|
H+ |
+ HPO 42 ; |
|
|
|
[H ][HPO2- ] |
6,2·10-8; |
|||||||||||
|
|
|
|
K2 |
|
|
4 |
|
|
|||||||||||||
|
|
|
[H |
- |
] |
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
PO |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
4 |
|
|
|
|
|
|
|
HPO 42 |
|
|
|
H+ |
+ PO 3 |
; |
K |
3 |
|
[H ][PO34- ] |
5,0·10-13 |
|
||||||||||
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
4 |
|
|
|
|
|
[HPO2- ] |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
Суммирование уравнений ступенчатой ионизации фосфорной кислоты дает общее
уравнение ионизации: |
|
|
|
|
Н РО |
4 |
|
3Н+ + РО 3 |
|
|
||||
3 |
4 |
|
||
Константа равновесия, отвечающая этому уравнению, называется общей константой ионизации; она равна произведению ступенчатых констант ионизации:
Ка = |
[H ]3[PO34- ] |
K1 |
K2 |
K3 |
||
[H3PO4 |
] |
|
||||
|
|
|
|
|
||
Поскольку с увеличением отрицательного заряда аниона затрудняется отщепление каждого последующего катиона водорода, то К1 > К2 > K3. Эта закономерность всегда соблюдается при ступенчатой ионизации.
Как и всякая константа равновесия, константа ионизации не зависит от концентрации, но зависит от природы электролита и температуры. Для большинства слабых электролитов с повышением температуры константа ионизации увеличивается (например, для растворов аммиака).
Изменение концентрации не влияет на величину константы диссоциации, но значительно влияет на степень диссоциации. Проследим это влияние на примере уксусной кислоты:
|
+ |
- |
|
[H ][CH3COO- ] |
|
СН3СООН |
|
Н |
+ СН3СОО ; |
Ка = |
|
|
[CH3COOH] |
||||
|
|
|
|
|
|
101

Выразим равновесные концентрации частиц в растворе через общую концентрацию уксусной кислоты (С):
[CH3COO-] = [H+] = C ; |
[CH3COOH] = C - C = C(1- ) |
Подставив полученные формулы в выражение константы диссоциации, получим следующее уравнение:
K = Cα Cα C(1- α)
Поскольку для слабых электролитов <<1, то уравнение можно привести к более простому виду:
K C 2, отсюда |
|
K |
|
|
|||
C |
|||
|
|
Ионные равновесия можно смещать, вводя в систему сильные электролиты, содержащие ион, отщепляемый слабым электролитом. Например, если к раствору уксусной кислоты добавить ацетат натрия, практически нацело диссоциирующий по уравнению:
CH3COONa = Na+ + CH3COO-,
то концентрация ацетат-иона в растворе возрастет. Согласно принципу Ле Шателье, увеличение концентрации ионов CH3COO- будет сопровождаться уменьшением концентрации ионов водорода, т.е. смещением равновесия в сторону процесса ассоциации. Таким образом, одноименные ионы подавляют ионизацию слабых электролитов.
Ионное произведение растворителя. Растворители (H2O, NH3, HCN, HF и др.) обыч-
но являются самоионизирующимися веществами, и в какой-то мере распадаются на ионы. К этим процессам также применим закон действующих масс. Так, вода, хотя и весьма незначительно, распадается на ионы по уравнению:
Н2О + Н2О  Н3О+ + ОН-
Н3О+ + ОН-
катион гидроксония
или в упрощенной форме
Н2О  Н+ + ОН- Константа ионизации воды определяется следующим соотношением
Н+ + ОН- Константа ионизации воды определяется следующим соотношением
K [H ][OH- ] [H2O]
Поскольку ионизации подвергается ничтожно малая часть молекул воды (примерно одна из 550 млн), равновесную концентрацию воды можно считать постоянной. Тогда уравнение приобретает вид:
Kw = [H ][OH ]
Таким образом, для воды и водных растворов произведение концентраций ионов водорода и гидроксила есть величина постоянная. В любом водном растворе всегда присутствуют и ионы Н+, и ионы ОН-, концентрации которых взаимосвязаны. Константа Кw (или KH2O )
называется ионным произведением воды. Поскольку процесс ионизации эндотермичен (Δ Ho298 = 57,3 кДж/моль), с повышением температуры ионное произведение воды возрас-
тает. Так, при 25˚С Кw = 1,008·10-14 10-14, при 50˚С - 5,5·10-14, а при 100˚С - 5,9·10-13.
Используя ионное произведение воды, можно определить понятия нейтральный, кислый, щелочной водный раствор следующим образом. Нейтральными растворами называются растворы, для которых концентрации ионов водорода и гидроксила равны
102

[H+] = [OH-] = 
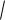 Kw = 10-7 моль/л.
Kw = 10-7 моль/л.
Кислыми растворами называются растворы, для которых
[H+] > 10-7 моль/л; |
[OH-] < 10-7 моль/л. |
Щелочными растворами называются растворы, для которых |
|
[H+] < 10-7 моль/л; |
[OH-] > 10-7 моль/л. |
Поскольку значения концентраций ионов Н+ и ОН- в растворе меняются в широком диапазоне, для количественной оценки кислотности или щелочности раствора удобно использовать не концентрацию водородных ионов, а так называемый водородный показатель:
pH = -lg[H+]
Соответственно для нейтральных растворов рН = 7, для кислых растворов рН < 7, а для щелочных растворов рН > 7. Чем меньше значение рН, тем выше кислотность и ниже щелочность среды.
Значение рН среды может быть определено различными методами, простейшим из которых является индикаторный метод. Индикаторами называются вещества, изменяющие свою окраску в определенном интервале значений рН. Ниже приведены интервалы перехода некоторых широко используемых индикаторов с указанием изменения окраски:
метиловый желтый (2,9 - 4,0; красный желтый); метиловый оранжевый (3,1 - 4,4; красный желтый); метиловый красный (4,2 - 6,2; красный желтый); бромтимоловый синий (6,0 - 7,6; желтый синий); фенолфталеин (8,2 - 10,0; бесцветный малиновый); тимолфталеин (9,3 - 10,5; бесцветный синий).
Как видно из приведенных примеров, каждый индикатор меняет окраску в небольшом интервале значений рН. Смешивая несколько индикаторов, можно получить реактивы, называемые универсальными индикаторами, которые позволяют приближенно оценивать рН разных растворов.
Аналогично величине рН можно ввести в рассмотрение велину рОН (гидроксильный показатель): pОH = -lg[ОH-]. Величины рН и рОН связаны простым соотношением:
рН + рОН = 14.
Рассмотрим примеры расчета рН водных растворов сильных и слабых кислот и оснований.
Пример № 1. Сантимолярный раствор (0,01 моль/л) соляной кислоты (сильная одноос-
новная кислота).
HCl = H+ + Cl-
[H+] = CHCl = 0,01; |
pH = -lg 0,01 = 2 |
Пример № 2. Сантимолярный раствор (0,01 моль/л) гидроксида натрия (сильное однокислотное основание).
NaOH = Na+ + OH-
[OH-] = CNaOH = 0,01; |
pOH = -lg 0,01 = 2; |
pH = 14 - pOH = 12 |
Пример №3. Сантимолярный раствор (0,01 моль/л) уксусной кислоты (слабая одноосновная кислота).
CH3COOH  CH3COO- + H+
CH3COO- + H+
103

Из уравнения реакции следует, что [H+] = [CH3COO]. Учтем также, что для слабого электролита [CH3COOH] C. Подставим эти формулы в константу кислотной диссоциации уксусной кислоты и преобразуем полученное выражение:
|
|
|
[CH3COO- ][H+ ] |
|
-5 |
|
|
|
|
[H+ |
]2 |
|
+ |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
||||||||
K |
a |
= |
|
|
|
= 1,75 10 |
|
; |
K |
a |
= |
|
|
|
; |
[H ] K |
C |
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
[CH3COOH] |
|
|
|
|
|
|
C |
|
|
|
a |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
рН = - lg 
 KaC = -1/2(lgKa + lgC) = 1/2(pKa - lgC) = 1/2(4,75 + 2) = 3,38
KaC = -1/2(lgKa + lgC) = 1/2(pKa - lgC) = 1/2(4,75 + 2) = 3,38
Пример № 4. Сантимолярный раствор (0,01 моль/л) аммиака (гидроксида аммония).
NH3·H2O  NH4+ + OH-
NH4+ + OH-
Из уравнения реакции следует, что [NH4+] = [OH-], а [NH3·H2O] C, поскольку гидроксид аммония слабый электролит. Подставим эти формулы в константу ионизации аммиака как основания и преобразуем полученное выражение:
|
|
[NH4 |
][OH- ] |
= 1,8 10 |
-5 |
|
|
[OH- ]2 |
- |
|
|||
|
|
|
|
||||||||||
Kb |
|
|
|
|
|
; |
Kb = |
|
; |
[OH ] = KbC |
|||
[NH3 |
H2 O] |
|
|
||||||||||
|
|
|
|
|
|
C |
|
|
|||||
рOН = -lg 
 KbC = 1/2(pKb - lgC);
KbC = 1/2(pKb - lgC);
pH = 14 - pOH = 14 + 1/2(lgC - pKb) = 14 + 1/2(-2 - 4,76) = 10,62
Ионными произведениями могут быть охарактеризованы и другие самоионизирующиеся растворители. Уравнения ионизации и ионные произведения для некоторых из них приведены ниже:
1) жидкий фтороводород
3HF |
|
H F+ |
+ HF ; |
K |
HF |
= 2,0 10-11 |
(при 18˚С); |
|
|||||||
|
2 |
2 |
|
|
|
||
2) жидкий сероводород
2H S |
|
H S+ |
+ HS-; |
K |
H 2S |
= 3,0 10-35 |
(при -70˚С); |
|
|||||||
2 |
3 |
|
|
|
|
||
3) жидкий аммиак
2NH |
|
NH |
+ + NH -; |
K |
= 2,1 10-33 |
(при -50˚С). |
|
||||||
3 |
4 |
2 |
|
NH3 |
|
|
Произведение растворимости малорастворимого электролита. Если раствори-
мость электролита AmBn очень мала, допустимо считать, что степень ионизации его в насыщенном растворе равна единице, в результате чего в системе устанавливается равновесие между кристаллическим веществом и его насыщенным раствором:
AmBn(к)
mAn+(p-р) + nBm-(p-р)
Константа равновесия процесса диссоциации малорастворимого электролита называется произведением растворимости и обозначается символом ПР. Поскольку вещества, образующие твердые фазы, не входят в уравнение закона действующих масс, то:
ПР [An ]m[Bm ]n
Таким образом, в насыщенном растворе малорастворимого электролита произведение концентраций ионов, отщепляемых электролитом, является постоянной величиной.
Пусть в растворе AmBn концентрации ионов А и В равны СА и СВ моль/л. Между СА, СВ и ПР возможны три вида соотношений:
1) САm·СВn = ПР; такой раствор будет насыщенным, т.е. способным сколь угодно долго контактировать с избытком AmBn без изменения состава жидкой фазы;
104

2) САm·СВn < ПР; раствор будет ненасыщенным, т.е. способным растворить еще какое-то количество AmBn;
3)САm·СВn > ПР; раствор будет пересыщенным (метастабильное состояние). Произведение растворимости связано с растворимостью электролита (s, моль/л). Если
в растворе отсутствуют другие электролиты, отщепляющие ионы Аn+ и Bm-, то [An+] = ms, а [Bm-] = ns, откуда
ПР mmnnsm n
Произведение растворимости является одной из фундаментальных характеристик малорастворимого вещества, поэтому эти величины сведены в специальные таблицы, т.е. являются справочными. Например:
ПРAgCl [Ag ][Cl ] s2 1,78 10 10; ПРPbI2 [Pb2 ][I ]2 4s3 1,1 10 9;
ПРCa3 (PO 4 )2 [Ca2 ]3[PO43 ]2 108s5 2,0 10 29
При введении в систему электролитов, отщепляющих одноименные ионы, растворимость малорастворимого электролита понижается, так как равновесие при этом смещается в направлении образования осадка. В этом случае растворимость будет определяться концентрацией иона, ставшей в результате смещения равновесия меньше его концентрации в насыщенном растворе.
Зная произведения растворимости, можно решать ряд задач, имеющих прикладное значение.
Пример №1. Определить растворимость в воде сульфата свинца и изменение растворимости этого соединения при введении в систему 0,1 моль/л сульфата калия.
В соответствии с уравнением: PbSO4(к)  Pb2+(р-р) + SO42-(р-р)
Pb2+(р-р) + SO42-(р-р)
ПР = [Pb2+][SO42-]
ПР = [Pb2+][SO42-] = 1,6 10-8
Из уравнения процесса растворения видно, что [Pb2+] = [SO42-] = s. Отсюда следует:
|
|
|
|
|
|
ПР = s2; |
s = ПР |
1,6 10 8 = 1,26·10-4 (моль/л) |
|||
В 0,01 М растворе сульфата калия [SO42-] = 0,01; тогда:
|
ПР |
|
1,6 10 8 |
|
|||
s' = [Pb2+] = |
|
|
|
|
|
= 1,6 10-6 |
(моль/л). |
[SO2 |
] |
0,01 |
|||||
|
4 |
|
|
|
|
|
|
Таким образом, после добавления сульфата калия растворимость сульфата свинца уменьшилась в 78,75 раз.
Константа устойчивости комплексного иона. Комплексные ионы диссоциируют в растворах как слабые электролиты, и этот процесс подчиняется закону действующих масс. Для количественной характеристики устойчивости комплексного иона используют константу равновесия реакции образования комплекса. Эта величина, называемая константой образования комплексного иона, обозначается символом . Например, для комплекса [Ag(NH3)2]+, образующегося по уравнению:
Ag+ + 2NH3  [Ag(NH3)2]+,
[Ag(NH3)2]+,
константа образования определяется следующим образом:
105

2 = [Ag(NH3 )2 ] 1,62 107 [Ag ][NH3 ]2
Комплексные ионы образуются ступенчато и каждой ступени отвечает своя константа устойчивости. Например,
Ag+ + NH3  [Ag(NH3)] +;
[Ag(NH3)] +;
[Ag(NH3)+] + NH3  [Ag(NH3)2] +;
[Ag(NH3)2] +;
Cоответственно ступенчатые константы устойчивости определяются уравнениями:
|
[Ag(NH3 ) ] |
3 |
|
[Ag(NH3 )2 ] |
3 |
|||
К1 = |
|
|
6,92 10 ; |
К2 = |
|
|
|
2,34 10 |
[Ag ][NH ] |
[Ag(NH |
) ][NH ] |
||||||
|
3 |
|
|
|
3 |
3 |
|
|
Очевидно, что константа образования равна произведению ступенчатых констант устойчивости комплексной частицы:
2 = К1·К2 = 1,62 107
7.3.4. Теория сильных электролитов
Рассмотренные выше закономерности, присущие слабым электролитам, не могут быть распространены на растворы сильных электролитов. В частности, сильные электролиты не подчиняются закону разбавления Оствальда. Теория, объясняющая поведение растворов сильных электролитов, была разработана П. Дебаем и Э. Хюккелем (1923 г.). В основе этой теории лежат следующие положения:
1.Реальная степень диссоциации сильных электролитов не зависит от концентрации и равна единице.
2.В растворах сильных электролитов реализуется электростатическое межионное взаимодействие. В результате вокруг каждого иона образуется атмосфера из ионов противоположного знака.
Межионное взаимодействие препятствует перемещению ионов в растворе, что влияет на физические свойства системы. Так, при пропускании через раствор электрического тока анионы будут тормозить перемещение катионов к катоду, а катионы - перемещение анионов к аноду. В результате наблюдаемая электропроводность раствора будет меньше величины, отвечающей полной диссоциации электролита в растворе.
3. Непосредственное измерение степени диссоциации сильного электролита дает не истинную, а кажущуюся степень диссоциации
αкаж < αист = 1
Первоначально полагали, что в растворах сильных электролитов вообще нет ионных агрегатов. Однако позже было установлено, что в концентрированных растворах может происходить ассоциация ионов. Агрегаты, образованные гидратированными ионами, называют ионными парами. Естественно, ионные пары по строению, свойствам и механизму образования не тождественны молекулам слабых электролитов.
Как указывалось выше, растворы сильных электролитов не подчиняются закону действующих масс. Выделить и количественно охарактеризовать каждый из факторов, обуславливающих это явление, не представляется возможным. Однако можно учесть суммарное влияние всех этих факторов, введя в теорию растворов представление об активности
106

(Г. Льюис, 1907 г.). Активность - это эффективная концентрация частицы, т.е. концентрация, соответственно которой частица проявляет себя в растворе.
Уравнения, базирующиеся на законе действующих масс, могут быть распространены на растворы сильных электролитов, если концентрации частиц, входящих в эти уравнения, заменить их активностями. Активность (а) связана с концентрацией следующим уравнением:
а = f·C,
где С - концентрация иона, соответствующая полной диссоциации электролита, f - коэффициент активности - параметр, суммарно отражающий результат действия всех силовых полей, возникающих в растворе. Коэффициенты активности в общем случае устанавливают экспериментально. В очень разбавленных растворах (С < 0,01 моль/л) коэффициенты активности мало зависят от природы иона и определяются только зарядом этого иона и ионной силой раствора. Ионной силой раствора (μ) называется полусумма произведений концентраций всех ионов, присутствующих в растворе, на квадрат заряда этих ионов (z):
μ = 0,5ΣСizi2
Ионная сила и коэффициент активности для разбавленных растворов связаны уравнением Дебая-Хюккеля:
lgf 0,5z2 
 μ 1
μ 1 
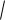 μ
μ
Пример. Рассчитать активности ионов в 0,01М растворе сульфата калия. В соответствии с уравнением диссоциации:
K2SO4 = 2K+ + SO 24
концентрации ионов калия и сульфат-иона в растворе составляет 0,02 и 0,01 моль/л, а ионная сила
μ 0,5(0,02 12 0,01 22 ) 0,03 (моль/л)
Тогда
lgf(K+) = 0,5 12 |
|
|
0,03 |
|
|
|
0,0738; |
f(K+) = 0,844; |
||||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||||
|
1 |
0,03 |
|
|
|
|||||||
а(K+) = f(K+)·С(К+) = 0,0168 моль/л |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|||
lgf(SO42-) = - 0,5 22 |
0,03 |
|
|
|
0,295; |
f(SO42-) = 0,507; |
||||||
|
|
|
|
|
|
|
|
|
||||
1 |
|
|
|
|
|
|
||||||
0,03 |
|
|||||||||||
|
|
|
|
|
||||||||
а(SO42-) = f(SO42-)·С(SO42-) = 0,00507 моль/л
7.3.5. Обменные реакции в растворах электролитов
Теория электролитической диссоциации показывает, что реакции в растворах электролитов фактически являются реакциями между ионами, на которые распадаются растворенные вещества. В связи с электростатическим взаимодействием разноименно заряженных частиц подобные реакции обычно характеризуются низкими энергиями активации и высокими скоростями. В большинстве своем ионные реакции обратимы, хотя зачастую очень сильно смещены в направлении образования продуктов реакции (практически необратимые процессы). Можно выделить две группы реакций в растворах электролитов: обменные реакции, протекающие без изменения степени окисления элементов, и окисли- тельно-восстановительные реакции, сопровождающиеся изменением степени окисления элементов. В настоящем разделе рассмотрен вопрос об обменных реакциях в растворах электролитов.
107
В зависимости от того, какие продукты образуются в результате связывания ионов, можно выделить четыре группы реакций обмена в растворах.
1. Реакции, сопровождающиеся образованием растворимых слабых электролитов.
Для процессов этого типа взаимодействие сводится к связыванию ионов в молекулы растворимого, но слабо диссоциирующего соединения (воды, слабых кислот и т.д.). Например, взаимодействие между ацетатом натрия и хлороводородной кислотой
CH3COONa + HCl = CH3COOH + NaCl
после учета диссоциации сильных электролитов (CH3COONa, HCl, NaCl) сводится к уравнению:
CH3COO- + H+ = CH3COOH
Образующимся слабым электролитом может быть также вода или слабо диссоциирующие соли. Например:
NaOH + HCl = NaCl + H2O; |
H+ + OH- = H2O; |
Hg(NO3)2 + 2KCl = HgCl2 + 2KNO3; |
Hg2+ + 2Cl- = HgCl2 |
2. Реакции, сопровождающиеся образованием малорастворимых соединений. Ниже
приведены примеры подобных реакций: |
|
|
|
|
|
|
|||||
|
AgNO3 + NaCl = AgCl↓ + NaNO3; |
Ag+ + Cl- = AgCl↓; |
|
||||||||
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl; |
Cu2+ + 2OH- = Cu(OH)2↓; |
||||||||||
Na WO |
+ H SO |
4 |
= H WO ↓ + Na SO ; |
WO 2 |
+ 2H+ = H |
WO ↓ |
|||||
2 |
4 |
2 |
2 |
4 |
2 |
4 |
4 |
2 |
|
4 |
|
3. Реакции, сопровождающиеся выделением газообразных продуктов. Примером по-
добных реакций может служить взаимодействие сульфида натрия с хлороводородной кислотой:
Na2S + 2HCl = 2NaCl + H2S↑; |
S2- + 2H+ = H2S↑ |
4. Реакции, сопровождающиеся образованием комплексных ионов. Ниже приведены примеры подобных реакций:
Hg(NO3)2 + 4KI = K2[HgI4] + 2KNO3; |
Hg2+ + 4I- = [HgI4]2-; |
BeCl2 + 4NaF = Na2[BeF4] + 2NaCl; |
Be2+ + 4F- = [BeF4]2- |
Обобщая сказанное, можно сформулировать следующее правило: реакции обмена в растворах электролитов протекают тогда, когда их продукты выводят ионы из зоны реакции.
Сравнительно с молекулярными, ионные уравнения значительно информативнее, так как в них фигурируют частицы, реально участвующие во взаимодействии. Так, например, составление ионных уравнений позволяет ответить на вопрос, почему реакции
HCl + NaOH |
= NaCl + H2O; |
||||
HNO3 |
+ KOH |
= KNO3 + H2O; |
|||
HClO4 + |
1 |
Ba(OH)2 |
= |
1 |
Ba(ClO4)2 + Н2О |
|
|
||||
2 |
|
2 |
|
||
имеют одинаковый тепловой эффект (-57,32 кДж/моль в стандартных условиях), хотя во взаимодействие вступают разные кислоты и основания. Действительно, во всех рассмотренных случаях в системах протекает один и тот же процесс, описываемый ионным уравнением:
H+ + OH- = H2O; |
Ho298 = -57,32 кДж/моль |
108

Точно так же реакции:
AgNO3 + HCl = AgCl↓ + HNO3;
AgClO4 + NaCl = AgCl↓ + NaNO3;
AgClO3 + NH4Cl = AgCl↓ + NH4ClO3
имеют одинаковый тепловой эффект, так как сводятся к одному ионному уравнению:
Ag+ + Cl- = AgCl↓; |
Ho298 = -65,5 кДж/моль. |
7.4.6. Гидролиз солей
Одним из типов обменных реакций в растворах являются реакции гидролиза, т.е. реакции обменного взаимодействия вещества с водой. Гидролизу подвергаются различные классы неорганических и органических соединений: бинарные соединения неметаллов, соли, сложные эфиры, углеводы и т.д. Примером реакции гидролиза может служить, например, гидролиз сульфида кремния:
SiS2 + 4H2O = H4SiO4 + 2H2S
В настоящем разделе рассмотрен вопрос о гидролизе солей в водных растворах. Гид-
ролизом соли называется обменное взаимодействие ионов соли с молекулами воды.
Механизм гидролиза. Гидролиз является следствием поляризационного взаимодействия ионов соли с молекулами воды, гидратирующими данный ион. Гидролизу могут подвергаться как катионы, так и анионы соли. Катионы гидратируются за счет присоединения молекул воды по донорно-акцепторному механизму. Пусть катион Xz+ присоединяет 4 молекулы воды, выступая акцептором электронных пар кислорода, а одна из координированных молекул воды образует водородную связь с внешнесферной молекулой воды (рис. 35а). Катион Xz+ поляризует координированную молекулу Н-О′-Н′, причем индуцированный в молекуле воды диполь ориентирован отрицательным полюсом к иону Хz+, а положительным - к атомам водорода. В результате связь О' Н′ ослабевает и разрывается, а водородная связь Н′∙∙∙О″ упрочняется и переходит в ковалентную. В растворе увеличивается концентрация отщепляемых ионов гидроксония. Гидролиз катиона, таким образом, протекает по уравнению:
Xz+ + H2O |
|
XOH(z-1)+ + H+ |
|
Катион гидратируется тем сильнее, чем больше его поляризующее действие, т.е. чем выше положительный заряд иона и меньше его радиус. Таким катионам соответствуют слабые основания.
Анионы гидратируются за счет образования водородных связей (рис. 35б). Взаимодействие отрицательного заряда аниона с диполем молекулы воды приводит к усилению акцепторных свойств атома водорода Н′. В результате водородная связь Y∙∙∙Н′ переходит в ковалентную, а полярная связь О″- Н′ разрывается. Гидролиз аниона протекает по уравне-
нию:
Yz- + H2O  HY(z-1)- + OH-,
HY(z-1)- + OH-,
а раствор приобретает щелочную реакцию. Анион гидролизуется тем сильнее, чем выше его отрицательный заряд и меньше радиус. Легко гидролизующимся анионам соответствуют анионы слабых кислот.
Z+ |
(Z-1)+ |
|
|
|
H2O |
|
|
|
|
|
H |
|
H2O |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
а) |
|
H O |
X |
O' |
|
H' ... |
... O'' |
|
|
|
|
H O X |
|
|
|
|
+ |
H O+ |
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
O' H' |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|||||||
|
2 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
||
|
|
|
|
H |
|
H |
|
|
|
|
|
|
|
|
|||||
|
|
|
H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
109

|
|
|
|
Z- |
|
|
|
|
|
|
|
|
|
(Z-1)- |
|
.. |
|
|
|
|
|
H |
|
|
.. |
|
+ OH- |
||
|
|
|
|
|
|
|
|
|
||||||
б) |
|
: Y : .. |
.. |
H' |
|
O" |
|
|
|
|
: Y : H' |
|||
|
|
|
|
|||||||||||
|
|
|
|
|||||||||||
|
.. |
|
|
|
|
|
|
|
.. |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 35. Механизм гидролиза солей по катиону (а) и аниону (б).
По характеру гидролиза соли можно разделить на три типа.
1. Соли, образованные слабыми кислотами и сильными основаниями, например,
CH3COONa, K2S, Ca(NO2)2. В случае подобных соединений соль гидролизуется по аниону, а раствор приобретает щелочную реакцию (рН > 7). Так гидролиз ацетата натрия протекает по уравнению:
CH3COO- + H2O  CH3COOH + OH-;
CH3COOH + OH-;
или
CH3COONa + H2O  CH3COOH + NaOH
CH3COOH + NaOH
2. Соли, образованные сильными кислотами и слабыми основаниями, например, NH4Cl, AlCl3, Zn(NO3)2. Для таких солей происходит гидролиз по катиону, в результате чего раствор приобретает кислую реакцию (рН < 7). Например, гидролиз хлорида аммония описывается уравнениями:
NH 4 + H2O  NH3∙H2O + H+;
NH3∙H2O + H+;
NH4Cl + H2O  NH3∙H2O + HCl
NH3∙H2O + HCl
Продуктом гидролиза является гидратированный аммиак.
3. Соли, образованные слабыми кислотами и слабыми основаниями, (апример,
CH3COONH4, Al2S3, Fe(CH3COO)3. В этом случае гидролизу подвергаются и катион, и анион. Реакция среды будет определяться относительной силой образующихся кислоты и основания; раствор может быть нейтральным, слабокислым, слабощелочным. Так, ацетат аммония гидролизуется по уравнениям:
NH 4 + CH3COO- + H2O  NH3∙H2O + CH3COOH;
NH3∙H2O + CH3COOH;
CH3COONH4 + H2O  NH3∙H2O + CH3COOH
NH3∙H2O + CH3COOH
Поскольку константы ионизации уксусной кислоты и гидратированного аммиака одинаковы (1,8∙10-5), раствор ацетата аммония имеет нейтральную реакцию.
Если катион или анион многозарядны, то гидролиз протекает ступенчато. Так катион алюминия гидролизуется в три стадии:
Al3+ + H2O |
|
|
|
Al(OH)2+ + H+; |
|||||
|
|
|
|||||||
Al(OH)2+ + H O |
|
|
|
|
Al(OH) |
+ H+; |
|||
|
|
|
|||||||
|
2 |
|
|
|
2 |
|
|||
Al(OH) |
+ H O |
|
|
|
Al(OH) |
3 |
+ H+ |
||
|
|
|
|||||||
2 |
2 |
|
|
|
|
|
|
||
В данном случае доминирующей обычно является первая стадия, т.е. гидролиз иона с максимальным значением заряда, причем процесс этот обратим. Однако в некоторых случаях при растворении соли может наблюдаться полный гидролиз, сопровождающийся превращением соли в соответствующие кислоту и основание. Полному гидролизу подвергаются соли, образованные очень слабыми кислотой и основанием, особенно если один из продуктов гидролиза выделяется в виде газа. Например, сульфид алюминия не может существовать в водных растворах в связи с количественным протеканием реакции:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
110
