
OBSchAYa_KhIMIYa
.pdf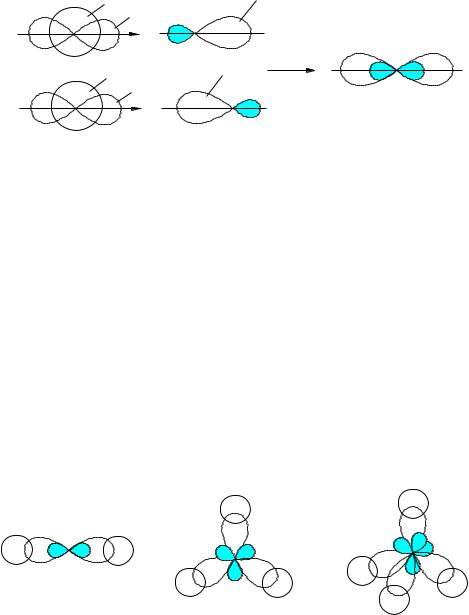
|
|
|
|
|
|
|
|
(+) |
|
|
|
|
|
|
|
|
|
|
sp |
|
|
|
|
|
|
|
s |
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
- |
+ |
px |
- |
+ |
|
|
|
|
|
|
x |
|
|
|
x |
|
|
|
||||
|
|
|
|
- |
+ |
|
|
|
|
||
|
|
+ |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(-) |
|
+ - |
- + |
||
|
|
|
|
|
|
|
+ |
- |
- |
+ |
|
|
|
|
s |
|
|
sp |
|
|
|
||
|
|
+ |
|
|
|
|
|
|
|
|
|
|
+ |
- |
px |
+ |
|
- |
|
|
|
|
|
x |
|
|
|
x |
|
|
|
||||
|
|
|
|
+ |
|
- |
|
|
|
||
|
|
+ |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 6. Построение sp-гибридных орбиталей.
Как уже отмечалось, образовавшиеся гибридные орбитали ориентируются в пространстве так, чтобы силы отталкивания между находящимися на них электронами были минимальными. В случае sp-гибридизации гибридные орбитали ориентируются по одной оси в разные стороны, а угол между ними составляет 180 . sp-Гибридизации соответствует образование линейных молекул, примером которых может служить молекула газообразного гидрида бериллия (рис. 7а).
В случае sp2-гибридизации смешиваются s- и две р-орбитали. Полученные при этом асимметричные гибридные орбитали лежат в одной плоскости, образуя равносторонний треугольник; угол между ними составляет 120 . sp2-Гибридизации подвергается, например, атом бора в молекуле ВН3, имеющей форму равностороннего треугольника (рис. 7б). Следует отметить, что молекула ВН3 нестабильна и существует лишь в газовой фазе при высокой температуре, при обычных температурах она димеризуется в диборан В2Н6.
При sp3-гибридизации из s- и трех р-орбиталей образуется четыре гибрида, направленные от центра тетраэдра к его вершинам. Валентный угол в молекулах с sp3- гибридизацией центрального атома составляет 109,5 ; примером частиц с данным типом гибридизации может служить молекула метана (рис. 7в).
|
|
. |
|
. |
|
|
|
|
|
. |
. |
|
|
|
|
. |
. |
. |
. |
|
|
|||
|
|
б |
|
. |
|
а |
|
в |
|
|
|
|
||
|
|
|
|
Рис. 7. Строение молекул BeH2 (а), BH3 (б) и CH4 (в).
Некоторые типы гибридизации с участием d-орбиталей представлены в табл. 4, в которой приведены геометрия, значения валентных углов и примеры молекул и ионов, центральный атом которых подвергается данному типу гибридизации. Как правило, все орбитали, образующиеся при гибридизации данного типа, эквивалентны как по значениям валентных углов, так и по длине образующихся связей. Исключением является sp3d- гибридизация, в случае которой пять гибридных орбиталей образуют тригональную бипирамиду. При этом три орбитали располагаются в экваториальной плоскости (экваториальные орбитали), а две орбитали направлены перпендикулярно этой плоскости (аксиальные орбитали). Валентные углы, отвечающие этому типу гибридизации, не одинаковы (120 между экваториальными орбиталями, 180 между аксиальными орбиталями и 90 между экваториальными и аксиальными орбиталями). Связи, образованные за счет экваториальных и аксиальных орбиталей, несколько отличаются как по длине, так и по энергии. Так, в молекуле PСl5 длина связей P-Cl равна 202 пм для экваториальных и 212 пм для аксиальных орбиталей.
31
Таблица 4.
Некоторые типы гибридизации с участием s-, p- и d-орбиталей
Тип |
Геометрия |
Валентные |
Примеры |
||||
гибридизации |
углы, |
||||||
|
|
||||||
sp |
|
|
Прямая линия |
180 |
BeF2 |
||
|
|
|
|
|
|||
sp2 |
|
Треугольник |
120 |
BF3 |
|||
|
|
|
|
|
|||
sp3 |
|
Тетраэдр |
109,5 |
[BF4]1- |
|||
|
|
|
|
|
|||
d3s |
|
Тетраэдр |
109,5 |
[MnO4]1- |
|||
|
|
|
|
|
|
||
dsp |
2 |
Квадрат |
90, 180 |
1- |
|||
|
|
|
[AuCl4] |
||||
sp3d |
Тригональная |
90, 120, 180 |
PCl5 |
||||
|
|
|
|
бипирамида |
|
|
|
sp3d |
Тетрагональная |
90, 180 |
[Ni(CN)5]3- |
||||
|
|
|
|
пирамида |
|
|
|
3 |
d |
2 |
Октаэдр |
90, 180 |
SF6 |
||
sp |
|
|
|||||
На гибридных орбиталях могут находиться неспаренные электроны и электронные пары, гибридные орбитали могут оставаться вакантными. Наличие в образовавшейся молекуле неподеленных пар на гибридных орбиталях оказывает влияние на геометрию частицы, искажая валентные углы, соответствующие данному типу гибридизации. Неподеленная пара электронов менее оттянута от ядра центрального атома, чем связывающая, находящаяся между ядрами. В связи с этим неподеленная электронная пара оказывает большее отталкивающее действие на другие электронные пары, нежели связывающая. В результате углы между орбиталями, занятыми связывающими парами, уменьшаются, а неподеленными - увеличиваются. В качестве примера рассмотрим строение молекул аммиака и воды (рис. 8). При образовании молекулы аммиака атом азота подвергается sp3-гибридизации; на четырех гибридных орбиталях распределяются пять электронов, что приводит к появлению неподеленной электронной пары; соответственно молекула аммиака имеет форму тригональной пирамиды (рис. 8а). Валентный угол, отвечающий sp3-гибридизации, должен быть равен 109,5 , однако наличие неподеленной электронной пары приводит к его сжатию до 107,3 .
Образование молекул воды также сопровождается sp3-гибридизацией орбиталей атома кислорода; две из четырех гибридных орбиталей заполняют неподленные пары, а остальные используются на образование связей О-Н по обменному механизму. В результате молекула воды имеет угловую форму, а валентный угол сжимается до 104,5 .
N  O
O
H |
. |
|
. |
|
|
. |
|
|
|
|
|||
|
|
|
|
|
H |
|
|
|
|
H |
|
. |
|
|
H |
. |
H |
104,5o |
||
|
107,3o |
|
||||
|
|
|
|
|
||
|
|
|
а |
|
|
б |
Рис. 8. Строение молекул NH3 (а) и H2O (б).
Когда центральный атом в молекуле использует неподеленную пару для образования связи по донорно-акцепторному механизму, сжатие валентного угла исчезает. Так, присо-
32

единение аммиаком иона водорода приводит к образованию тетраэдрического иона NH4+, все валентные углы в котором равны 109,5 .
H+
+
|
|
|
|
H |
|
H |
N |
H |
H |
N |
H |
|
|
||||
|
H |
|
|
H |
|
Ион гидроксония, образующийся при присоединении иона водорода к молекуле воды, имеет форму тригональной пирамиды, для которой валентные углы НОН равны 109,0 .
При образовании молекул может наблюдаться расширение валентных углов. Это явление имеет место тогда, когда на одной из гибридных орбиталей молекулярной частицы остается неспаренный электрон. Например, атом азота в молекуле NO2, подвергается sp2- гибридизации, две гибридные орбитали используются на образование связей с атомами кислорода, а на третьей сохраняется неспаренный электрон, который слабее отталкивает связывающие электронные пары, чем неподеленная пара. В результате валентный угол в молекуле диоксида азота составляет 131 , а не 120 .
3.2.4. Кратность ковалентной связи
Между двумя атомами в молекуле возможно образование не только одной, но и нескольких локализованных связей. Ковалентные связи, осуществляемые двумя и более электронными парами называются кратными связями, в отличие от связи, осуществляемой одной электронной парой, называемой одинарной. Число электронных пар, связывающих два атома, называется кратностью связи.
При образовании кратных связей всегда соблюдается следующее правило: электронные облака взаимодействующих атомов, образующие кратные связи не могут перекрываться в одном и том же направлении, т.е. иметь одинаковое расположение в пространстве. Так, например, если между двумя атомами, ядра которых лежат на оси х образовалась связь в результате перекрывания двух px-орбиталей, то вторая связь за счет перекрывания s- или dx 2 y2 -орбиталей возникнуть не может, так как эти орбитали перекрываются
втом же направлении, что и px-орбитали.
Взависимости от характера перекрывания различают три вида ковалентной связи.
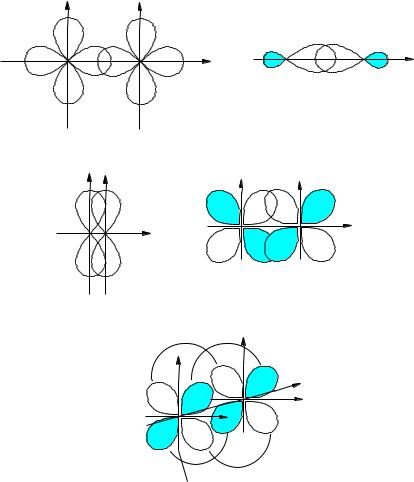
Сигма-связь ( -связь). Перекрывание валентных орбиталей происходит вдоль линии связи, т.е. линии, соединяющей ядра взаимодействующих атомов. -Связь может быть образована орбиталями любого типа, если эти орбитали перекрываются по линии связи. Наиболее прочная -связь образуется за счет гибридных орбиталей, в силу этого образованию -связи обычно предшествует гибридизация, если последняя возможна. На рис. 9а приведены примеры перекрывания атомных орбиталей, приводящие к образованию - связей.
Пи-связь ( -связь). Перекрывание орбиталей происходит в направлении, перпендикулярном линии связи (боковое перекрывание). Образующееся при этом связывающее элек-
тронное облако имеет плоскость, включающую линию связи и одну из координатных осей. Поскольку линии связи перпендикулярны две оси, между атомами могут возникнуть две -связи, для которых электронные облака не будут пространственно совмещаться. - Связь может образовываться за счет р- и d-орбиталей (рис. 9б). Прочность -связи меньше прочности -связи, тем не менее образование -связей дополнительно стабилизирует молекулу.
33
a) |
y |
|
|
y |
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
+ |
|
+ |
+ |
- |
+ |
+ |
- |
x |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
x |
|
|
|
|
|
|
- |
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
(spx)a - (spx)b |
|
|
|
|
(dx2-y2)a - (dx2-y2)b |
|
|
|
|
|
|
|||
|
z |
z |
|
|
|
z |
z |
|
|
|
б) |
+ |
|
+ |
|
- |
|
|
- |
|
|
|
|
|
+ |
+ |
|
|
||||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
x |
|
|
|
x |
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
+ |
- |
+ |
|
|
|
|
- |
|
- |
|
|
|
|
|
|
|
|
(pz)a - (pz)b |
|
|
(dxz)a - (dxz)b |
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
y |
|
|
|
|
|
|
|
|
|
y |
|
|
|
|
|
|
в) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
- |
z |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
+ |
- |
|
x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- |
x - |
+ |
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
(dxy)a - (dxy)b |
|
|
|
|
|
Рис. 9. Перекрывание электронных орбиталей при образовании - (а), - (б) и |
||||||||||
|
|
|
|
|
-связей (в). |
|
|
|
|
|
Дельта-связь ( -связь). Перекрывающиеся орбитали расположены в двух параллельных плоскостях, перпендикулярных линии связи. -Связь может образоваться в результате перекрывания d xy -орбиталей взаимодействующих атомов, если линией связи является ось
z (рис. 9в); при этом между двумя атомами возможно образование только одной -связи. Таким образом, максимальная теоретически возможная кратность связи между двумя
атомами равна четырем: одна -, две - и одна -связь.
В качестве примера соединения с - и -связями можно привести молекулу азота N2. Атом азота, имеющий электронную конфигурацию 1s22s22p3, характеризуется наличием на валентных энергетических подуровнях электронной пары и трех неспаренных электронов. Наиболее выгодным типом гибридизации в данном случае является sp-гибридизация, при которой сохраняются две "чистые" р-орбитали, обеспечивающие образование двух - связей:
2s |
|
|
2p |
|
|
|
|
|
|
|
|
|
|
|
sp-гибридизация
На двух sp-гибридных орбиталях каждого атома азота распределяются три электрона (электронная пара и неспаренный электрон); электронные пары остаются неподеленными, а непарные электроны образуют -связь, направленную по оси х. Неспаренные электроны
34
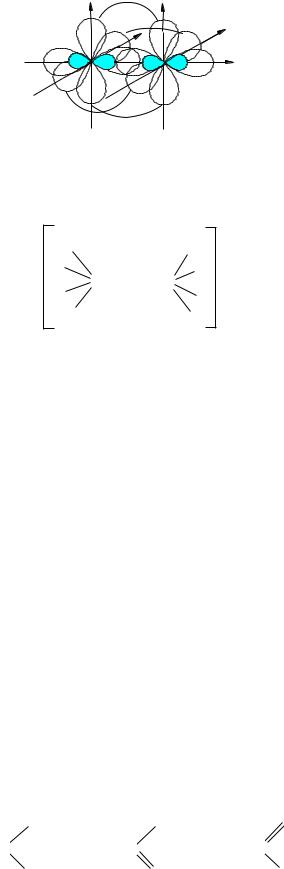
образуют две -связи, ориентированные взаимно перпендикулярно. Структура молекулы :N N: приведена на рис. 10.
z |
z |
|
z |
N |
|
y |
y |
|
|
||
|
|
|
x |
|
|
|
N |
y |
|
|
|
Рис. 10. Строение молекулы азота. |
|||
-Связь реализуется значительно реже, чем - и -связи. Примером соединения с - связью может служить ион [Re2Cl8]2-:
2-
Cl |
|
|
|
Cl |
|
Cl |
|
|
|
|
Cl |
Re |
|
|
|
Re |
|
|
|
|
|||
|
|
||||
Cl |
|
|
|
Cl |
|
|
|
|
|
|
|
Cl |
|
|
|
Cl |
|
|
|
|
|
|
|
3.2.5. Делокализованные многоцентровые связи. Теория резонанса
Используя концепцию двухэлектронных локализованных связей, можно построить структурные формулы большинства ковалентных соединений. Однако полученный результат не всегда достаточно хорошо согласуется с экспериментальными данными, в связи с чем представление о связях, соединяющих два атома пришлось дополнить представлениям о связях, объединяющих три, четыре и более атома. Подобные связи получили название делокализованных многоцентровых связей.
Рассмотрим вопрос об образовании многоцентровых связей на примере строения кар- бонат-аниона. Ион СО32- формально можно представить как результат соединения атома углерода, атома кислорода и двух однозарядных анионов кислорода, распределение электронов в которых показано ниже:
2s |
|
|
|
2p |
|
|
2s |
|
|
2p |
|
|
2s |
|
|
|
2p |
|
||
С |
|
|
|
|
|
|
О |
|
|
|
|
|
|
О- |
|
|
|
|
|
|
|
|
sp2-гибридизация |
|
sp2-гибридизация |
|
|
|
sp3-гибридизация |
|
|||||||||||
Определим строение карбонат-аниона, используя представление о локализованных двухцентровых связях. Для этого необходимо предположить, что атомы углерода и кислорода, не несущие заряда, подвергаются sp2-гибридизации, что позволяет им соединиться двойной связью; ионы О- в состоянии sp3-гибридизации образуют с углеродом лишь по одной -связи. В результате ион СО32- должен иметь форму равнобедренного треугольника, поскольку в образовавшейся частице двойная связь короче одинарных. В действительности же ион СО32- имеет форму равностороннего треугольника. Причиной наблюдаемого противоречия является произвольный выбор атома кислорода, присоединенного двойной связью. Действительно, иону СО32- отвечают три равноценные формы:
|
|
|
|
O- |
O- |
|
O- |
- |
O |
|
|
|
|
|
|
|
|
|
|||
O |
|
|
|
Ñ |
|
Ñ |
O |
|
Ñ |
|
|
|
|
|
|||||||
|
|
|
|
|
||||||
|
|
|
|
O- |
|
|
O |
|
|
O- |
35

Подобные формы принято называть каноническими. Картина, отвечающая истинному строению иона СО32-, не соответствует ни одной из этих структур. Для описания таких частиц метод валентных связей использует специальный прием, получивший название «резонанса валентных схем» (Л. Полинг). Согласно теории резонанса реальная структура частицы является наложением всех ее канонических форм:
|
|
|
|
O- |
|
|
|
- |
|
|
|
O |
|
|
|
|
|
|
|
O- |
|
O |
- |
||||
O |
|
|
|
Ñ |
|
|
|
|
|
||||
|
|
|
|
|
Ñ |
|
O |
|
Ñ |
|
|||
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
||||||||
|
|
|
|
O - |
|
|
|
O |
|
|
|
O |
- |
|
|
|
|
|
|
|
|
|
|
|
|
||
Согласующийся с экспериментальными данными результат можно получить, если предположить, что в карбонат-ионе происходит одновременное перекрывание четырех pz- орбиталей (если частица расположена в плоскости ху) всех атомов кислорода и атома углерода, приводящее к образованию четырехцентровой -связи, охватывающей всю частицу. Делокализованную -связь обозначают пунктиром. Одновременно происходит делокализация отрицательного заряда на все атомы кислорода, в результате чего строение СО32- выражается следующей формулой:
|
-2/3 |
|
|
2- |
|
О |
|
|
О |
-2/3 О |
С |
-2/3 |
|
С |
О |
О |
О |
3.2.6. Неполярные и полярные связи. Типы ковалентных молекул
Пусть между атомами А и В, электроотрицательности которых равны А и В, образуется локализованная ковалентная связь. При этом в зависимости от значений А и В возможны три случая:
1.А и В равны или очень близки по значениям. Образующаяся при этом общая электронная пара в равной мере принадлежит обоим взаимодействующим атомам, а возникающее электронное облако симметрично относительно ядер атомов А и В. Подобная связь называется неполярной. Неполярная связь реализуется в гомоядерных молекулах, напри-
мер, в молекулах Cl2, P4, S8. Примером гетероядерной связи, очень близкой к неполярной, может служить связь Р-Н в молекуле фосфина РН3 (электроотрицательности водорода и фосфора по Полингу равны соответственно 2,20 и 2,19).
2.А и В умеренно отличаются друг от друга. В этом случае общая электронная пара смещается в сторону атома с большей электроотрицательностью, в результате чего связь становится асимметричной. Такая связь называется полярной. Вследствие несимметричного распределения электронной плотности относительно ядер А и В полярная связь представляет собой диполь - электронейтральную систему, в которой центры тяжести положительного и отрицательного заряда не совпадают. Как и любому диполю, полярной связи присущи три количественные характеристики:
а) заряд, возникающий на полюсе диполя (q), по величине соизмерим с зарядом электрона (1,60 10-19 Кл),
б) длина диполя ( ), равная расстоянию между полюсами диполя; эта величина принимает значения в пределах от нуля до 10-10 м;
в) дипольный момент, представляющий собой произведение абсолютного значения заряда полюса на длину диполя:
= q
Дипольный момент является вектором, направленным от положительного полюса к отрицательному. Единица дипольного момента имеет размерность Кл м; обычно диполь-
36

ные моменты представляют собой величину порядка 10-30 Кл м. На практике часто используется внесистемная единица - Дебай (D): 1D = 3,33 10-30 Кл м. Значение дипольного момента относительно легко определяют экспериментально, измеряя диэлектрическую проницаемость вещества при разных температурах. Дипольные моменты некоторых молекул приведены в табл. 5.
Таблица 5.
Дипольные моменты некоторых молекул
Молекула |
1030, Кл м |
Молекула |
1030, Кл м |
|
|
|
|
H2 |
0 |
CO2 |
0 |
N2 |
0 |
H2O |
6,10 |
O2 |
0 |
H2S |
3,40 |
HF |
6,36 |
NO2 |
0,97 |
HCl |
3,42 |
NH3 |
4,94 |
HBr |
2,63 |
PH3 |
1,83 |
HI |
1,40 |
NF3 |
0,70 |
CO |
0,33 |
CCl4 |
0 |
NO |
0,53 |
CHCl3 |
3,17 |
O3 |
1,73 |
|
|
|
|
|
|
3. А и В очень сильно отличаются друг от друга. В этом случае связывающая электронная пара переходит к атому с большей электроотрицательностью, в результате чего этот атом превращается в отрицательный ион, а его партнер - в положительный. Между образовавшимися ионами действуют электростатические силы, не связанные с перекрыванием электронных орбиталей. Возникающая при этом связь называется ионной.
Ковалентные молекулы могут содержать одну или несколько связей одинаковой или различной полярности. Векторная сумма дипольных моментов всех связей и неподеленных пар молекулы называется дипольным моментом молекулы. По значениям дипольных моментов молекулы могут быть подразделены на два типа:
1)неполярные молекулы, для которых дипольный момент равен нулю;
2)полярные молекулы, для которых дипольный момент принимает значения отличные от нуля.
Асимметричное распределение электронной плотности в молекуле по направлению полярных связей можно учесть, приписав атомам в молекуле некоторый эффективный за-
ряд (не путать с эффективным зарядом ядра). Эффективный заряд атома в молекуле можно рассматривать как меру полярности ковалентной связи. Так, например, для молекулы хлороводорода эффективный заряд на атоме хлора составляет -0,18 эл.ед., а на атоме водорода +0,18 эл.ед.
Полярность молекул определяется не только полярностью связей, но и геометрией частицы. Так, например, в молекулах BeF2 и H2O связи Be-F и Н-О полярны, однако дипольный момент молекулы фторида бериллия равен нулю, а для воды составляет 6,1 10-30 Кл м. Это явление объясняется тем, что для линейной молекулы BeF2 векторная сумма двух противоположно направленных дипольных моментов равна нулю. Молекула воды - угловая молекула, в результате сумма дипольных моментов связей Н-О нулю не равняется.
|
|
|
|
|
|
|
|
2 |
|
|
2 |
|
|
|
O |
|
|||
F |
|
|
Be |
|
|
F |
|
||
|
|
|
|
H |
|
H |
|||
|
|
|
|
|
|
|
|
|
|
Be-F |
|
|
Be-F |
HO |
|
HO |
|||
На полярность молекул оказывает также влияние ориентация дипольных моментов неподеленных электронных пар молекулы. Так, молекулы NH3 и NF3, имеющие одинаковую
37

форму, существенно отличаются по полярности (рис. 11). Это объясняется тем, что электроотрицательность азота выше электроотрицательности водорода, но ниже электроотрицательности фтора. В результате в молекуле аммиака дипольные моменты связей N-H направлены от водорода к азоту; суммирование их с дипольным моментом неподеленной пары приводит к увеличению дипольного момента молекулы NH3. В случае молекулы трифторида азота дипольные моменты связей N-F и неподеленной пары направлены в противоположные стороны и при сложении частично компенсируют друг друга.
|
.. |
|
|
|
|
|
|
.. |
|
|
|
|
|
N |
|
|
|
|
|
|
N |
|
|
|
|
H |
|
|
H |
|
|
|
F |
|
|
F |
|
|
|
H |
|
|
|
|
|
F |
|
|
|
|
|
|
= 4,9 |
. |
-30 . |
м |
|
|
. |
-30 |
. |
м |
||
NH |
10 |
Кл |
NF |
= 0,7 10 |
|
Кл |
||||||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
Рис. 11. Дипольные моменты связей и неподеленной электронной пары в молекулах NH3 и NF3.
Если та или иная молекула испытывает действие внешнего электростатического поля, в ней происходит перераспределение электронной плотности, центры тяжести положительного и отрицательного заряда смещаются, в результате чего неполярная молекула может стать полярной, а дипольный момент полярной молекулы возрастает. Этот процесс называется поляризацией молекулы, а возникающий при этом диполь - наведенным или индуцированным диполем. Значение индуцированного диполя зависит от природы молекулы и напряженности поля (Е):
Е = Е
Величина в приведенном уравнении называется поляризуемостью молекулы. Чем больше поляризуемость, тем легче деформируется молекула под воздействием внешнего поля. Источником внешнего электрического поля могут являться ионы или полярные молекулы, окружающие деформируемую частицу.
3.2.7. Недостатки метода валентных связей
Наряду с очевидными достоинствами, методу валентных связей присущи определенные ограничения и недостатки.
1.Метод ВС не способен объяснить существование частиц, связь в которых осуществ-
ляется за счет одного электрона (одноэлектронная связь). Примером таких частиц может служить молекулярный катион водорода Н2+; эта частица существует в газовой фазе и характеризуется определенными длиной и энергией связи (106 пм, 255,7 кДж/моль).
2.Метод ВС не всегда адекватно отражает физические свойства молекул, в частности,
их магнитное поведение. Так, по методу ВС молекула О2 должна быть диамагнитной, так как все электроны в ней спарены. Реально же молекулярный кислород парамагнитен, причем магнитная восприимчивость молекулы кислорода соответствует наличию в ней двух неспаренных электронов.
3.Метод ВС не рассматривает возбужденные состояния молекул, в силу чего не может быть использован для объяснения спектров поглощения веществ и присущей им окраски.
4.При качественной характеристике химической связи метод ВС прост и нагляден, однако математический аппарат метода весьма сложен и неудобен для выполнения количественных расчетов с использованием ЭВМ.
3.3.Предсказание геометрической формы молекул. Метод Гиллеспи
Представления о направленности связи и теория гибридизации электронных орбиталей
позволяют объяснить геометрическую форму молекул веществ с ковалентными связями,
38
но не могут предсказать ее. Теоретический расчет геометрической конфигурации частицы квантово-механическими методами представляет собой очень сложную и не всегда имеющую однозначное решение задачу. Однако существует довольно простой прием, позволяющий с достаточно высокой надежностью качественно оценить геометрию молекул. Этот прием был разработан Р. Гиллеспи и получил название: метод отталкивания электронных пар валентной оболочки. Метод связывает форму частицы с силами отталкивания, действующими между электронными парами, сформированными при образовании соответствующей молекулы. Метод Гиллеспи особо результативен для молекул, образованных s- и р-элементами.
Концепция отталкивания электронных пар валентной оболочки может быть сведена к следующим основным положениям:
1.Геометрическая форма молекулы определяется числом электронных пар валентной оболочки (ЭПВО), в которые не включают электронные пары, образующие -связи.
2.Электронные пары валентной оболочки ориентируются так, чтобы отталкивание между ними было минимально.
3.Неподеленные электронные пары занимают больший объем околоядерного пространства, чем связывающие. Следствием неэквивалентности неподеленных и связывающих электронных пар является искажение валентных углов.
Чтобы определить число ЭПВО необходимо сложить число валентных электронов данного атома с числом электронов, предоставленных присоединенными атомами, а затем
из полученной суммы вычесть число электронов, образующих -связи, и разделить полученный результат на два. Так, для молекулы СО2, имеющей две - и две -связи, каждый атом кислорода предоставляет по два электрона на образование связей с атомом углерода, а атом углерода предоставляет по два электрона на образование связей с каждым атомом кислорода. Соответственно число ЭПВО для атома углерода равно 2:
NЭПВО (С) = |
4 + 2 2 - 2 2 |
= 2 |
|
2 |
|||
|
|
Число связывающих ЭПВО равно числу -связей, образуемых центральным атомом (N ); разность равна числу неподеленных электронных пар: Nнп = NЭПВО - N .
Идеальные геометрические формы, отвечающие различным значениям числа ЭПВО и неподеленных электронных пар, приведены в табл. 6, в скобках указан атом, для которого определяется тип гибридизации.
Если валентная оболочка атома в молекуле включает две электронные пары, два одноименных точечных заряда, оказавшись на поверхности сферы, расположатся на концах диаметра большого круга. Соответственно две ЭПВО должны занять орбитали, обеспечивающие валентный угол 180 , что согласно методу валентных связей отвечает spгибридизации атомных орбиталей. Максимальному удалению и минимальному отталкиванию трех ЭПВО будет отвечать ориентация орбиталей от центра к вершинам равностороннего треугольника (sp2-гибридизация). Четырем ЭПВО соответствует тетраэдрическая конфигурация (sp3-гибридизация). В случае пяти ЭПВО наиболее выгодным является распределение электронных пар по направлениям к вершинам тригональной бипирамиды (sp3d-гибридизация), шести ЭПВО соответствует октаэдрическая конфигурация (sp3d2- гибридизация).
При наличии неподеленных электронных пар геометрия молекулы изменяется в зависимости от их числа. Как видно из табл. 6, в случае трех ЭПВО молекулы могут быть угловыми (Nнп = 1) и линейными (Nнп =2). Наличие в валентной оболочке четырех электронных пар допускает образование тригонально-пирамидальных при Nнп = 1, угловых при Nнп
= 2 и линейных (Nнп = 3) молекул.
Если число ЭПВО равно пяти и все пары являются связывающими, молекула имеет форму тригональной бипирамиды. При наличии неподеленных электронных пар необходимо знать, какие орбитали, аксиальные или экваториальные, будут заняты ими. Расчет
39

показывает, что более выгодным является экваториальное положение. Действительно, занимающие экваториальное положение неподеленные пары имеют только двух ближайших соседей под углом 90 , тогда как при аксиальном положении таких соседей было бы три, что привело бы к более сильному отталкиванию. В результате молекула с одной неподеленной парой имеет форму бисфеноида (искаженный тетраэдр), с двумя - Т-форму, а трем неподеленным парам соответствуют линейные молекулы.
Таблица 6.
Геометрия молекул s- и p-элементов
|
Тип |
|
|
Число неподеленных пар |
|
|
||||
NЭПВО |
гибридиза- |
|
0 |
1 |
|
2 |
3 |
|
||
|
ции |
|
|
|
||||||
|
|
|
|
|
|
|
|
|||
|
|
|
|
÷ |
× |
|
|
|
|
|
2 |
sp |
|
линейная |
линейная |
|
|
|
|||
|
|
|
|
BeF2 (Be) |
AlF (Al) |
|
|
|
|
|
|
|
|
|
|
÷ |
|
|
|
|
|
3 |
sp2 |
|
|
|
÷ |
÷ |
÷ |
|
|
|
|
|
|
|
÷ |
÷ |
|
|
|
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
угловая |
|
линейная |
|
|
|
|
|
|
треугольник |
|
NH (N) |
|
|
||
|
|
|
|
SnCl2 (Sn) |
|
|
||||
|
|
|
|
|
BF3 (B) |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
÷ |
|
|
|
|
|
4 |
sp |
3 |
|
÷ |
÷ |
÷ |
÷ |
÷ |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
÷ |
÷ |
|
÷ |
÷ |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
тетраэдр |
тригональная |
угловая |
линейная |
|||
|
|
|
|
пирамида |
||||||
|
|
|
|
|
CF4 (C) |
Н2О (О) |
IF (I) |
|||
|
|
|
|
|
NH3 (N) |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
÷ |
÷ |
|
÷ |
÷ |
|
|
|
|
|
÷ |
|
÷ |
|
|
|
|
|
|
|
|
÷ |
÷ |
|
|
÷ |
|
|
|
|
|
|
|
÷ |
|
|
|
||
5 |
sp3d |
|
|
|
|
|
||||
|
÷ |
|
|
|
|
|
||||
|
|
|
|
|
÷ |
|
÷ |
|
|
|
|
|
|
|
|
|
|
÷ |
|
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
тригональная |
бисфеноид |
T-форма |
Линейная |
|||
|
|
|
|
бипирамида |
||||||
|
|
|
|
SF4 (S) |
|
|||||
|
|
|
|
|
IF3 (I) |
|||||
|
|
|
|
|
XeF2 (Xe) |
|||||
|
|
|
|
|
PF5 (P) |
|
||||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
÷ |
÷ |
|
|
|
|
|
|
|
|
÷ |
|
÷ |
|
÷ |
÷ |
|
|
|
|
|
÷ |
÷ |
÷ |
|
|
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
÷ |
|
÷ |
|
÷ |
÷ |
÷ |
6 |
3 |
d |
2 |
|
|
÷ |
|
|||
sp |
|
|
÷ |
|
÷ |
|
|
|
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
÷ |
|
|
|
|
|
|
|
|
|
|
октаэдр |
тетрагональ- |
квадрат |
Т-форма |
||
|
|
|
|
|
XeF4 (Xe) |
- |
(Xe) |
|||
|
|
|
|
|
SF6 (S) |
ная пирамида |
[XeF3] |
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
BrI5 (Br) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В случае шести ЭПВО неподеленные пары занимают в октаэдре транс-положение друг относительно друга. В силу этого для шести ЭПВО реализуются следующие формы молекул: октаэдр (Nнп = 0), тетрагональная пирамида (Nнп = 1), квадрат (Nнп = 2) и т.д..
40
