
OBSchAYa_KhIMIYa
.pdfЧтобы определить геометрическую форму молекулы по методу Гиллеспи, необходимо знать электронные конфигурации атомов, порядок соединения этих атомов в молекуле, число - и -связей в образовавшейся частице и учесть эффекты, приводящие к искажению валентных углов.. Рассмотрим несколько примеров.
Пример 1. Для молекулы COCl2, в которой атом кислорода образует с углеродом двойную связь, а атомы хлора – одинарные (рис. 20а), числа ЭПВО и неподеленных пар составляют:
NЭПВО(C) = |
4 +1 2 + 2 1-1 2 |
= 3; |
Nнп(С) = 3 - 3 = 0 |
|
2 |
||||
|
|
|
Поэтому молекула COCl2 должна иметь форму равностороннего треугольника с валентными углами, равными 120 . В действительности же эта молекула имеет форму рав-
нобедренного треугольника (dC=O = 117 пм, dC-Cl = 175 пм, ClCO = 124 , СlCCl = 111 ). Поскольку кратные связи занимают больший объем у центрального атома, что приводит к
сжатию валентных углов.
Пример 2. Для молекулы CHCl3 число ЭПВО и связывающих пар одинаково (NЭПВО = 4, Nнп = 0), однако молекула хлороформа не имеет форму правильного тетраэдра (dC-Cl =176 пм, dC-H = 110 пм, ClCCl = 111,3 , HCCl = 107,5 ). Это связано с неравноценностью присоединенных атомов: атом водорода и атомы хлора имеют различные радиусы и образуют различные по длине связи с атомом углерода.
Пример 3. Определим форму молекулы оксофторида ксенона XeO2F2, в которой центральным является атом ксенона, образующий четыре - и две -связи (рис. 20б).
Числа ЭПВО и неподеленных пар валентной оболочки хсенона составляют:
NЭПВО(Xe) = |
8 + 2 2 + 2 1- 2 2 |
= 5 ; |
Nнп(Xe) = 5 - 4 = 1 |
|
2 |
||||
|
|
|
В соответствии с табл. 10 образующаяся молекула имеет форму бисфеноида, в котором атомы кислорода образуют связи за счет экваториальных орбиталей, обеспечивающих этим атомам максимальное удаление от орбитали, занятой неподеленной парой, а атомы фтора, имеющие по три неподеленные пары, находятся в транс-положении. Можно ожидать, что длина двойных связей Xe=O будет меньше длины одинарных связей Xe-F, а углы OXeO и FXeF в связи с наличием неподеленной пары на экваториальной орбитали будут меньше 120 и 180 соответственно. Эти предположения хорошо согласуются с результатами экспериментального определения формы рассматриваемой частицы: молекула XeO2F2 действительно имеет форму слегка искаженного бисфеноида (dXe=O = 171 пм, dXe-F
= 190 пм, OXeO = 105,7 , FXeF = 174,7 ).
Пример 4. Определим геометрию газообразного метабората натрия (рис. 20в).
При определении геометрии сложных молекул, содержащих цепочки из четырех и более атомов, рационально разбить молекулу на фрагменты и определить геометрию каждого из них отдельно. Для метабората натрия следует порознь определить форму фрагментов O=B-O и B-O-Na. Для атома бора:
NЭПВО(В) = |
3 +1 2 +1 1-1 2 |
= 2; |
Nнп(В) = 2 - 2 = 0; |
|
2 |
||||
|
|
|
т.е. фрагмент O=B-O имеет линейную форму.
NЭПВО(О) = |
3 + 1 1 |
+ 1 1 |
= 2; |
Nнп(O) = 4 - 2 = 2 |
2 |
|
|||
|
|
|
|
Таким образом, фрагмент B-O-Na имеет угловую форму, валентный угол близок к 109,5 . Молекула NaBO2 действительно представляет собой сочетание линейного и углового фрагментов с валентными углами 180 и 109 (рис. 20в).
41
Cl |
F |
|
|
|
|
|
||||
O |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
B |
|
O |
C |
|
|
O |
|
Xe |
|
||||
|
|
|
|
|
||||||
|
|
|
|
|||||||
|
|
O |
|
|
|
|
Na |
|||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||
Cl |
|
|
|
|
|
|
||||
F |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||
а |
б |
|
|
|
в |
|||||
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
||
Рис. 20. Структурные формулы молекул СOCl2 (а), XeOF2 (б), NaBO2 (в).
Пример 5. Определим геометрию иона IO2F2-.
Если частица является ионом, то при расчете числа ЭПВО следует вычесть заряд иона из числа валентных электронов. Для атома иода, являющегося центральным и образующего четыре - и две -связи:
NЭПВО(I) = |
7 + 2 2 |
+ 2 1- 2 2 - (-1) |
= 5; |
Nнп(I) = 5 - 4 = 1 |
|
2 |
|||
|
|
|
|
Рассматриваемый ион должен иметь форму бисфеноида, что подтверждено экспериментально.
3.4. Метод молекулярных орбиталей
Метод молекулярных орбиталей (ММО) является в настоящее время наиболее широко используемым приемом описания химической связи. ММО рассматривает молекулу как единую частицу, электроны которой заселяют молекулярные орбитали, принадлежащие всей молекуле. Чтобы описать молекулу по методу МО, необходимо сконструировать набор молекулярных орбиталей, построить энергетическую диаграмму, расположив полученные орбитали в порядке возрастания их энергий, а затем распределить на них электроны. Метод МО более универсален и прост по сравнению с методом ВС, но уступает последнему в наглядности. Свое развитие ММО получил в трудах Р. Малликена, Ф. Хунда и ряда других исследователей.
Существует несколько вариантов ММО, отличающихся принципами конструирования молекулярных орбиталей; наиболее популярным из них является метод МО ЛКАО (аббревиатура тезиса: "Молекулярная орбиталь - линейная комбинация атомных орбиталей"), в случае которого волновая функция молекулы МО конструируется по уравнению:
МО = сi i ,
где i - атомные орбитали входящих в молекулу атомов, сi - коэффициенты, определяющие "долю" участия данной атомной орбитали в сформированной МО. В основе метода МО ЛКАО лежат следующие положения:
1.Состояние каждого электрона в многоатомной молекуле описывается молекулярной волновой функцией МО, квадрат которой в любой точке пространства пропорционален вероятности нахождения электрона в объеме dV, включающем данную точку.
2.Число молекулярных орбиталей равно числу атомных орбиталей, образующих атомный базис.
3.Каждой МО соответствует определенный энергетический уровень; заполнение орбиталей электронами начинается с самого нижнего уровня, согласно принципу минимальной энергии.
4.Молекулярные орбитали подчиняются принципу Паули и правилу Хунда. На каждой МО могут находиться два электрона с антипараллельными спинами. При наличии нескольких вырожденных МО электронные пары на них начинают формироваться лишь после того, как все эти орбитали заполнятся неспаренными электронами.
42
5. Не все орбитали атомного базиса можно комбинировать в молекулярные орбитали. Комбинируемые орбитали должны перекрываться, быть близкими по энергии и обладать сходной симметрией относительно линии связи. Если хотя бы одно из этих условий не выполняется, соответствующие атомные орбитали переходят в молекулу без изменения.
Различают три типа молекулярных орбиталей: связывающие, разрыхляющие (антисвязывающие) и несвязывающие. Связывающие МО имеют энергию, меньшую по сравнению с исходными атомными орбиталями. Их заполнение стабилизирует молекулу. Разрыхляющие молекулярные орбитали имеют энергию более высокую по отношению к исходным АО. Заполнение электронами разрыхляющих МО ведет к дестабилизации частицы. Несвязывающие МО локализованы на отдельных атомах и фактически представляют собой атомные орбитали, перенесенные в молекулу без изменения. По симметрии МО разделяют на (симметричные относительно линии связи) и (антисимметричные относительно линии связи). Последние меняют математический знак волновой функции при повороте вокруг линии связи.
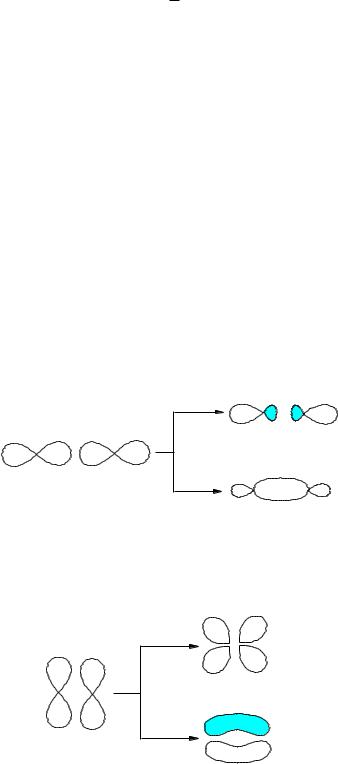
Рассмотрим электронное строение двухатомных молекул, образованных элементами первого периода. В качестве базисного набора АО будем использовать 1s-орбитали, линейные комбинации волновых функций которых дадут -функции двух молекулярных орбиталей:
1 = с1 1sA + c2 1sB ; |
2 = с3 1sA - c4 1sB |
Форма граничной поверхности полученных МО и энергетическая диаграмма молекулы имеют следующий вид:
|
- |
+ . |
. |
- |
E |
* |
|
|
|||||
|
|
|
|
1s |
||
|
|
|
* |
|
|
|
|
|
|
1s |
|
|
|
+ |
+ |
|
|
|
|
|
|
|
|
1s |
|
1sA |
1sB |
|
|
. |
|
|
|
|
|
+ |
+ . |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
1s |
|
АО |
|
МО |
|
|
|
Разместив на МО электроны, получим электронные формулы соответствующих молекулярных частиц (табл. 7).
Таблица 7.
Двухатомные гомоядерные молекулы элементов первого периода
Частица |
Электронная формула |
КС |
Магнитное |
|
поведение |
||||
|
|
|
||
H2+ |
( 1s)1 |
1/2 |
Парамагнетик |
|
H2 |
( 1s)2 |
1 |
Диамагнетик |
|
H2- |
( 1s)2( 1s*)1 |
1/2 |
Парамагнетик |
|
He2+ |
( 1s)2( 1s*)1 |
1/2 |
Парамагнетик |
|
He2 |
( 1s)2( 1s*)2 |
0 |
- |
|
|
|
|
|
Метод МО не требует использования понятия валентность. В то же время важное значение для описания молекул имеет характеристика, называемая кратностью связи. Крат-
43
ность связи определяют как полуразность числа электронов на связывающих (ne) и разрыхляющих орбиталях (ne*):
КС = 12 (ne - ne*)
Метод молекулярных орбиталей позволяет оценить ряд важнейших характеристик молекул. К ним относятся:
1.Принципиальная возможность существования частиц (частица может существовать, если кратность связи для нее больше нуля).
2.Энергия связи. Энергия связи тем выше, чем больше кратность связи.
3.Длина связи (межъядерное расстояние). Межъядерное расстояние тем меньше, чем больше кратность связи.
4.Магнитные свойства частиц.
По своему отношению к внешнему магнитному полю частицы делятся на две группы: а) парамагнитные частицы, втягиваемые магнитным полем; такие частицы содержат неспаренные электроны; б) диамагнитные частицы, выталкиваемые магнитным полем; все электроны таких частиц спарены.
Двухатомные гомоядерные молекулы элементов второго периода. При конструиро-
вании МО двухатомных гомоядерных молекул, образованных элементами второго периода, в качестве исходных АО можно использовать 2s- и 2p-орбитали. 1s-Орбитали входят в состав молекулы без изменения, т.е. являются несвязывающими. Схема и результат взаимодействия волновых функций 2s-орбиталей аналогичны рассмотренным выше для s- орбиталей элементов первого периода. 2px-Орбитали, ориентированные по линии связи, взаимодействуют с образованием двух -МО:
|
|
|
- |
- |
+ |
- |
+ |
* |
|
|
|
|
|||||
|
|
|
|
|
|
|
x |
|
- |
+ |
+ |
- |
|
|
|
|
|
|
|
|
|
|
|
|||
|
px |
|
+ |
- |
+ |
|
- |
x |
|
|
|
|
|||||
|
АО |
|
|
|
МО |
|
|
|
Взаимодействие 2p-орбиталей, ориентированных по осям y и z, приводит к образованию двух эквивалентных наборов -МО ( z, у):
- |
+ |
- |
|
|
*( * ) |
||
|
|
y |
z |
|
- |
+ |
|
++
- - |
+ |
. |
+ |
. y ( z ) |
|
||||
|
|
|||
py (pz) |
|
|
||
|
|
|
|
- |
АО |
|
|
МО |
|
Энергетическая диаграмма молекулярных орбиталей двухатомной молекулы, образованной элементами конца второго периода (начиная с кислорода), имеет вид, представленный на схеме справа:
44
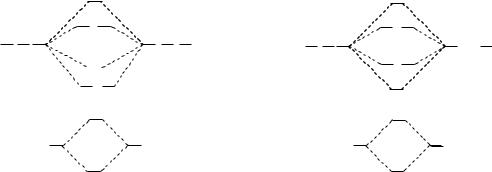
|
x* |
|
|
* |
|
|
|
|
|
x |
|
2p |
* |
2p |
2p |
* |
2p |
|
y,z |
|
y,z |
||
|
|
|
|
y,z |
|
|
x |
|
|
x |
|
|
y,z |
|
|
|
|
|
|
|
|
|
|
|
* |
|
|
* |
|
2s |
s |
2s |
2s |
s |
2s |
|
|
||||
|
s |
|
|
s |
|
У элементов, расположенных в начале второго периода, близость энергии 2p- и 2sорбиталей приводит к участию последних в формировании х-орбиталей и увеличению их энергии. Вследствие этого на энергетической диаграмме уровни х и y,z меняются местами (левая часть рисунка). Разместив электроны на МО в порядке возрастания их энергии, получим электронные формулы соответствующих молекулярных частиц (табл. 8).
|
|
|
|
Таблица 8. |
|
|
Двухатомные гомоядерные молекулы элементов второго периода |
||
|
|
|
|
|
Частица |
|
Электронная формула |
КС |
Магнитное |
|
Поведение |
|||
|
|
|
|
|
|
|
|
|
|
Li2 |
|
KK( s)2 |
1 |
Диамагнетик |
Be2 |
|
KK( s)2( s*)2 |
0 |
- |
B2 |
|
KK( s)2( s*)2( y)1( z)1 |
1 |
Парамагнетик |
C2 |
|
KK( s)2( s*)2( y)2( z)2 |
2 |
Диамагнетик |
N2 |
|
KK( s)2( s*)2( y)2( z)2( x)2 |
3 |
Диамагнетик |
O2+ |
|
KK( s)2( s*)2( x)2( y)2( z)2( y*)1 |
2,5 |
Парамагнетик |
O2 |
|
KK( s)2( s*)2( x)2( y)2( z)2( y*)1( z*)1 |
2 |
Парамагнетик |
O2- |
|
KK( s)2( s*)2( x)2( y)2( z)2( y*)2( z*)1 |
1,5 |
Парамагнетик |
F2 |
|
KK( s)2( s*)2( x)2( y)2( z)2( y*)2( z*)2 |
1 |
Диамагнетик |
Ne2 |
|
KK( s)2( s*)2( x)2( y)2( z)2( y*)2( z*)2( x*)2 |
0 |
- |
|
|
|
|
|
Из полученных данных видно, что метод МО более адекватно отражает физические свойства молекул, в частности, он объясняет парамагнетизм молекулы кислорода. Кроме этого метод молекулярных орбиталей позволяет описать как одноэлектронные, так и делокализованные связи. Однако он несколько проигрывает методу валентных схем в наглядности.
Двухатомные гетероядерные молекулы типа АВ можно подразделить на две группы: частицы, построенные из атомов элементов одного периода, и частицы, построенные из атомов элементов разных периодов.
Если элементы А и В принадлежат одному периоду, то для описания частиц АВ можно использовать набор молекулярных орбиталей, построенных для гомоядерных частиц А2. Однако в этом случае вклады атомов А и В в связывающие и разрыхляющие орбитали не
45
будут одинаковы. Атом, имеющий большую электроотрицательность, вносит больший вклад в связывающие МО, атом с меньшей электроотрицательностью - в разрыхляющие. Соответственно граничные поверхности молекулярных орбиталей перестанут быть симметричными: электронная плотность, отвечающая "связывающим" электронам будет смещена к атому с большей электроотрицательностью, тогда как вероятность нахождения "разрыхляющих" электронов будет ближе к атому с меньшей электроотрицательностью. В качестве примера на рис. 12 приведены граничные поверхности z-орбиталей для подобных молекул.
z*
- |
+ |
- |
+ |
z |
|
|
|||
|
|
|
|
АВ
z
- |
+ |
- |
z |
|
АВ
Рис. 12. Связывающие ( z) и разрыхляющие ( z*) орбитали молекулы АВ ( А< В).
Применение метода МО к молекулам типа АВ позволяет объяснить некоторые свойства последних, не находящие объяснения в рамках метода ВС. Так, например, в молекуле оксида углерода(II), согласно методу ВС, образуется тройная связь, причем одна из - связей образуется по донорно-акцепторному механизму за счет неподеленной электронной пары кислорода:
:С О:
О:
Можно ожидать, что молекула оксида углерода(II) будет полярной с отрицательным зарядом на углероде. В действительности дипольный момент молекулы очень мал и составляет 0,4 10-30 Кл м. Метод МО объясняет данное явление. Молекула СО изоэлектронна N2 и имеет электронную формулу ( s)2( s*)2( x,y)4( z)2, соответственно которой 8 из 10 валентных электронов находятся на связывающих орбиталях. Поскольку электроотрицательность кислорода больше электроотрицательности углерода, электроны связывающих орбиталей преимущественно находятся возле атома кислорода, в результате чего перетекание электронной плотности от кислороду к углероду не наблюдается.
3.5. Ионная связь
Ионная связь представляет собой предельный случай полярной связи, когда электроотрицательности взаимодействующих атомов настолько сильно отличаются друг от друга, что связывающая электронная пара полностью переходит от атома с меньшей электроотрицательностью к атому с большей электроотрицательностью, следствием чего является превращение атомов в ионы.
Рассмотрим в качестве примера образование ионной связи во фториде лития. Для этого вспомним электронное строение взаимодействующих атомов и оценим их валентные возможности. Атом лития имеет электронную формулу 1s22s1. Очевидно, что для достижения устойчивой структуры ему необходимо отдать один электрон, расположенный на внешнем энергетическом уровне.
Li(1s22s1) Li+(1s2) + e-
46
Атому фтора, который имеет электронную формулу 1s22s22p5, для достижения устойчивой конфигурации электронной оболочки достаточно присоединить один электрон, источником которого является атом лития:
F(1s22s22p5) + e- F-(1s22s22p6)
Электростатическое притяжение образовавшихся ионов и приводит к образованию вещества с ионной связью: Li + F Li+ + F- Li+F-.
Следует отметить, что описанная картина несколько идеализирована. В реальности полного переноса электрона не происходит, что вызвано поляризующим действием катиона лития, за счет которого он оттягивает на себя часть электронной плотности аниона. Квантово-механический расчет показывает, что в молекуле фторида лития эффективный заряд на атоме лития составляет +0,51, соответственно на атоме фтора -0,51, т.е. связь ли- тий-фтор в значительной мере ковалентна.
Электростатическая природа ионной связи обуславливает ее основные свойства - ненаправленность и ненасыщаемость. Ненаправленность ионной связи обусловлена сферической симметрией электростатического поля иона, вследствие которой заряженная частица притягивает ионы противоположного знака равномерно по всем направлениям.
Образование ионной связи с частицей противоположного заряда нарушает сферическую симметрию поля, но само поле не исчезает. Поэтому, образовав одну ионную связь, ион не утрачивает способность к электростатическому взаимодействию с другими частицами.
Вследствие этого молекулы с ионным типом связи существуют только при высокой температуре в газовой фазе. В конденсированном состоянии ионы стремятся окружить себя максимальным число ионов противоположного знака, что приводит к образованию веществ с немолекулярной структурой - ионных агрегатов (ионных кристаллов).
Общий тип химической связи обуславливает некоторые общие свойства, присущие всем ионным соединениям:
1.Ионные соединения имеют высокую температуру плавления и низкую летучесть. Это явление объясняется сильным электростатическим притяжением между ионами.
2.Ионные соединения, как правило, имеют низкую электрическую проводимость в кристаллическом состоянии, так как ионы, находящиеся в узлах кристаллической решетки, не способны к поступательному движению. Расплавы ионных соединений хорошо поводят электрический ток.
3.Ионные кристаллы тверды, но хрупки. Твердость ионных соединений объясняется отсутствием в них направлений, по которым кристаллическая решетка могла бы расслаиваться, как, например, в случае кристалла графита. Хрупкость ионных кристаллов связана
стем, что даже незначительные деформации решетки сопровождаются сближением одноименно заряженных ионов, в результате чего баланс сил отталкивания и притяжения нарушается, а кристалл раскалывается.
47

4. Ионные соединения обычно заметно растворимы в полярных растворителях. Полярные растворители характеризуются высокими значениями диэлектрической постоянной ( ), которая связана с энергией взаимодействия двух заряженных частиц уравнением:
E = Z+ Z- , 4 r
где Z+ и Z- - заряды взаимодействующих частиц, r - расстояние между ними. Для воды диэлектрическая постоянная составляет 7,25 10-10 Кл2 Дж-1 м-1, тогда как диэлектрическая постоянная вакуума ( 0) равна 8,85 10-12 Кл2 Дж-1 м-1, то есть в 82 раза меньше. Изменение диэлектрической постоянной при переходе от вакуума к воде в 82 раза понижает энергию электростатического взаимодействия, что способствует распаду вещества на ионы. Примером других жидкостей с высокими значениями диэлектрической проницаемости могут служить циановодород ( = 158 0), фтороводород ( = 83,6 0), муравьиная кислота ( = 57,9 0), метиловый спирт ( = 37,9 0), жидкий аммиак ( = 25,0 0).
3.6. Металлическая связь. Зонная теория кристаллов
Металлическая связь - это особый вид химической связи, реализующейся в металлах, сплавах, в соединениях металлов друг с другом (интерметаллидах). Основной особенностью металлической связи является ее электронодефицитность: взаимодействие осуществляется с использованием значительно меньшего числа валентных электронов, чем это необходимо для образования двухцентровых связей. Так, например, в кристалле натрия каждый атом имеет в ближайшем окружении восемь таких же атомов, в то время как единственный валентный электрон позволяет ему образовать лишь одну двухцентровую связь. Совершенно очевидно, что существование кристалла натрия возможно лишь за счет образования делокализованных связей, охватывающих все атомы кристалла.
Таким образом, металлическая связь - это многоцентровая связь, объединяющая большое число атомов за счет обобществления валентных электронов в пределах всего кристалла.
Характерными особенностями металлической связи являются ее ненаправленность и ненасыщаемость. Вследствие этого веществам с металлической связью присущ ряд общих свойств. Кристаллы таких веществ обладают высокой электропроводность и теплопроводностью. Веществам с металлической связью присущи пластичность (ковкость) и характерный металлический блеск.
Заметим, что наряду с металлической связью в кристалле металла могут проявляться и иные виды взаимодействия, вплоть до образования локализованных связей. Так, в кристалле ниобия, атомы которого имеют пять валентных электронов, лишь около 25 % от их числа идет на образование металлической связи.
Наиболее удовлетворительно металлическую связь описывает зонная теория кристаллов, представляющая собой распространение метода молекулярных орбиталей на системы
спеременным и очень большим числом атомов (порядка числа Авогадро).
Воснове зонной теории кристаллов лежит представление об энергетических зонах. Познакомимся с этим понятием на примере формирования кристалла щелочного металла,
например, натрия. В изолированном атоме натрия электроны находятся на дискретных энергетических уровнях в соответствии с электронной конфигурацией 1s22s22p63s1. При
сближении двух атомов натрия из двух 3s-орбиталей образуются связывающая s и разрыхляющая s* молекулярные орбитали (рис. 13).
Валентные электроны заполняют s орбиталь, результатом чего является образование молекулы Na2. Взаимодействие трех атомов натрия приводит к образованию трех МО - связывающей, разрыхляющей и несвязывающей. Агрегату Na4 будет соответствовать формирование четырех МО (двух связывающей и двух разрыхляющих). По мере увеличения числа атомов в агрегате число молекулярных орбиталей будет расти, а отвечающие им
48
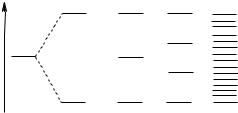
энергетические уровни будут сближаться. При достаточно большом числе атомов (порядка числа Авогадро) формируется совокупность огромного числа энергетических уровней, в которой энергии двух соседних уровней отличаются на очень малую величину (порядка 10-20 - 10-22 кДж/моль). Подобные совокупности энергетических уровней называются энергетическими зонами.
E
3s
N=1 N=2 |
N=3 |
N=4 N 1023 |
Рис. 13. Формирование 3s-зоны в кристалле натрия.
Энергетические зоны подчиняются законам квантово-механической теории. Так, для энергетических зон справедлив принцип Паули: если кристалл состоит из N атомов, емкость s-зоны составляет 2N электронов, р-зоны - 6N электронов и т.д. Соблюдается также правило Хунда: если в зоне имеются вырожденные уровни, электроны распределяются таким образом, чтобы число параллельных спинов было максимальным. Зона, в которой располагаются валентные электроны, называется валентной зоной; ближайшая к валентной вакантная зона называется зоной проводимости.
Энергетические зоны распространяются на все атомы кристалла, в результате чего любой электрон, участвующий в образовании металлической связи, принадлежит всем атомам, что обеспечивает свободное перемещение электрона по кристаллу.
В кристалле металла возможно перекрывание энергетических зон, образованных орбиталями разных энергетических подуровней. Зоны являются перекрывающимися, если верхний край нижней валентной зоны выше нижнего края зоны проводимости. Если зоны не перекрываются, то энергетический зазор между нижним краем зоны проводимости и верхним краем валентной зоны называется запрещенной зоной.
Зонная теория объясняет характерные свойства металлов. Так, высокая электрическая проводимость типичных металлов связана со свободным перемещением электронов в пределах кристалла. Очевидно, что металлическая проводимость проявляется в двух случаях:
1.Если валентная зона укомплектована электронами не полностью.
2.Если валентная зона и зона проводимости перекрываются. В этом случае валентные электроны заполняют энергетические уровни не только валентной зоны, но и зоны проводимости.
Если заполненная электронами валентная зона отделена от зоны проводимости запрещенной зоной, то свойства кристалла будут определяться шириной запрещенной зоны.
Если ширина запрещенной зоны ( Е) больше 400 кДж/моль, то кристалл не будет проводить электрический ток. Такие вещества называются диэлектриками. Примером диэлектрика может служить алмаз, для которого Е = 580 кДж/моль, а удельное сопротивление составляет 1 106 Ом см-1. При ширине запрещенной зоны, укладывающейся в интервал 10 - 400 кДж/моль, часть электронов, обладающих достаточной энергией, переходит в зону проводимости; такие вещества называются полупроводниками. Так, для кристаллического кремния Е = 105 кДж/моль, а = 6 104 Ом см-1 при комнатной температуре.
Понижение температуры по-разному влияет на проводимость металлических проводников и полупроводников: для первых проводимость с повышением температуры понижается, для вторых - повышается. Это явление также может быть объяснено в рамках зонной теории. В случае металлических проводников с повышением температуры электро-
49
ны, поглощая тепловую энергию, перемещаются с низких уровней на вакантные уровни той же зоны или зоны проводимости. В результате уменьшается число незанятых уровней с относительно низкой энергией и, следовательно, проводимость кристалла. В случае полупроводника с повышением температуры возрастает доля электронов, способных преодолеть запрещенную зону, и проводимость кристалла увеличивается.
В результате обобществления электронов и свободного перемещения их в пределах всего кристалла в узлах кристаллической решетки металла находятся частицы, имеющие одноименный (положительный) эффективный заряд. В связи с этим слои атомов металла относительно легко смещаются друг относительно друга, Этим объясняется типичная для металлов пластичность.
3.7. Межмолекулярное взаимодействие
Экспериментальные данные свидетельствуют о том, что между молекулами любых простых и сложных веществ в газообразном, жидком и твердом состояниях наблюдается взаимное притяжение даже на относительно больших расстояниях, исключающих перекрывание электронных орбиталей и образование химических связей. Силы, обуславливающие данное взаимодействие, называются силами Ван-дер-Ваальса, а изменение энергии системы, обусловленное действием этих сил, - эффектом межмолекулярного взаимодействия. Следствием межмолекулярного взаимодействия является, в частности, переход газов в жидкости, а жидкостей - в кристаллические структуры.
Межмолекулярное взаимодействие отличается следующими особенностями:
1.Межмолекулярное взаимодействие является относительно слабым. Отвечающие ему тепловые эффекты на один-два порядка меньше тепловых эффектов образования кова-
лентных связей. Так, энергия связи для молекулы Н2 равна 432 кДж/моль, в то время как энтальпия возгонки кристаллического водорода, связанная с межмолекулярным взаимодействием, составляет 2,1 кДж/моль.
2.Межмолекулярное взаимодействие не является специфическим. Силы Ван-дер- Ваальса действуют между самыми разнообразными молекулами.
3.Силы Ван-дер-Ваальса имеют электростатическую природу, в связи с чем межмолекулярное взаимодействие является ненасыщаемым и ненаправленным.
Наряду с силами притяжения между молекулами могут действовать и силы отталкивания, обусловленные взаимодействием заполненных электронами орбиталей при сильном сближении частиц. Однако силы эти обычно весьма слабы и становятся значительными лишь при очень малых межмолекулярных расстояниях.
Можно выделить три вида межмолекулярного взаимодействия, каждый из которых вносит определенный вклад в изменение энергии системы.
Ориентационное взаимодействие обусловлено взаимодействием собственных дипольных моментов молекул и присуще веществам, молекулы которых полярны. В подобных веществах и смесях веществ молекулы ориентируются друг относительно друга так, чтобы их разноименные полюса максимально сближались. Действующие при этом силы называются ориентационными. Энергия ориентационного взаимодействия двух одинаковых молекул (ориентационный эффект) выражается следующим уравнением (В. Кеезом, 1912 г.):
E |
|
= - |
2 |
|
μ4 N |
A |
= - |
A |
, |
op |
|
|
|
r6 |
|||||
|
|
3 |
|
R T r6 |
|
||||
где - дипольный момент молекулы, r - расстояние между молекулами.
Индукционное взаимодействие. При сближении двух полярных молекул или полярной и неполярной молекул наблюдается взаимная поляризация частиц, сопровождающаяся возникновением индуцированных дипольных моментов, ориентированных друг к другу противоположными полюсами. Между частицами возникают дополнительные силы притяжения (индукционные силы), понижающие энергию системы. Величина индукционного эффекта может быть вычислена по следующему уравнению (П. Дебай, 1920 г.).
50
