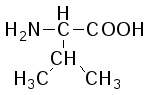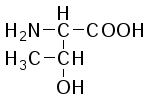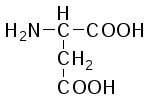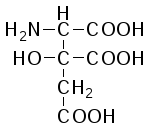- •0 Модуль Тема: «Предмет и задачи пищевой химии. Химический состав продуктов питания»
- •Вопросы для самоподготовки:
- •1 Модуль Тема «Химический состав белков и их эссенциальные компоненты. Химическая и биологическая ценность белков растительного и животного происхождения»
- •Практическое занятие № 1 «Заменимые и незаменимые аминокислоты и их роль в обмене человеческого организма. Энергетическая ценность белков» Вопросы к семинарскому занятию:
- •Лабораторная работа № 1 «Качественный и количественный анализ белков растительного и животного происхождения»
- •Тесты для самопроверки и контроля знаний:
- •Тема «Каталитическая функция белков. Ферменты пищевой промышленности»
- •Практическое занятие № 2 «Классификация ферментов; строение коферментов и простетических групп их каталитических центров» Вопросы к семинарскому занятию:
- •Лабораторная работа № 2 «Изучение механизма действия витаминзависимых ферментов на примере оксидоредуктаз»
- •Тесты для самопроверки и контроля знаний:
- •Тема «Водорастворимые витамины, как составная часть каталитических центров энзимов. Роль жирорастворимых витаминов, как регуляторов, структурных элементов клеток и организма человека в целом»
- •Практическое занятие № 3 «Жирорастворимые витамины и их растительные предшественники» Вопросы к семинарскому занятию:
- •Самостоятельная работа: План написания реферата по теме «Водорастворимые витамины»
- •Лабораторная работа № 3 «Качественный анализ водо- и жирорастворимых витаминов»
- •Тесты для самопроверки и контроля знаний:
Вопросы для самоподготовки:
Физиологическая роль воды для организма. Источники поступления воды в организм. Содержание воды в пищевых продуктах.
Физиологическая роль минеральных элементов. Характеристика макро-, микро- и ультрамикроэлементов. Содержание основных минеральных элементов в продуктах питания.
Углеводы, их классификация, характеристика, содержание в продуктах питания. Энергетическая роль.
Химическая природа белков. Значение для полноценного питания.
Жиры – химическая природа и значение. Содержание в продуктах питания животного и растительного происхождения.
Фосфолипиды, стериды, воска.
Значение ферментов для жизнедеятельности организма.
Роль витаминов для полноценного питания. Участие витаминов в ферментных процессах.
Характеристика органических кислот пищевых продуктов и их роль.
Красители и эфирные масла в пищевых продуктах. Их роль в питании людей.
1 Модуль Тема «Химический состав белков и их эссенциальные компоненты. Химическая и биологическая ценность белков растительного и животного происхождения»
Аминокислоты являются производными карбоновых кислот, в которых один атом водорода углеродной цепи замещен на аминогруппу. В зависимости от положения NH2-группы (аминогруппа) различаютα-,β-,γ- и т.д. аминокислоты. В природе существует более 300 аминокислот, их можно условно разделить на две группы:
свободные аминокислоты (непротеиногенные) – не берут участия в образовании белков;
протеиногенные – ковалентно связанные друг с другом в составе пептидов и белков.
Непротеиногенные аминокислоты более разнообразны чем протеиногенные.
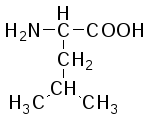
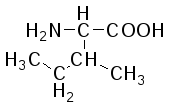
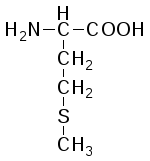
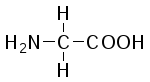
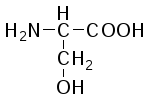
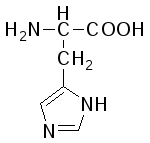
В состав белков входит 22 α-аминокислоты, в которых аминогруппа -NH2и карбоксильная группа –СООН присоединены к одному и тому жеα-углеродному атому и которые встречаются практически во всех белках. Общая структурная формулаα-аминокислот может быть представлена в таком виде:
![]()
α-Аминокислоты отличаются друг от друга структурой и составом группыR(боковая цепь), которая может представлять собой атом углерода, как в глицине, или более сложнуюгруппировку, как, например, гуанидиновая группа в аргинине.
Аминокислоты классифицируют соответственно по химическому строению на ациклические (алифатические), ароматические, гетероциклические; по количеству в молекуле аминных и карбоксильных групп – на моноаминомонокарбоновые, диаминомонокарбоновые, моноаминодикарбоновые, диаминодикарбоновые.
По современной рациональной классификации, которая основана на полярности радикалов, выделяют четыре класса аминокислот:
неполярные, или гидрофобные;
полярные (гидрофильные) незаряженные;
отрицательно заряженные;
положительно заряженные при физиологических значениях рН (если рН 6,0-7,0).
В табл. приведена классификация протеиногенных аминокислот. В ней представлены исторические и рациональные названия, структурная формула и сокращенные обозначения аминокислот, которые приняты в современной и зарубежной литературе.
Таблица
Классификация протеиногенных аминокислот
|
Название |
Структура |
Сокра-щенное название |
|
І. Неполярные, или гидрофобные аминокислоты | ||
|
L-Аланин (α-амино-пропионовая кислота) |
|
Ала (Ala) |
|
L-Валин (α-аминоизовалериановая кислота) |
|
Вал (Val) |
|
L-Лейцин (α-амино-изокапроновая кислота) |
|
Лей (Leu) |
|
L-Изолейцин (α-амино-β-метилвалериановая кислота) |
|
Иле (Ile) |
|
L-Триптофан (α-амино-β-индолилпропионовая кислота) |
|
Три (Try) |
|
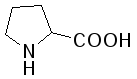
L-Пролин (пирролидин-α-карбоновая кислота) |
|
Про (Pro) |
|
L-Фенилаланин (α-амино-β-фенилпропионовая кислота) |
|
Фен (Phe) |
|
L-Метионин (α-амино-γ-метилтиомасляная кислота) |
|
Мет (Met) |
|
ІІ. Полярные (гидрофильные) незаряженные аминокислоты | ||
|
Глицин (аминоуксусная кислота) |
|
Гли (Gly) |
|
L-Серин (α-амино-β-оксипропионовая кислота) |
|
Сер (Ser) |
|
L-Треонин (α-амино-β-оксимасляная кислота) |
|
Тре (Thr) |
|
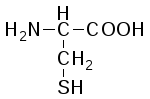
L-Цистеин (α-амино-β-тиопропионовая кислота) |
|
Цис (Cys) |
|
L-Селеноцистеин |
|
SeЦиc (SeCys) |
|
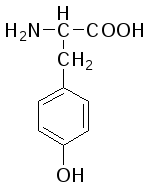
L-Тирозин (α-амино-β-параоксифенилпропионовая кислота) |
|
Тир (Tyr) |
|
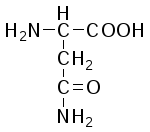
L-Аспарагин (амид аспарагиновой кислоты) |
|
Асн (Asn) |
|
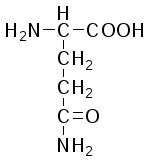
L-Глутамин (амид глутаминовой ислоты) |
|
Глн (Gln) |
|
ІІІ. Отрицательно заряженные (кислые) аминокислоты | ||
|
L-Аспарагиновая кислота (α-аминоянтарная кислота) |
|
Асп (Asp) |
|
L-Глутаминовая кислота (α-аминоглутаровая кислота) |
|
Глу (Glu) |
|
L-Аминолимонная кислота (α-аминоцитрат) |
|
|
|
ІV. Положительно заряженные (основные) аминокислоты | ||
|
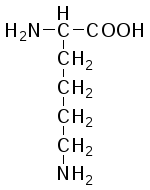
L-Лизин (α,ε-диамино-капроновая кислота) |
|
Лиз (Lys) |
|
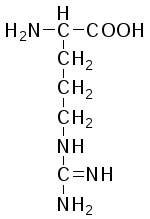
L-Аргинин (α-амино-β-гуанидинвалериановая кислота) |
|
Арг (Arg) |
|
L-Гистидин (α-амино-β-имидазолилпропионовая кислота) |
|
Гис (His) |
По биологическому значению (пищевой ценности) аминокислоты делятся на заменимые и незаменимые. Незаменимые аминокислоты не могут синтезироваться организмом из других соединений. Человек получает их только с пищей. Таких аминокислот восемь: из алифатических незамещенных – валин, лейцин, изолейцин; из алифатических замещенных – треонин, лизин, метионин; из ароматических – фенилаланин; из гетероциклических – триптофан. Две аминокислоты – аргинин и гистидин – незаменимые для детского организма, у взрослых в здоровом состоянии они синтезируются в необходимом количестве. Тирозин и цистеин являются условно заменимыми аминокислотами, т.к. источником их могут служить фенилаланин и метионин.
Высшие растения могут содержать все необходимые для белкового синтеза аминокислоты. В организме человека синтезируются только 12 из 22 аминокислот, поэтому они принадлежат к заменимым аминокислотам.
В белках есть и модифицированные аминокислоты. Химическая модификация обычно происходит уже после того, как исходная аминокислота попадает в состав белка. Один из примеров важной модификации – окисление двух -SH-групп цистеиновых остатков с образованием аминокислоты цистина, которая содержит дисульфидную связь.
Белки – наиболее важные компоненты питания. Способность белка выполнять функцию питания характеризует его биологическую ценность. Эффективность употребления белковых веществ человеком определяется двумя основными факторами – сбалансированностью содержания незаменимых аминокислот в белке и его усвояемостью. Если не удовлетворяется потребность хотя бы в одной из незаменимых аминокислот, то ограничивается использование других, и, значит, снижается ценность белка в целом. Незаменимая аминокислота, которая находится в белке в минимальном количестве, называется лимитирующей аминокислотой, т.к. она наибольшей мерой уменьшает биологическую ценность данного белка.
Обогащение пищевых белковых продуктов отсутствующими аминокислотами применяется в питании человека в исключительных случаях. Это объясняется тем, что свободные L-аминокислоты всегда содержат примесьD-аминокислот, которые опасны для организма человека. Однако добавление синтетических или полученных микробиологическим способом аминокислот к кормам животных является распространенной практикой. Подобным образом во всем мире готовят кормовые смеси для домашней птицы, свиней, коров, что позволяет более бережно использовать корма. Известно, что добавки этих аминокислот улучшают утилизацию белка животными приблизительно на 20 %.
Обычно биологическая ценность белка выражается в относительных величинах. Она представляет собой отношение исследуемого параметра данного белка к подобному параметру «идеального» белка. В качестве последнего используют казеин молока, белок яиц, смесь мышечных белков, которые легко перевариваются и содержат незаменимые аминокислоты в соотношениях, близких к эталонным. Биологическая ценность белка сравнительно с эталонными свидетельствует о том, насколько он способен удовлетворять потребности организма в аминокислотах. Для оценки любого белка или пищевого продукта необходимы данные про содержание в нем отдельных аминокислот, т.е. про его аминокислотный состав.
Некоторые растительные белки (бобовые) по своему аминокислотному составу близки к животным белкам, но имеют более низкую биологическую ценность, так как хуже перевариваются в ЖКТ человека. Однако белки семян большинства сортов зерновых (рис, овес) дефицитны по двум, а чаще (пшеница, кукуруза и др.) трем и четырем незаменимым аминокислотам. Основной лимитирующей аминокислотой белков зерновых культур является лизин. Лимитирующие аминокислоты белков зерновых являются разными в семенах разных культур: в пшенице, рисе и жите – треонин, в кукурузе – триптофан и т.д. Белки бобовых культур имеют лучшую сбалансированность содержащихся в них незаменимых аминокислот, чем белки злаковых, но имеют невысокий процент содержания лизина.
В животных белках дефицит незаменимых аминокислот выражен слабо. Некоторые из них (белки молока, мяса, субпродуктов) содержат недостаточно серусодержащих аминокислот. В целом для животных белков более характерно избыточное, сравнительно с потребностями организма, содержание некоторых незаменимых аминокислот.
В питании большей части населения земного шара имеется дефицит трех незаменимых аминокислот – лизина, триптофана и метионина. Разный аминокислотный состав растительных и животных белков позволяет повысить их биологическую ценность при употреблении необходимого количества разнообразной белковой пищи. Только такое питание можно назвать полноценным.
Таблица
Содержание белка в основных пищевых продуктах
|
Продукт |
Белок, г/100г |
Продукт |
Белок, г/100г |
|
Говядина |
18,6-20,0 |
Грибы сушеные |
20,1 |
|
Баранина |
15,6-19,8 |
Орех фундук |
16,1 |
|
Свинина мясная |
14,3 |
Мука пшеничная |
10,6 |
|
Печень говяжья |
17,9 |
Мука ржаная сеянная |
6,9 |
|
Куриное мясо |
18,2-21,2 |
Крупа манная |
10,3 |
|
Яйца куриные |
12,7 |
Крупа гречневая |
12,3 |
|
Колбаса вареная (высший сорт) |
12,2 |
Крупа рисовая |
7,0 |
|
Сервелат |
24,0 |
Хлеб пшеничный |
7,6-8,1 |
|
Молоко |
2,8 |
Хлеб ржаной |
4,7-7,0 |
|
Сыр нежирный |
18,0 |
Макароны |
10,4-11,8 |
|
Сыры (твердые) |
19,0-31,0 |
Капуста белокачанная |
1,8 |
|
Масло сливочное |
0,5 |
Морковь |
1,3 |
|
Картофель |
2,0 |
Свекла |
1,5 |
|
Горох |
20,5 |
Яблоки |
0,4 |
|
Фасоль |
21,0 |
Груши |
0,4 |
Аромат и вкус мяса при варке обусловлен составом веществ, содержащихся в основном в мышечной и жировой тканях.
Вкус мясу придают низкомолекулярные пептиды: глутатион, карнозин, анзерин и др. Кроме того, на вкус мяса влияют аминокислоты: глутаминовая кислота, треонин, цистеин, метионин, лейцин, изолейцин, валин, аланин, гистидин. Часть аминокислот находятся в мышечной ткани в свободном состоянии, а часть пополняется за счет гидролиза белков и пептидов. Активность протеолиза возрастает при размораживании мяса.
Горький вкус мясу придают некоторые свободные аминокислоты (лейцин, изолейцин, фенилаланин, триптофан, метионин, лизин, гистидин, аргинин).
В формировании сладкого вкуса принимают участие углеводы (глюкоза, фруктоза, рибоза, сахароза и др.) и аминокислоты (аланин, валин, пролин, глицин, серин, треонин).