
Sivolob_A_V__Afanasyeva_K_S_Molekulyarna_organ
.pdf191
гістоні Н3. Гіперацетилювання гістонів та метилювання Lys4 блокує роботу ферментів, що вносять гетерохроматинові маркери, перешкоджає зв'язуванню НР1 та інших гетерохроматинових білків.
Крім того, бар'єр між еута гетерохроматином може виникати за рахунок зв'язування інсуляторної зони з певною частиною ядерного матриксу – це робить такі бар'єрні інсулятори подібними до енхансер-блокуючих, що обговорювались у підпідрозд. 5.1.5. Описано також випадки, коли бар'єром слугує гіперактивний ген домашнього господарства: висока транскрипційна активність гена забезпечує збіднення на нуклеосоми та рекрутування гістондеацетилаз. Зокрема, саме такий бар'єр відокремлює гетерохроматинову зону в теломерах дріжджів – активним геном виступає ген тРНК. В якості бар'єру може виступати також сильний енхансер. Взагалі, бар'єрні інсулятори мають багато спільних рис з енхансерами та промоторами – всі ці ділянки рекрутують подібні активності та часто є збідненими на нуклеосоми.
Отже, бар'єрні інсулятори відокремлюють центромерну зону, всередині якої реалізується додаткова компактизація хроматину за рахунок підтримання певного набору гетерохроматинових маркерів. При реплікації білки тимчасово знімаються з ДНК у точці реплікації (наступний підрозділ). Реплікація ДНК здійснюється нерівномірно – гетерохроматин реплікується в останню чергу. За точкою реплікації гістони батьківського хроматину (які несуть на собі гетерохроматинові маркери) повертаються на дочірні молекули ДНК разом із гістонами, синтезованими de novo, НР1 також повертається на той самий локус, де він був присутній, і відновлює патерни модифікацій гістонів і компактний (репресований) стан гетерохроматинової ділянки: гетерохроматиновий стан даного локусу відтворюється в дочірніх клітинах.
Подібна система репресії за участю НР1 широко використовується в інших ділянках гетерохроматину, а також для гарантованого блокування генів в еухроматинових зонах. Гетерохроматин утворюється передусім на послідовностях ДНК,
192
що повторюються. Причому має значення не послідовність як така, а саме наявність повторів. У формуванні та підтриманні гетерохроматинового стану повторів важливу роль відіграє також процес РНК-інтерференції.
Зв'язування мікро-РНК у складі комплексу RISC з мРНК під час транскрипції (підпідрозд. 5.1.6), крім нуклеазної деградацій мРНК, викликає рекрутування до хроматину гістонметилтрансфераз, що здійснюють метилювання Lys9 в гістоні Н3 із наступною репресією даного гена (за схемою рис. 5.23). Дещо подібне відбувається і в прицентромерному гетерохроматині. При порушенні компактизації на центромерних повторах може відбуватися спонтанна транскрипція в різних напрямках. Оскільки матрицею є повтори, існує висока ймовірність синтезу комплементарних молекул РНК: утвориться дволанцюгова РНК, яка запустить процес інтерференції. Крім деградації транскриптів, інтерференція має інший наслідок: RISC, який опиняється в зоні повторів, рекрутує до хроматину гістонметилтрансферазу, що здійснює метилювання Lys9 гістону Н3: відбувається зв'язування НР1 і компактизація гетерохроматину.
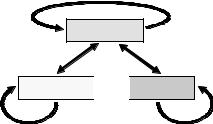
Отже, метилювання Lys9 гістону Н3 та деацетильований стан лізинів гістонів Н3/Н4 є найхарактернішою ознакою гетерохроматинових ділянок. Як описано вище, обидві модифікації самопідримуються та підтримують одна одну через опосередковану дію НР1. Важливу роль у забезпеченні репресованого стану відіграє також метилювання цитозинів ДНК – інша ковалентна модифікація, яка також відновлюється при клітинному поділі й замикає своєрідне “ коло репресії”
(рис. 5.24).
Н3 Me -Lys 9
Н3 / H4 Lys + 
 ДНК 5 m C
ДНК 5 m C
193
Рис. 5.24. Взаємний вплив деацетилювання гістонів, метилювання Lys9 гістону Н3 і метилювання ДНК у
гетерохроматині.
5.5.3. Метилювання ДНК. Субстратом метилювання ДНК є цитозини (метильна група приєднується до п'ятого атому кільця з утворенням 5mC – 5- метилцитозину) у складі динуклеотидів CpG. Узагалі, у 70–80 % динуклеотидних контактів CpG обидва цитозини є метильованими в геномі хребетних. Зони, де підтримується деметильований стан CpG (так звані CpGострівці), часто розташовані в промоторах генів домашнього господарства.
Патерн тканиноспецифічного метилювання ДНК є результатом двох процесів: підтримання метильованого статусу після реплікації та метилювання de novo.
Підтримуюча ДНК-метилтрансфераза (DNA methyltransferase, Dnmt) спрацьовує протягом 1–2 хвилини після реплікації: дві дочірні молекули ДНК містять батьківській ланцюг ДНК (з 5mС у складі CpG) і синтезований ланцюг, де С не метильований. Dnmt упізнає такі напівметильовані динуклеотидні контакти й відновлює симетрію щодо метилювання цитозину. За рахунок цього процесу патерн метилювання відтворюється в дочірніх клітинах, що є, поряд з відновленням модифікацій гістонів, одним із важливих механізмів епігенетичного спадкування.
Інші ДНК-метилтрансферази здійснюють метилювання ДНК de novo. Особливо важливим цей процес є на ранніх стадіях ембріонального розвитку, коли ДНК є тотально деметильованою. У процесі диференціації у ссавців відбувається масове метилювання ДНК, що визначає специфічне вимикання певних груп генів у спеціалізованих клітинах. Крім того, деметилювання є можливим і в диференційованих клітинах, де Dnmt використовуються для відновлення метильованого статусу.
Отже, метилювання ДНК є ознакою репресованих і гетерохроматинових ділянок. Залучення 5mС до репресії пов'язане з наявністю у складі певних білків особливих структурних модулів – MBD (M ethyl Binding Domain), які мають
194
специфічну спорідненість до метильованих динуклеотидів CpG. Білки, що містять MBD, є компонентами різноманітних репресуючих комплексів. Зокрема, такі білки рекрутують до метильованих ділянок хроматину гістон-деацетилази. З іншого боку, деацетильований стан гістонових хвостів блокує деметилюючі активності, і навпаки – ацетилювання хвостів може викликати деметилювання ДНК у активних ділянках.
Аналогічно, білки, що містять MBD, рекрутують гістонметилтрансферазу, яка здійснює метилювання Lys9 гістону Н3, що призводить до репресії (рис. 5.23, 5.24). І навпаки: Me-Lys9 упізнається білком, що містить хромодомен і рекрутує ДНКметилтрансферазу. Саме такий шлях (за формулою "histones first, DNA second") реалізується для визначення сайтів метилювання ДНК в процесі індивідуального розвитку: репресуючі комплекси індукують метилювання Н3Lys9, після чого здійснюється метилювання ДНК, яке закріплює інактивований статус.
Хоча Me-Lys9 та 5mС є загальними маркерами конститутивно репресованих ділянок хроматину, не завжди репресія та додаткова компактизація залежить від НР1 – реалізуються також інші системи, більшість з яких є ще не достатньо вивченими. Прикладом такої системи є інактивація однієї з Х-хромосом у клітинах самок ссавців. У складі Х- хромосоми, яка буде інактивованою (обирається випадково на ранніх стадіях розвитку), спрацьовує ген Xist, що продукує велику некодуючу молекулу РНК. Ці РНК укривають собою хромосому і взаємодіють з деякими білками, серед яких – варіант гістону Н2А macroH2A (підпідрозд. 2.1.3). Імовірно, macroH2A рекрутує гістон-метилтрансферазу (здійснюється метилювання Lys9 гістону Н3) і гістон-деацетилазу. Метилювання Lys9, у свою чергу, зумовлює метилювання ДНК (що забезпечує епігенетичну спадковість). Крім того, до Х- хромосоми рекрутуються структурні компактизуючі білки (але не НР1).
5.6. Реплікація ДНК у хроматині
195
Перед поділом клітини, під час періоду інтерфази, що позначається як S-фаза, відбувається дуплікація хромосом. При цьому здійснюється як реплікація ДНК, так і відновлення профілю епігенетичної інформації у вигляді хімічних модифікацій ДНК та гістонів.
Реплікація ДНК починається з порівняно невеликої ділянки – ориджина (origin), де здійснюється ініціація процесу, головним моментом якої є розходження ланцюгів ДНК. Далі по ходу реплікації такий реплікативний міхур розростається у двох протилежних напрямках. На кожному боці міхура існує так звана реплікативна вилка, в основі якої й відбувається синтез ДНК. Ділянку ДНК, де здійснюється реплікація, що розпочинається з однієї точки, називають репліконом.
Кожна хромосома є полірепліконом: загалом геном, наприклад ссавців, містить близько 40 тис. точок ініціації – ориджинів (розмір еукаріотичного реплікона варіює від 50 до 200 тис. пар основ). Ориджини важко ідентифікувати, оскільки спільних елементів послідовності у них немає, вони лише характеризуються підвищеним вмістом АТ-пар.
Ініціація реплікації залежить від мультибілкового комплексу
ORC (Origin Recognition Complex), який збирається на ориджині.
При підготовці до реплікації у фазі G1 клітинного циклу відбувається фосфорилювання циклінзалежними кіназами певних факторів регуляції клітинного циклу. У результаті дві реплікативні ДНК-гелікази МСМ завантажуються в ORC та індукують локальне плавлення подвійної спіралі. З розплетеними полінуклеотидними ланцюгами взаємодіють компоненти реплікативної машинерії (див. нижче), і розпочинається рух двох реплікативних вилок у протилежних напрямах. Кожен ориджин використовується для ініціації реплікації тільки один раз під час клітинного циклу – після початку реплікації вмикаються спеціальні молекулярні механізми, що запобігають повторній ініціації.
У кожній реплікативній вилці працюють принаймні дві молекули ДНК-полімерази, що здійснюють синтез двох полінуклеотидних ланцюгів. Оскільки два ланцюги у складі молекули ДНК є антипаралельними, і синтез відбувається тільки

196
в напрямку від 5'-до 3'-кінця, синтез тільки одного з ланцюгів відбувається безперервно, починаючись від ориджина. Цей ланцюг називають лідуючим (leading strand), його 3'-кінець розташований поблизу від основи реплікативної вилки. Синтез
іншого ланцюга – ланцюга, що запізнюється (lagging strand) –
розпочинається від реплікативної вилки: синтезуються окремі фрагменти довжиною ~200 нуклеотидів – так звані фрагменти Оказакі (Reiji Okazaki), які пізніше з'єднуються між собою.
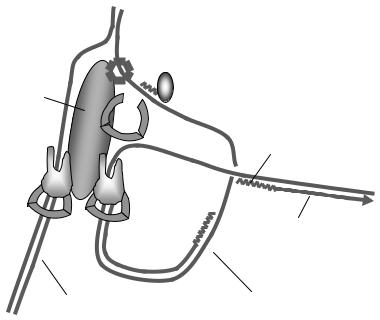
У реплікативній вилці працює складний мультибілковий комплекс – реплісома, до якого входять компоненти, що забезпечують розплітання ДНК, підвищення процесивності ДНК-полімерази та виконують інші важливі допоміжні операції. Головними компонентами еукаріотичної реплісоми, крім двох ДНК-полімераз (ДНК-полімерази δ/ε), є (рис. 5.25): моногексамерна геліказа МСМ; білки, що стабілізують одноланцюговий стан ДНК, – RPA (R eplication Protein A);
праймаза, що синтезує короткий РНК-праймер на початку кожного фрагмента Оказакі (цю роль в еукаріотів виконує ДНКполімераза α, яка містить РНК-полімеразну активність); два зажими, що ковзають (sliding clamps) – своєрідні монотримерні "хомути", які, охоплюючи ДНК кільцем та зв'язуючись з ДНК-полімеразами, забезпечують їхню високу процесивність (PCNA – P roliferating Cell Nuclear Antigene);
мультибілковий комплекс RFC (Replication Factor C) – основний структурний елемент реплісоми та завантажувач PCNA на ДНК. Процес реплікації потребує також ативностей ДНКтопоізомераз, які здійснюють релаксацію позитивної надспіралізації попереду реплікативної вилки, а також – топоізомерази класу ІІ – забезпечують розділення двох дуплексів при зустрічі двох реплікативних вилок сусідніх репліконів.
197
|
Геліказа |
RFC |
Праймаза |
|
Праймер
ДНК-полімераза
5'
PCNA |
Фрагмент Оказакі |
Лідуючий ланцюг |
Ланцюг, що запізнюється |
3'
Рис. 5.25. Схема організації реплісоми.
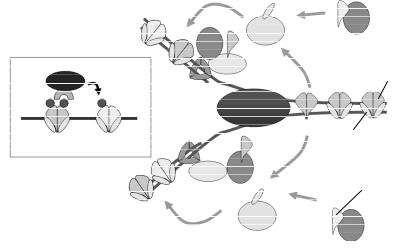
Зрозуміло, що нуклеосоми є суттєвим бар'єром на шляху реплісоми. Попереду реплікативної вилки відбувається декомпактизація хроматинової фібрили й тимчасове видалення відносно легко взаємодіючого з ДНК гістону Н1. Нуклеосоми руйнуються у два етапи (рис. 5.26): спочатку видаляється димер гістонів Н2А-Н2В, потім найміцніше зв'язаний із ДНК тетрамер (Н3-Н4)2. Процес видалення гістонових комплексів забезпечується активністю комплексів ремоделювання хроматину і присутністю проміжних акцепторів гістонів – гістонових шаперонів. Такі шаперони зв'язують гістонові комплекси, що витісняються реплісомою, а потім виконують роль факторів збирання нуклеосом позаду реплікативної вилки.
До найбільш вивчених факторів збирання нуклеосом, що працюють під час реплікації, відносять: NAP1 (Nucleosome
198
Assembly Protein), що має підвищену спорідненість до димерів Н2А-Н2В; трьох-субодиничний комплекс CAF1 (Chromatin Assembly Factor) та білок ASF1 (Anti-Silencing Function) –
споріднені до гістонів Н3-Н4 і PCNA, за рахунок чого вказані гістони (імовірно, у формі димерів Н3-Н4) спрямовуються до основи реплікативної вилки (рис. 5.26); RSF (Remodeling and Spacing Factor), який є проміжним акцептором гістонів, а також сприяє регулярному розподілу відновлених нуклеосом на ДНК. У сприянні такому рівномірному розподілу на дочірніх ланцюгах ДНК приймають участь також комплекси ремоделювання родини
ISWI.
ASF1
NAP1
ASF1
CAF1
H3-H4
Реплісома
PCNA |
|
H2A-H2B |
|
|
|
||
CAF1 |
ASF1 |
Гістони, |
|
синтезовані |
|||
|
|||
|
|
||
|
|
de novo |
|
|
NAP1 |
ASF1 |
|
|
|
Рис. 5.26. Руйнування та відновлення нуклеосом у реплікативній вилці (синтезовані de novo гістони Н2А-Н2В не показано). На вставці: механізм відновлення хімічних модифікацій (кульки), що несуть батьківські гістони.
Відновлення нуклеосом позаду реплікативної вилки відбувається також у дві стадії: першим на ДНК повертається тетрамер (Н3-Н4)2 (у вигляді двох димерів, що звільняються від
199
гістонових шаперонів), який зв'язує два димери Н2А-Н2В. По двох дочірніх ланцюгах ДНК гістонові комплекси розподіляються випадково, до них додаються гістони, синтезовані в цитоплазмі de novo під час реплікації. Ці нові гістони транспортуються до ядра у вигляді комплексів димерів Н2А-Н2В і Н3-Н4 з відповідними шаперонами. Таким чином, “ старі” гістони, що несуть на собі певні характерні модифікації, повертаються на ту саму ділянку ДНК обох ланцюгів, на якій вони були присутні на материнській молекулі. До ділянок хроматину поза реплікативною вилкою рекрутуються відповідні ферменти, котрі здійснюють аналогічні модифікації щойно синтезованих гістонів, використовуючи "читаючі головки" (бромодомени, хромодомени тощо) – патерн модифікацій відновлюється, що сприяє збереженню певного функціонального стану ділянки хроматину в дочірніх клітинах. Принцип відновлення модифікацій на нових гістонах за допомогою батьківських в якості "матриць" зображено на вставці рис. 5.26 – саме такий механізм, який реалізується через білок НР1 у гетерохроматині розглядався у попередньому підрозділі. Відновлення патерну модифікацій гістонів стосується в першу чергу гістонів Н3 та Н4 (досить інтенсивний обмін димерами Н2А-Н2В між різними ділянками хроматину робить ці гістони значно менш важливими для епігенетичної спадковості).
Важливу роль інтеграції процесів відновлення нуклеосом та епігенетичних маркерів в процесі реплікації відіграє PCNA – крім гістонових шаперонів, він має спорідненість і до багатьох ферментів, що здійснюють модифікації гістонів. Аналогічно, саме PCNA рекрутує до реплікативної вилки ДНКметилтрансферазу, яка відновлює патерн метилювання динуклеотидів CpG в ДНК (підпідрозд. 5.5.3).
Дуплікація надзвичайно великого еукаріотичного геному повинна відбутися в клітині, що готується до поділу, однократно і тільки однократно. Загальна система регуляції реплікації в еукаріотів залишається далекою від остаточного розуміння. Найважливішим для такого розуміння є питання про координацію роботи різних репліконів під час S-фази. Відомо,
200
що різні ділянки хроматину реплікуються не одночасно (виключення становлять дріжджі Saccharomyces cerevisiae, в клітинах яких реплікація ініціюється практично одночасно на чітко визначених ориджинах): існує певний "розклад" ініціації реплікації в різних репліконах, і S-фазу прийнято розділяти на ранню, середню і пізню стадії. На ранніх стадіях здійснюється реплікація еухроматинових зон, які активно транскрибуються, на пізніх – транскрипційно мовчазного гетерохроматину. При цьому ориджини "вмикаються" випадково – так, що часовий розподіл ініціації реплікації на різних ориджинах варіює від одного клітинного циклу до іншого.
Ориджини ранньої S-фази, з одного боку, розташовані в зонах, що активно транскрибуються, з іншого – характеризуються порівняно низької швидкістю ініціації реплікації. Випадковий характер вмикання ориджинів залишається і на пізніх стадіях, але ефективність ініціації значно зростає – напевно, за рахунок підвищення концентрації факторів ініціації реплікації, які звільняються від ориджинів, де ініціація вже відбулась. При цьому ймовірність ініціації є підвищеною на ориджинах, сусідніх до реплікона, де вже відбувається синтез ДНК.
Ці факти укладаються в модель, згідно якої реплікація відбувається за "принципом доміно" (рис. 5.27). Важливим фактором визначення ранніх ориджинів є, напевно, "відкрита" структура хроматину в ділянках, що активно транскрибуються: це сприяє ефективному зв'язуванню в таких ділянках і факторів транскрипції, і факторів ініціації реплікації. Реплікація, що відбувається в кількох таких ранніх репліконах, індукує ініціацію реплікації на сусідніх ориджинах – принаймні один із факторів такого впливу може полягати в підвищенні структурної динаміки хроматину на ділянках, що фланкують активний реплікон. У результаті ориджини стають більш доступними, там також розпочинається реплікація, а це, в свою чергу, індукує ініціацію на сусідніх ділянках: процес продовжується лавиноподібно (із підвищенням ефективності ініціації) і виключає наявність прогалин, які б залишились нереплікованими.
