
Sivolob_A_V__Afanasyeva_K_S_Molekulyarna_organ
.pdf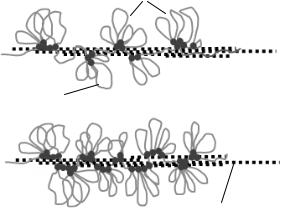
241
Хромомери
Фібрила 30 нм
Білки ядерного матриксу
Рис. 6.13. Початкові етапи компактизації хромосоми згідно хромомерної моделі.
Розглянуті моделі структури мітотичної хромосоми мають спільну рису – вони передбачають наявність суцільної скелетної основи, побудованої з конденсинів та топоізомерази ІІ. Ці моделі добре пояснюють випетлювання ДНК після видалення гістонів і аксіальне розміщення конденсинів та топоізомерази ІІ. Але всі ці моделі є абсолютно несумісними з описаними у попередньому підрозділі даними про високу еластичність хромосоми: суцільна осьова білкова структура не може бути розтягнутою в 5 разів та повернутись до вихідного стану після зникнення розтягувальної сили.
Натомість, як зазначено у попередньому підрозділі, результати дослідження мікромеханіки хромосом привели до формулювання моделі хроматинової сітки (chromatin network model). Згідно цієї моделі білки хромосомного скефолду не утворюють суцільного скелету всередині хромосоми – окремі білкові елементи (найімовірніше, конденсини) скріплюють (прошивають) сітку, що формується хроматиновою фібрилою (рис. 6.10). Модель сітки цілком узгоджується із визволенням петель ДНК після видалення гістонів (рис. 6.11) – після такого
242
визволення всередині хромосоми залишаються окремі блоки (конденсинові зшивки основ петель), які сприймаються під електронним мікроскопом як скефолд. Такий "дискретний скефолд" зовсім не обов'язково формує суцільну монолітну структуру (власне, така дискретність цілком узгоджується з зображенням, наведеним на рис. 6.11). Але велика кількість даних свідчить також і про те, що білкові зшивки, які скріплюють сітку, мають бути зосереджені, в основному, в аксіальній частині хромосоми. Одна із спроб інтегрувати дані, отримані за допомогою різних підходів, представлена у моделі на рис. 6.14.
Топоізомераза ІІ
Конденсини ІІ
Хромомери
Конденсини ІІ
Когезини
Конденсини І
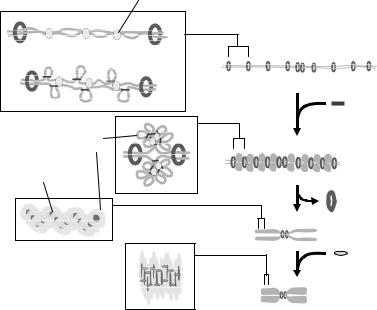
Рис. 6.14. Схема послідовних стадій компактизації мітотичної хромосоми (пояснення в тексті). Адаптовано з Marko (2008).
Загальний сценарій компактизації хромосоми виглядає, згідно цієї моделі, наступним чином. Після реплікації сестринські хроматиди у вигляді хроматинових фібрил з'єднані
243
між собою когезиновими комплексами по всій довжині зі щільністю 1 комплекс на ~10 тис пар основ. На фібрилах присутня також топоізомераза ІІ, активність якої є необхідною для роз'єднання сестринських хроматид після реплікації. На початку профази, після фосфорилювання конденсинів ІІ, вони зв'язуються з фібрилами та індукують формування надспіральних витків. Поява перехрещень ДНК змушує топоізомеразу ІІ впізнавати ці перехрещення і, ймовірно, індукувати утворення вузлів в межах однієї фібрили та розділяти переплетені сестринські хроматиди. Частина міжхроматидних зачеплень при цьому, напевно, залишається – відомо, що активність топоізомерази ІІ є необхідною на перших етапах розходження хромосом при мітозі (розділ 7). Результатом сумісної активності конденсинів ІІ та топоізомерази ІІ є накопичення петель, які об'єднуються у розеткові структури – хромомери, обмежені когезиновими комплексами. Власне, поява хромомерів є просто наслідком наявності когезинів, що чергуються по ланцюгу і створюють перешкоди для компактизації там, де вони знаходяться. Об'єднання петель у розетки також обумовлено обмеженістю простору для компактизації, а конденсини та топоізомераза ІІ, які взаємодіють, головним чином, з основами петель (з перехрещеннями), автоматично опиняються всередині розетки (і потім залишаються всередині хромосоми). Можна сказати, що когезини, таким чином, каналізують хаотичний процес утворення хроматинової сітки у певному напрямі.
Продовження компактизації після утворення хромомерів є несумісним з наявністю когезинових комплексів – відбувається їх масоване видалення. Після зняття когезинових обмежень хромомери набувають змоги взаємодіяти між собою, утворюючи більш компактну структуру. При таких взаємодіях утворюються додаткові зшивки та перехрещення ділянок ДНК. На такі перехрещення рекрутується топоізомераза ІІ, яка, таким чином, частково виштовхується із хромомерів, що призводить до чергування скупчень конденсинів та топоізомерази ІІ уздовж хромосоми. Продовження компактизації не відбувається тільки там, де залишаються когезини – в зоні центромер, які після
244
закінчення компактизації хромосоми зберігають порівняно невеликий рівень компактності, що й надає їм вигляд перетяжок.
Після зникнення ядерної оболонки з хромосомою починають динамічно взаємодіяти конденсини І, які ще більше підсилюють ступінь компактизації, утворюючи динамічні білкові зшивки. Одночасно з конденсиновими зшивками, за рахунок активності топоізомерази ІІ формуються топологічні зшивки – вузли, які суттєво стабілізують компактний стан. Одночасно з підвищенням рівня компактизації з хромосомою взаємодіють двохвалентні катіони, і ця взаємодія ще більше сприяє стабілізації компактного стану хромосоми. При цьому іони Ca2+, інактивуючи топоізомеразу ІІ, фіксують зроблені нею топологічні зшивки. Цілком можливо також, що конденсини, які здатні взаємодіяти між собою, можуть утворювати динамічні тимчасові комплекси – своєрідні елементи скелетних структур. Прикладом хромосом, де, ймовірно, наявні такі структури, є згадані в попередньому підрозділі хромосоми яйцеклітин
Xenopus.
Наприкінці мітозу відбувається дисоціація конденсинів, яка ініціює процес декомпактизації хромосом. Руйнування хроматинової сітки сприяє дисоціації двохвалентних катіонів та активації топоізомерази ІІ, яка розділює топологічні зшивки, забезпечуючи остаточну декомпактизацію.
Отже, на сьогодні можна сформулювати наступні твердження щодо структурної організації мітотичної хромосоми: (1) мітотична хромосома являє собою компактизовану та реорганізовану хроматинову фібрилу, присутню в інтерфазному ядрі, і ця компактизація відбувається у декілька послідовних етапів; (2) головними факторами компактизації є конденсинові комплекси, топоізомераза ІІ та двохвалентні катіони; (3) хроматинова фібрила всередині мітотичної хромосоми формує сітку, вузли якої стабілізовані білковими (конденсиновими) зшивками та топологічними зачепленнями елементів сітки; (4) білкові зшивки концентруються в аксіальній зоні хромосоми.
245
Рекомендована література
Загальна
Koshland, D., Strunnikov, A. Mitotic chromosome condensation // Annu. Rev. Cell Dev. Biol. – 1996. – Vol. 12. – P. 305-333.
Marko, J.F. Micromechanical studies of mitotic chromosomes // Chromosome Res.– 2008. – Vol. 16. – P. 469-497.
Ohta, S., Bukowski-Wills, J.-C., Sanchez-Pulido, L, et al. The protein composition of mitotic chromosomes determined using multiclassifier combinatorial proteomics // Cell. – 2010. – Vol. 142.
– P. 810-821.
Woodcock, C.L., Ghosh, R.P. Chromatin higher-order structure and dynamics // Cold Spring Harb. Perspect. Biol. – 2010. – Vol. 2. – a000596.
Роль топоізомерази ІІ в конденсації мітотичних хромосом
Cuvier, O., Hirano, T. A role of topoisomerase II in linking DNA replication to chromosome condensation // J. Cell Biol. – 2003. – Vol. 160. – P. 645-655.
Escargueil, A.E., Plisov, S.Y., Skladanowski, A., Borgne, A., Meijer, L., Gorbsky, G.J., Larsen, A.K. Recruitment of cdc2 kinase by DNA topoisomerase II is coupled to chromatin remodeling // FASEB J. – 2001. – Vol. 15. – P. 2288-2290.
Kawamura, R., Pope, L.H., Christensen, M.O., Sun, M., Terekhova, K., Boege, F., Mielke, C., Andersen, A.H., Marko, J.F.
Mitotic chromosomes are constrained by topoisomerase II–sensitive DNA entanglements // J. Cell Biol. – 2010. – Vol. 1 88. – P. 653-663.
Wells, N.J., Hickson, I.D. Human topoisomerase II alpha is phosphorylated in a cell-cycle phase-dependent manner by a prolinedirected kinase // Eur. J. Biochem.– 1995. – Vol. 2 31. – P. 491-497.
Білки SMC, конденсини та когезини
246
Díaz-Martínez, L.A., Giménez-Abián, J.F., Clarke DJ.
Chromosome cohesion – rings, knots, orcs and fellow ship // J. Cell Sci. – 2008. – Vol. 121. – P. 2107-2114.
Hagstrom, K.A., Meyer, B.J. Condensin and cohesin: more than chromosome compactor and glue // Nat. Rev. Genet. – 2010. – Vol. 11. – P. 520-534.
Hirano, T. SMC proteins and chromosome mechanics: from bacteria to humans // Phil. Trans. R. Soc. B. – 200 5. – Vol. 360. – P. 507-514.
Hirano, T. At the heart of the chromosome: SMC proteins in action // Nat. Rev. Mol. Cell Biol. – 2006. – Vol. 7. – P. 311-322.
Hudson, D.F., Marshall, K.M., Earnshaw, W.C. Condensin: Architect of mitotic chromosomes // Chromosome Res.– 2009. – Vol.17. – P. 131-144.
Jessberger, R. The many functions of SMC proteins in chromosome dynamics // Nat. Rev. Mol. Cell Biol. – 2002. – Vol. 3.
– P. 767-778.
Nakajima, M., Kumada, K., Hatakeyama, K., Noda, T., Peters, J.- M., Hirota1, T. The complete removal of cohesin from chromosome arms depends on separase // J. Cell Sci. – 2007. – Vol. 120. – P. 4188-4196.
Ono, T., Losada, A., Hirano, M., Myers, M.P., Neuwald, A.F., Hirano, T. Differential contributions of condensin I and condensin II to mitotic chromosome architecture in vertebrate cells // Cell.– 2003.
– Vol. 115. – P. 109-121.
Peters,J.-M., Tedeschi, A., Schmitz, J. The cohesin complex and its roles in chromosome biology // Genes Dev. – 2008. – Vol. 22. – P.3089-3114.
Strick, T.R., Kawaguchi, T., Hirano, T. Real-time detection of single-molecule DNA compaction by condensin I // Curr. Biol. – 2004. – Vol. 14. – P. 874-880.
Tanno, Y., Kitajima, T.S., Honda, T., Ando, Y., Ishiguro, K., Watanabe, Y. Phosphorylation of mammalian Sgo2 by Aurora B recruits PP2A and MCAK to centromeres // Genes Dev. – 2010. – Vol. 24. – P.2169–2179.
247
Роль неорганічних іонів в організації мітотичної хромосоми
Maniotis, A.J., Bojanowski, K., Ingber, D.E. Mechanical continuity and reversible chromosome disassembly within intact genomes removed from living cells // J. Cell Biochem. – 1997. – Vol. 65. – P. 114-130.
Poirier, M.G., Marko, J.F. Micromechanical studies of mitotic chromosomes // J. Muscle Res. Cell Motil. – 2002. – Vol. 23. – P. 409-431.
Strick, R., Strissel, P.L., Gavrilov, K., Levi-Setti, R. Cationchromatin binding as shown by ion microscopy is essential for the structural integrity of chromosomes // J. Cell Biol. – 2001. – vol.
155. – P. 899-910.
Механічні властивості мітотичної хромосоми
Almagro, S., Riveline, D., Hirano, T., Houchmandzadeh, B., Dimitrov, S. The mitotic chromosome is an assembly of rigid elastic axes organized by structural maintenance of chromosomes (SMC) proteins and surrounded by a soft chromatin envelope // J. Biol. Chem. – 2004. – Vol. 279. – P. 5118–5126.
Houchmandzadeh, B., Dimitrov, S. Elasticity measurements show the existence of thin rigid cores inside mitotic chromosomes // J. Cell Biol. – 1999. – Vol. 145. – P. 215-223.
Marko, J.F. Micromechanical studies of mitotic chromosomes // Chromosome Res.– 2008. – Vol. 16. – P. 469-497.
Nicklas, R.B. Measurements of the force produced by the mitotic spindle in anaphase // J. Cell Biol. – 1983. – Vol. 97. – P. 542-548.
Poirier, M.G., Marko, J.F. Micromechanical studies of mitotic chromosomes // J. Muscle Res. Cell Motil. – 2002. – Vol. 23. – P. 409-431.
Poirier, M.G., Marko, J.F. Mitotic chromosomes are chromatin networks without a mechanically contiguous protein scaffold // Proc. Natl. Acad. Sci. USA. – 2002. – Vol. 99. – P. 15393 -15397.
Poirier, M.G., Marko, J.F. Micromechanical studies of mitotic chromosomes // Curr. Top. Dev. Biol. – 2003. – Vol. 55. P. 75-141.
248
Моделі структури мітотичної хромосоми
Belmont, A.S. Mitotic chromosome scaffold structure: new approaches to an old controversy // Proc. Natl. Acad. Sci. USA. – 2002. – Vol. 99. – P. 15855–15857.
Coelho, P.A., Queiroz-Machado, J., Sunkel, C.E. Could condensin scaffold the mitotic chromosome? // Cell Cycle.– 2004. – Vol. 3. – P. 538-540.
Cook, P.R. A chromomeric model for nuclear and chromosome structure // J. Cell Sci.– 1995. – Vol. 108. – P. 2 927-2935.
Earnshaw, W.C., Laemmli, U.K. Architecture of metaphase chromosomes and chromosome scaffolds // J. Cell Biol. – 1983. – Vol. 96. – P. 84-93.
Kireeva, N., Lakonishok, M., Kireev, I., Hirano, T., Belmont, A.S.
Visualization of early chromosome condensation: a hierarchical folding, axial glue model of chromosome structure // J. Cell Biol. – 2004. – Vol. 166. – P. 775-785.
Laemmli, U.K., Maeshima, K.A Two-step scaffolding model for mitotic chromosome assembly // Dev. Cell. – 2003. – Vol. 4. – P. 467-480
Marko, J.F. Micromechanical studies of mitotic chromosomes // Chromosome Res.– 2008. – Vol. 16. – P. 469-497.
Paulson, J.R., Laemmli, U.K. The structure of histone-depleted metaphase chromosomes // Cell. – 1977. – Vol. 12. – P. 817-828.
Sumner, A.T. Scanning electron microscopy of mammalian chromosomes from prophase to telophase // Chromosoma. – 1991. – Vol. 100. – P. 410-418.
Ushiki, T., Hoshi, O., Iwai, K., Kimura, E., Shigeno, V. The structure of human metaphase chromosomes: its histological perspective and new horizons by atomic force microscopy // Arch. Histol. Cytol. – 2002. – Vol. 65. – P.377-390.
249
Розділ 7. Сегрегація мітотичних хромосом
Як описано у попередньому розділі, під час першої стадії мітозу – профази – відбувається компактизація хромосом та руйнування ядерної оболонки, в результаті чого хромосоми опиняються в цитоплазмі клітини. Одночасно з цим на полюсах клітини розпочинається формування мікротрубочок веретена поділу. По мірі росту мікротрубочок реалізуються контакти між ними та кінетохорами хромосом – мультибілковими комплексами, які збираються на центромерних ділянках. Клітина переходить на стадію метафази, під час якої здійснюється рух хромосом по мікротрубочках і врешті-решт хромосоми опиняються в екваторіальній площині – формується так звана метафазна пластинка.
Наступна за метафазою стадія анафази характеризується порушенням зв'язку між двома сестринськими хромосомами (хроматидами), і розпочинається їхній рух до полюсів. Досягнувши полюсів клітини, хромосоми припиняють рух – клітина вступає до стадії телофази, під час якої практично відбувається реверсія подій, що здійснювались у профазі: навколо хромосом знову утворюється ядерна оболонка і здійснюється їхня деконденсація. Після завершеного таким чином каріокінезу розпочинається цитокінез, в результаті якого утворюються дві ідентичні клітини з однаковими наборами хромосом.
Для утворення в процесі поділу двох функціональних клітин необхідно, щоб усі етапи клітинного циклу знаходилися під жорстким контролем: жодна наступна фаза не повинна розпочатися до тих пір, поки не буде успішно завершена попередня. Всі події на кожному етапі повинні бути інваріантними, необоротними і відбуватися у чітко визначений час.
Тригерами переходу від однієї фази до іншої є білки родини
циклін-залежних протеїнкіназ (CDKs). Вони зумовлюють фосфорилювання ряду білків-мішеней, що є необхідним для запуску внутрішньоклітинних процесів, характерних для конкретної фази клітинного циклу. Активність CDKs у клітині
250
змінюється в залежності від стадії, на якій клітина перебуває. Контроль активності здійснює особлива група білків, основними серед яких є цикліни: лише у безпосередньому зв’язку з циклінами циклін-залежні кінази здатні до фосфорилювання своїх мішеней. Найбільш важливими серед циклінів є дві родини цих білків – цикліни, що з'являються в момент переходу клітини від пресинтетичної до синтетичної фази (G1/S-цикліни або просто S-цикліни) та ті, що синтезуються при переході від постсинтетичної фази до мітозу (G2/М-цикліни або М-цикліни).
Увипадку, коли на якійсь стадії клітинного циклу відбувся "збій" у нормальному проходженні процесів, характерних для того чи іншого етапу, необхідно затримати клітину на цій стадії, щоб дати час для виправлення дефекту. Для цього існують групи білків, які контролюють кожний етап. Їх модифікації та каскадні реакції білок-білкових взаємодій створюють умови, за яких клітина не здатна "рухатись" далі по клітинному циклу. Момент, на якому відбувається перевірка готовності клітини перейти до наступної стадії, називають контрольною точкою або контрольно-пропускним пунктом (checkpoint). Під словом "checkpoint" часто розуміють скоріше не сам момент, коли здійснюється перевірка, а систему контролю – комплекс реакцій, які запускаються для того, щоб здійснити контроль і, у разі потреби, затримати клітину на певній стадії. Основними контрольними точками клітинного циклу є три: перша при переході від G1-фази до S-фази, друга – між G2-фазою та мітозом і третя – в момент розходження хромосом до полюсів.
Уцьому розділі увагу буде приділено, зокрема, саме процесам, які лежать в основі контролю розходження (сегрегації) хромосом. Очевидно, що рівноцінне розділення молекул ДНК між двома клітинами – важливий момент поділу, тому приєднання мікротрубочок до хромосом перед їхнім розходженням і є однією з контрольних точок клітинного циклу.
Тут спрацьовує спеціальна система контролю збірки веретена поділу (SAC, spindle assembly checkpoint), яка забезпечує виконання жорсткого правила: розходження хромосом під час анафази є можливим лише за умови коректного приєднання їх
