
Краткий курс органической химии. Часть 1
.pdf
изображения полярных связей в молекулах хлороводорода, метилхлорида и формальдегида.
|
|
|
|
H |
|
|
H |
Cl |
CH3 |
Cl |
H |
C=O |
|
|
|
|
|
|
|
|
Электроотрицательность атомов углерода зависит от их гибридизации.
Чем больше s-характер гибридных орбиталей, тем выше электроотрицательность соответствующего атома углерода. Так, в ряду sp3-, sp2- и sp-гибридизованных атомов углерода их электроотрицательность растет.
Поэтому связи между атомами углерода в разной гибридизации являются полярными.
CH3 CH=CH2 |
CH3 CH2 C C CH3 |
Поляризуемость связи – свойство связи изменять свою полярность под действием внешнего фактора. В качестве такого фактора может выступать,
например, полярный растворитель или полярный реагент. Неполярные связи поляризуются труднее, чем полярные. Кроме того, поляризуемость зависит от кратности связи, поскольку π-электроны, как более удаленные от ядер,
сильнее подвержены внешнему воздействию, чем σ-электроны.
4. Электронные смещения в молекулах органических соединений
Под влиянием полярных связей в молекулах органических соединений возникает смещение электронной плотности неполярных связей или изменяется полярность полярных связей.
Таким образом, происходит взаимное влияние атомов в молекулах. Это может происходить по двум механизмам смещения электронной плотности,
которые называют индуктивным и мезомерным эффектами.
4.1.Индуктивный эффект
Вмолекуле этана связь между атомами углерода неполярна, т.к. она
связывает два атома углерода, имеющих одинаковую электроотрицательность.
В молекуле хлорэтана из-за более высокой электроотрицательности атома
http://www.mitht.ru/e-library

хлора на связанном с ним атоме углерода возникает понижение электронной плотности и, следовательно, частичный положительный заряд, который компенсируется оттягиванием в его сторону электронов С-С-связи, что приводит к поляризации этой связи и возникновению частичного положительного заряда на втором атоме углерода.
|
|
|
|
|
|
|
|
|
|
CH3 |
|
CH2 |
|
H |
H3C |
|
CH2 |
|
Cl |
|
|
|
|
||||||
-I-эффект
Смещение электронной плотности одной связи, т.е. ее поляризацию,
вызываемую соседней полярной связью, называют индуктивным эффектом и
обозначают буквой I. В рассмотренном случае атом хлора притягивает к себе электронную плотность сильнее, чем атом водорода. Такой индуктивный эффект атома хлора называют отрицательным индуктивным эффектом (-I).
Если же какой-то атом или группа атомов отталкивают от себя электронную плотность сильнее, чем атом водорода, то такое воздействие на соседнюю связь называют положительным индуктивным эффектом (+I). Так, например, в
молекуле этиллития атом лития, как атом, имеющий меньшую электроотрицательность, чем атом углерода, проявляет положительный индуктивный эффект.
|
|
CH |
CH Li |
3 |
2 |
+I
Направление индуктивного эффекта может зависеть не только от электроотрицательности, но и от заряда атома. Так, в молекуле этанола гидроксильная группа проявляет –I-эффект, а в этоксид-анионе отрицательно заряженный атом кислорода, несмотря на высокую электроотрицательность,
отталкивает от себя электронную плотность, проявляя положительный индуктивный эффект.
|
|
|
|
|
H3C |
CH2 |
OH |
CH3 CH2 O |
|
|
|
-I |
|
+I |
http://www.mitht.ru/e-library

Величина индуктивного эффекта зависит от электроотрицательности атома, связанного с атомом углерода, а также от заряда на этом атоме. Так,
например, отрицательный индуктивный эффект аминогруппы меньше, чем –I-
эффект гидроксильной группы, поскольку атом кислорода более электроотрицателен, чем атом азота. В свою очередь -I-эффект гидроксильной группы меньше, чем -I-эффект гидроксониевой группы (например, в
протонированном этаноле), поскольку акцепторное действие положительно заряженного атома кислорода сильнее, чем нейтрального атома кислорода.
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|||||||
H3C |
|
CH2 |
|
OH |
H3C |
|
CH2 |
|
O |
|
H |
|||
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
H |
|||||
|
|
|
|
-I |
< |
|
|
-I´ |
||||||
Поляризуемость углерод-углеродных σ-связей невелика, поэтому по цепи
индуктивный эффект быстро затухает. Так, на третьем атоме углерода в молекуле 1-хлорбутана частичный положительный заряд значительно меньше,
чем на втором атоме, а на четвертом атоме углерода еще меньше, чем на
третьем.
CH3 CH2
CH2 CH2
CH2 CH2
CH2 Cl
Cl
Индуктивный эффект вызывает смещение электронной плотности не только σ-, но и π-связей, которые поляризуются сильнее. Так, в молекуле пропена связь между метильной группой и атомом углерода в sp2-гибридизации является полярной из-за различия электроотрицательностей атомов углерода.
Электронная плотность этой σ-связи смещена в сторону атома углерода в sp2-
гибридизации. Таким образом, метильная группа проявляет по отношению к соседней двойной связи +I-эффект, вызывая смещение электронной плотности составляющих ее σ- и π-связи, причем поляризация последней происходит значительно сильнее из-за большей подвижности π-электронов. Частичные заряды на атомах углерода, связанных двойной связью, показывают поляризацию прежде всего π-электронной плотности.
|
|
|
|
F |
|
|
CH2=CH |
CH3 |
|
F |
|||
|
|
CH2=CH |
C |
|
||
|
|
|
|
F |
|
|
http://www.mitht.ru/e-library
4.2. Сопряжение орбиталей: делокализация связей, мезомерный эффект
Рассмотренные до сих пор связи характеризуются локализацией электронов. Молекулы, ионы или свободные радикалы, в которых атомы связаны такими связями, можно описать одной электронной формулой, в
которой обобществленные электронные пары (электроны связей) принадлежат только двум атомам. Такие электронные формулы называют структурами Льюиса.
Однако реальное строение многих соединений не может быть адекватно описано структурой Льюиса, поскольку в них одна пара (или больше, чем одна)
электронов принадлежит не только двум атомам, а охватывают три атома (или большее количество атомов). Такие связи называют делокализованными.
Все структуры, в которых имеются делокализованные связи,
характеризуются взаимодействием орбиталей, которое не приводит к образованию локализованной ковалентной связи. Такое взаимодействие называют сопряжением орбиталей.
4.2.1.π-π-Сопряжение.
Взаимодействие двух (или более) π-связей возможно только тогда, когда
двойные связи разделены одной простой связью. В молекуле 1,3-бутадиена все атомы углерода находятся в sp2-гибридизации. Четыре р-орбитали,
перекрываясь попарно, образуют две π-связи: между первым и вторым, а также между третьим и четвертым атомами углерода. Однако р-орбитали второго и третьего атомов углерода также взаимодействуют, частично перекрываются.
Это и есть сопряжение двух π-связей. Таким образом, между вторым и третьим атомами углерода в результате π-π-сопряжения возникает некоторая π-
электронная плотность. Описать такое явление с помощью формулы Льюиса невозможно, поскольку такая формула показывает только локализованные между двумя атомами связи. Поэтому для описания молекул с делокализованными связями используют не одну формулу Льюиса, а набор
http://www.mitht.ru/e-library

структур Льюиса, в которых делокализованные связи локализуют между разными атомами.
Такие структуры называют также каноническими или граничными.
Считают, что реальное строение представляет собой как бы гибрид всех граничных структур, которые вносят определенный вклад в реальное строение молекулы. Ниже приведены три канонические или граничные структуры,
описывающие строение 1,3-бутадиена. Первая из них – с локализованными между первым и вторым, а также между третьим и четвертым атомами углерода π-связями – вносит наибольший вклад в реальную структуру молекулы. Однако можно представить себе и другое распределение электронов на четырех р-атомных орбиталях: а именно, обобществление двух электронов на р-орбиталях второго и третьего атомов углерода с образованием π-связи и локализация неподеленной пары электронов на одной из оставшихся р-
орбиталей. Последний вариант распределения электронов на четырех р-
орбиталях дает две эквивалентные канонические структуры, в которых на крайних атомах возникают заряды – на атоме с полностью заполненной р-
орбиталью отрицательный заряд, а на атоме с вакантной р-орбиталью – положительный. Две эти граничные структуры вносят меньший вклад в реальную структуру 1,3-бутадиена, поскольку в них два атома углерода несут заряды. Однако они дают представление о том, что между вторым и третьим атомами углерода связь не совсем одинарная, т.е. ее порядок немного больше единицы. В наборе граничных структур взаимосвязь между ними показывают двойной стрелкой ↔, которую ни в коем случае нельзя смешивать со знаком равновесия. Надо помнить, что граничные структуры реально не существуют, а
используются только для описания действительной структуры с делокализованными связями.
CH2 CH CH
CH CH CH2
CH2 

 CH2 CH
CH2 CH CH CH2
CH CH2 
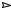 CH2 CH CH CH2
CH2 CH CH CH2
http://www.mitht.ru/e-library

Явление, когда действительная структура молекулы описывается совокупностью граничных структур Льюиса, называется мезомерией («между частями»).
Рассмотренное π-π-сопряжение в молекуле 1,3-бутадиена не приводит к поляризации связей. Если же одна из сопряженных π-связей полярна, как это имеет место, например, в молекуле акролеина (пропеналя), то и неполярная по определению углерод-углеродная π-связь становится полярной, поскольку вся сопряженная система из четырех π-электронов смещается к более электроотрицательному атому кислорода. Такое влияние полярной π-связи карбонильной группы на сопряженную с ней углерод-углеродную π-связь называют отрицательным мезомерным эффектом (-М-эффект).
Делокализация π-связей в этом случае может быть отражена различными способами:
набором граничных структур (одна из них содержит заряженные атомы и поэтому вносит, очевидно, меньший вклад в реальную структуру)
CH2=CH CH=O


 CH2 CH=CH O
CH2 CH=CH O
одной граничной формулой Льюиса из набора, которая в большей степени приближена к реальному строению акролеина, с изображением смещения электронной плотности изогнутыми стрелками от связи к соответствующему атому или к соседней одинарной связи
|
|
|
CH2=CH CH=O или |
CH2=CH CH=O |
|
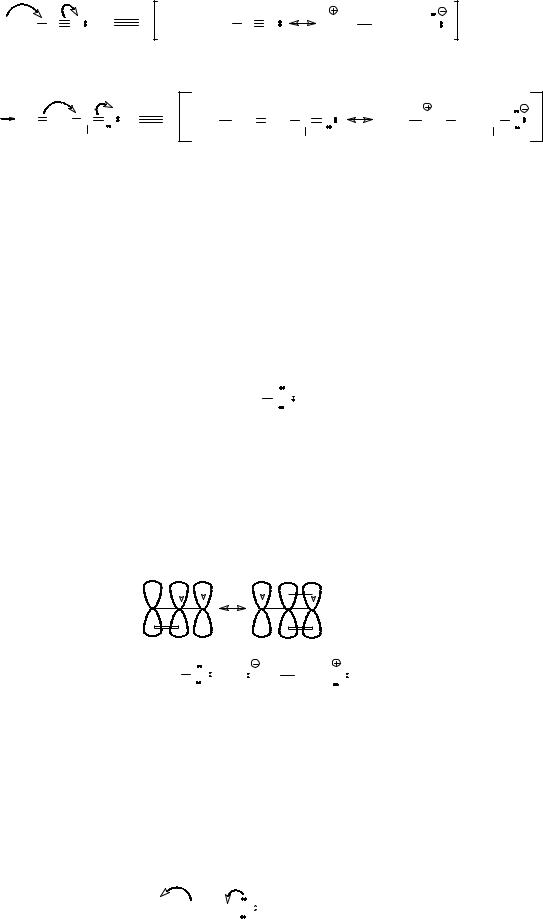
Таким образом, отрицательный мезомерный эффект могут проявлять те заместители, в которых имеется полярная двойная или тройная связь, если она оказывается в сопряжении с углерод-углеродной двойной или тройной связью,
т.е. отделена от нее одной простой связью. Так, в молекуле пропеннитрила -М-
эффект проявляет цианогруппа, а в молекуле 2-бутеновой кислоты – карбоксильная группа.
http://www.mitht.ru/e-library
|
|
CH2=CH C N |
CH2 |
CH=C=N |
CH2=CH C N |
||||
пропеннитрил |
|
|
|
|
|
|
CH CH CH C O |
CH CH CH=C O |
|
CH3 CH CH C O |
||||
|
OH |
3 |
|
3 |
|
|
OH |
OH |
|
2-бутеновая кислота
4.2.2.р-π-Сопряжение.
Вэтом виде сопряжения речь идет о взаимодействии р-орбитали атома с
соседней π-связью, которая отделена от него только одной простой связью.
Рассмотрим строение винилхлорида, в котором атом хлора связан с sp2-
гибридным атомом углерода двойной связи.
CH2=CH Cl
π-Электроны этой связи и одна из р-орбиталей атома хлора с неподеленной парой электронов находятся в сопряжении, которое приводит к делокализации π-связи и неподеленной пары электронов. Это можно представить двумя способами распределения этих четырех электронов (двух связанных и неподеленной пары) на трех орбиталях, т.е. набором двух граничных структур. 





CH2=CH Cl
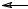

 CH2 CH=Cl
CH2 CH=Cl
Вторая граничная структура (по сравнению с первой) вносит меньший вклад в действительную структуру винилхлорида, поскольку в ней атомы несут заряды, однако она показывает, что связь углерод-хлор не совсем одинарная за счет р-π-сопряжения. Это увеличение порядка этой связи обозначают изогнутой стрелкой от р-электронов атома хлора на связь между атомом углерода и атомом хлора.
|
|
CH2=CH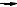 Cl
Cl
http://www.mitht.ru/e-library

Таким образом, атом хлора смещает на себя σ-электроны связи углерод-
хлор (-I-эффект), но одновременно и подает р-электроны в сторону двойной связи. Последний эффект смещения элекронной плотности называют положительным мезомерным эффектом (+М-эффект). Вторая изогнутая стрелка показывает смещение π-электронов двойной связи в сторону крайнего атома углерода. На такое смещение указывает и вторая граничная структура с отрицательным зарядом на крайнем атоме углерода.
+М-Эффект проявляют заместители, в которых атом, непосредственно связанный с кратной связью, имеет на р-орбитали неподеленную пару электронов. Так, например, в молекуле винилметилового эфира метоксигруппа,
проявляя по отношению к углерод-углеродной связи –I-эффект, одновременно
оказывает +М-эффект в результате р-π-сопряжения.
CH2=CH O CH3 |
CH2=CH O CH3 |
CH2 CH O CH3 |
Аналогичное смещение электронной плотности происходит в молекуле винилдиметиламина, где в качестве заместителя с +М-эффектом выступает
диметиламиногруппа. 
CH2=CH N CH3 CH3
N CH3 CH3
Величина положительного мезомерного эффекта зависит от электроотрицательности атома – донора р-электронной пары электронов, а
также от энергетического уровня, на котором эта пара находится. Так, +М-
эффект метоксигруппы по величине меньше, чем +М-эффект диметиламиногруппы, поскольку атом азота менее электроотрицателен, чем атом кислорода, и, следовательно, легче предоставляет неподеленную пару р-
электронов в сопряжение. С другой стороны, +М-эффект аминогруппы несравнимо сильнее, чем +М-эффект атома хлора, хотя электроотрицательности атомов азота и хлора практически одинаковы. Однако хлор является элементом третьего периода, следовательно, его р-орбиталь
http://www.mitht.ru/e-library

имеет значительно более высокую энергию, чем орбитали атома углерода.
Поэтому перекрывание 2р-орбитали углерода и 3р-орбитали атома хлора менее эффективно, чем перекрывание 2р-орбиталей атомов углерода и азота.
+М-эффект: N(СН3)2 > ОСН3 >> Сl
5. Изомерия органических соединений
Изомеры – это вещества, имеющие одинаковый качественный и количественный состав, отражаемый общей формулой, но проявляющие различные свойства, причиной чего является их различное строение. Например,
общей формуле С4Н8 отвечают следующие изомеры:
CH2=CHCH2CH3 |
CH3 |
CH3 |
CH3 |
CH3 |
CH3 |
C=CH2 |
|
C=C |
|
C=C |
|
|
|
|
H |
CH3 |
||||
|
H |
H |
H |
|
|
|
1-бутен |
цис-2-бутен |
транс-2-бутен |
2-метилпропен |
|||
CH3
циклобутан метилциклопропан
Среди представленных выше изомеров есть изомеры, имеющие различную последовательность соединения атомов в молекуле (структурные изомеры) и изомеры одинаковой структуры, имеющие различное расположение атомов или групп атомов в пространстве (пространственные изомеры или
стереоизомеры).
5.1.Структурная изомерия
Взависимости от того, чем отличаются друг от друга изомеры, имеющие
различную последовательность соединения атомов, выделяют следующие виды
структурной изомерии:
http://www.mitht.ru/e-library

изомерия углеродного скелета (например, бутан и изобутан, 1-бутен и 2-
метилпропен, циклобутан и метилциклопропан);
изомерия положения, или региоизомерия (например, 1-бутен и любой из 2-
бутенов, 1-хлорпропан и 2-хлорпропан, орто- и пара-нитрофенолы);
CH3 |
|
CH2 |
|
CH2Cl |
CH3 |
|
|
CH |
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|||
1-хлорпропан |
2-хлорпропан |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
OH |
OH |
|||||||||||
орто-нитрофенол |
|
|
|
NO2 |
|
|
|
|
|
пара-нитрофенол |
|||||||
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|||||||||
NO2
изомерия функциональных групп (например, этанол и диметиловый эфир,
ацетон и 1-пропен-2-ол).
CH3CH2OH CH3OCH3 CH3CCH3 CH2=CCH3 O OH
этанол |
диметиловый эфир |
ацетон |
1-пропен-2-ол |
5.2. Стереоизомерия
Пространственная изомерия, или стереоизомерия – это явление существования изомеров, имеющих одинаковую структуру и различное расположение атомов или групп атомов в пространстве. Стереоизомеры подразделяют на конформационные и конфигурационные изомеры. Примером последнего типа стереоизомеров является существование двух конфигурационных изомеров структуры 2-бутена: цис- и транс-2-бутены.
5.2.1.Конформационная изомерия.
Из-за осевой симметрии σ-связей возможно практически свободное
вращение вокруг простых углерод-углеродных связей. При этом реализуются самые различные взаимные расположения в пространстве не связанных между собой атомов и групп атомов, характеризующиеся определенной потенциальной энергией и называемые конформациями.
http://www.mitht.ru/e-library
