
Краткий курс органической химии. Часть 1
.pdf
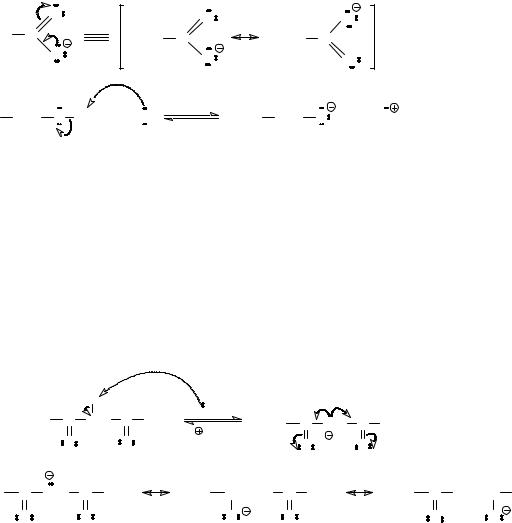
электроотрицательных атомах, и поэтому устойчивость сопряженных оснований в этом ряду соответственно увеличивается, а их сила уменьшается.
BH3<CH4<NH3<H2O<HF |
сила кислот увеличивается |
BH2< CH3< NH2 < HO < F |
устойчивость сопряженных |
|
оснований увеличивается |
BH2 > CH3 >NH2> HO > F |
сила оснований уменьшается |
Устойчивость сопряженным |
основаниям придает любое уменьшение |
локализации отрицательного заряда. Поэтому сила кислот увеличивается, если в сопряженном основании наблюдается смещение электронной плотности от атома, несущего в сопряженном основании отрицательный заряд. Так,
отрицательный индуктивный эффект заместителей приводит к усилению кислотных свойств и к уменьшению основных свойств. Например,
хлоруксусная кислота является почти в 100 раз более сильной кислотой, чем уксусная кислота, а хлорацетат-анион – более слабым основанием, чем ацетат-
анион. Это объясняется тем, что атом хлора в хлорацетат-анионе, будучи акцептором электронов (-I-эффект), оттягивает электронную плотность от отрицательно заряженной группы СОО–, в результате чего хлорацетат-анион оказывается устойчивее, чем ацетат-анион.
CH3 C |
O |
|
O |
|
рКа 4,76 |
+ H2O |
CH3 |
C |
+ H3O |
||
|
O H |
|
O |
|
|
CH2 C |
O |
|
O |
|
|
+ H2O |
CH2 C |
+ |
H3O |
рКа 2,86 |
|
Cl |
O H |
Cl |
O |
|
|
|
|
Более сильный акцептор – нитрогруппа – вызывает еще более сильное увеличение кислотных свойств нитроуксусной кислоты (рКа 1,68), поскольку эта группа еще сильнее стабилизирует сопряженное основание – нитроацетат-
http://www.mitht.ru/e-library
анион – за счет более сильного оттягивания электронной плотности от заряженной группировки, чем атом хлора в хлорацетат-анионе.
Кроме индуктивного эффекта, на устойчивость сопряженного основания и, следовательно, на силу кислоты оказывают влияние эффекты сопряжения.
Примером может служить более высокая кислотность уксусной кислоты (как,
впрочем, и других карбоновых кислот) по сравнению с этанолом (и другими спиртами). Ацетат-анион, в отличие от этилат-аниона, стабилизирован сопряжением р-орбитали заряженного атома кислорода с π-связью. В
результате сопряжения отрицательный заряд делокализован между двумя атомами кислорода и поэтому является менее концентрированным, чем в случае этоксид-аниона.
CH3 C |
O |
O |
O |
CH3 C |
CH3 C |
|
|
|
O |
O |
O |
CH3 CH2 O H + H2O |
CH3 CH2 O |
рКа ~16 |
|
+ H3O |
|||
Эффекты сопряжения, стабилизирующие сопряженное основание,
приводят к тому, что, С-Н-кислота становится более сильной, чем О-Н-кислота.
Так, например, кислотность 2,4-пентандиона (рКа 9) выше, чем кислотность воды или спиртов. Это объясняется высокой делокализацией отрицательного заряда в сопряженном основании благодаря двум карбонильным группам,
проявляющим –М-эффект. Такое «размазывание» заряда делает это основание очень устойчивым.
|
H |
B |
|
|
|
CH3 C CH C CH3 |
CH3 C CH C CH3 |
|
|||
_BH |
|
||||
O |
O |
O |
O |
|
|
CH3 C CH C CH3 |
CH3 C=CH C CH3 |
CH3 C CH=C CH3 |
|||
O |
O |
O |
O |
O |
O |
http://www.mitht.ru/e-library
3.2. Кислоты и основания Льюиса
Теория Льюиса представляет собой более широкую теорию кислот и оснований. Кислота Льюиса – это любая частица (нейтральная или заряженная), имеющая вакантную орбиталь и выступающая в кислотно-
основном взаимодействии акцептором пары электронов.
Основанием Льюиса (как и в теории Бренстеда) является частица,
имеющая доступную электронную пару (либо неподеленную, либо находящуюся на π-орбитали) и выступающая в кислотно-основном взаимодействии донором этой пары.
Вобщем виде кислотно-основное взаимодействие нейтральных кислоты
иоснования Льюиса выглядит следующим образом:
A +  B
B 
 A B
A B
Трифторид бора является кислотой Льюиса, поскольку атом бора, имея на внешней оболочке только шесть электронов, способен принять неподеленную электронную пару, которую ему предоставляет, например, атом кислорода в молекуле диэтилового эфира.
BF3 + 

 O(C2H5)2
O(C2H5)2 
 F3B O(C2H5)2
F3B O(C2H5)2
Кислотой Льюиса является и протон, поскольку он имеет вакантную s-
орбиталь, на которую он может принять любую доступную пару электронов,
например, электроны π-связи в молекуле этилена.
H + CH2=CH2 
 CH3 CH2
CH3 CH2
Карбокатионы также являются кислотами Льюиса, поскольку,
присоединяя нейтральную или отрицательно заряженную частицу, выступают как акцепторы пары электронов.
CH3 CH3
CH3 C
 +
+  OH
OH 
 CH3 C OH
CH3 C OH
CH3 CH3
http://www.mitht.ru/e-library

3.3. Кислотно-основный катализ
Катализ играет в органической химии очень большую роль, поскольку во многих случаях катализатор выполняет не типичную для катализаторов функцию увеличения скорости реакции, а делает реакцию вообще возможной.
Прежде всего это относится к катализу кислотами и основаниями. Так, бензол при обычных условиях с бромом вообще не реагирует, и только в присутствии кислоты Льюиса, такой, например, как трибромид железа, происходит реакция бромирования.
|
FeBr3 |
Br |
|
|
+ Br2 |
+ |
HBr |
||
|
Катализатор в этом случае помогает молекуле брома генерировать реакционноспособную частицу, с которой бензол, как нуклеофил, может реагировать: а именно, катион брома, который образуется в результате
кислотно-основного взаимодействия. Таким образом, кислота Льюиса
(трибромид железа) вызывает гетеролитический разрыв связи в неполярной
молекуле брома. |
|
Br Br + FeBr3 |
Br + FeBr4 |
Кислоты Бренстеда также часто используются в качестве катализатора.
Например, присоединение воды, которая является нуклеофильным реагентом, к
этилену, который также проявляет нуклеофильные свойства, может происходить только в кислой среде (протон над стрелкой символизирует сильную кислоту Бренстеда). Роль катализатора в данном случае заключается в кислотно-основном взаимодействии с этиленом, при этом он превращается в карбокатион – типичную электрофильную частицу, которая далее реагирует с
водой.
H |
H2O |
CH2 CH3 _ |
|
CH2 |
CH3 |
CH2=CH2 |
CH2 CH3 |
H |
|||
|
|
OH2 |
OH |
|
|
|
|
|
|
||
Последний |
пример показывает, что |
катализатор, |
участвуя |
в самой |
|
существенной стадии реакции, заключающейся в переносе протона между
http://www.mitht.ru/e-library

катализатором (кислотой Бренстеда) и субстратом, на последней стадии высвобождается в неизменном виде.
В тех случаях, когда катализаторы ускоряют реакции, которые без их участия протекают медленнее, их роль заключается в активировании реагентов:
кислоты увеличивают электрофильные свойства, основания – нуклеофильные.
Так, например, альдегиды и кетоны проявляют электрофильные свойства за счет высокой полярности карбонильной группы, однако в реакциях со слабыми нуклеофилами их электрофильности бывает недостаточно, поэтому в этих случаях используется кислотный катализ для увеличения их электрофильности.
Карбонильная группа при присоединении протона превращается в сопряженную кислоту, в которой электрофильность карбонильного атома углерода значительно выше, что видно из второй граничной структуры с локализацией положительного заряда на атоме углерода.
R |
|
H |
R |
|
R |
C O |
|
|
C O H |
C O H |
|
R' |
|
|
R' |
|
R' |
В реакциях фенолов часто используется основный катализ для увеличения его нуклефильности, поскольку при взаимодействии с основаниями фенол проявляет кислотные свойства и превращается в феноксид-анион,
нуклеофильность которого значительно выше.
O H |
O |
|
OH |
4.Задачи и упражнения
1.Определите, какие из перечисленных ниже частиц являются
электрофилами, а какие нуклеофилами: вода, протон, гидроксид-анион,
трет-бутил-катион, пропен, диоксид углерода, бром-катион, трихлорид железа, дихлорид цинка, бромид-анион, триоксид серы, метиламин,
http://www.mitht.ru/e-library

бензил-катион, 1,3-бутадиен, ацетат-анион, трихлорид бора,
гидроксиламин.
2.Сравните кислотные свойства следующих пар соединений: а) пропанон и пропан; б) метан и нитрометан; в) хлорметан и трихлорметан; г) этанол и
1,2-этандиол; д) 1-пропанол и пропановая кислота; е) этаналь и пропандиаль. Ответы обоснуйте сравнением устойчивости сопряженных оснований.
3.Сравните силу оснований в следующих парах: а) вода и аммиак; б) вода и сероводород; в) вода и гидроксид натрия; г) аммиак и метиламин; д)
гидроксид натрия и гидросульфид натрия; е) хлорид натрия и иодид натрия; ж) ацетат натрия и этилат натрия. Ответы обоснуйте.
4.Напишите уравнения кислотно-основного взаимодействия следующих соединений: а) протон и этилен; б) трихлорид алюминия и диметиловый эфир; в) уксусная кислота и метиламин; г) трихлорметан и амид натрия; д)
нитрометан и гидроксид натрия; е) этилат натрия и сероводород.
5.Определите, в какую сторону смещено равновесие следующих кислотно-
основных взаимодействий (ответ обоснуйте):
а) CH SNa |
+ |
CH OH |
|
|
|
CH ONa |
+ |
CH SH |
||||||||||||||
|
|
|
||||||||||||||||||||
|
|
|
||||||||||||||||||||
3 |
3 |
|
|
|
3 |
|
3 |
|
|
|
|
|
||||||||||
б) CH3COONa |
|
+ CH3CH2OH |
|
|
|
CH3COOH |
+ CH3CH2ONa |
|||||||||||||||
|
|
|
|
|||||||||||||||||||
|
|
|
|
|||||||||||||||||||
в) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
CH3CHCH=O + O=CHCH2CH=O |
|
|
|
|
CH3CH2CH=O + O=CHCHCH=O |
|||||||||||||||||
|
|
|
|
|||||||||||||||||||
|
|
|
||||||||||||||||||||
Na |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Na |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
http://www.mitht.ru/e-library
http://www.mitht.ru/e-library
Учебное пособие
Пом ога е в Але кс а ндр Ильич
КРАТКИЙ КУРС
ОРГАНИЧЕСКОЙ ХИМИИ
Часть 1
Теоретические основы органической химии.
Компьютерная верстка: Березовская Ю.В.
Подписано в печать …………………. Формат 60х90/16 Отпечатано на ризографе. Уч.-изд. л.
Бумага писчая. Тираж 120 экз. Заказ №………….. Лицензия на издательскую деятельность
ИД № 03507 от 15.12.2000
119571, Москва, пр. Вернадского, 86 ИПЦ МИТХТ им. М.В. Ломоносова
http://www.mitht.ru/e-library
