
Краткий курс органической химии. Часть 1
.pdf
Количество пространственных изомеров N для структуры с n хиральными атомами углерода может быть определено по формуле: N 2n , если нет мезоформ.
Следует также отметить, что диастереомеры могут существовать и для структур, в которых отсутствуют хиральные атомы углерода. Например, для структуры 1,3-диметилцклобутана, в котором нет асимметрических атомов углерода, существуют два диастереомера с различным расположением метильных групп относительно плоскости цикла: цис- и транс-1,3-
диметилциклобутаны. Конфигурация с расположением метильных групп по одну сторону от плоскости цикла обозначается приставкой цис-, а
конфигурация с расположенными по разные стороны от плоскости цикла метильными группами – транс-.
CH3 |
CH3 |
H |
CH3 |
H |
H |
CH3 |
H |
цис-1,3-диметилциклобутан |
транс-1,3-диметилциклобутан |
||
Другой пример – |
геометрические изомеры алкенов, |
в которых атомы |
|
углерода, связанные двойной связью, имеют два разных заместителя. Для структуры 2-бутена существуют две конфигурации двойной связи: с
расположением метильных групп по одну сторону двойной связи (может обозначаться как цис-конфигурация) или с расположением этих групп по разные стороны двойной связи (транс-конфигурация). Эти пространственные изомеры также являются диастереомерами.
CH3 |
|
CH3 |
CH3 |
|
H |
C |
|
C |
C |
|
C |
|
|
||||
|
|
||||
H |
|
H |
H |
|
CH3 |
цис-2-бутен транс-2-бутен
http://www.mitht.ru/e-library
6.Задачи и упражнения
1.Определите гибридизацию всех атомов углерода в молекулах следующих соединений:а) 2-метил-2-бутен; б) 2-бутеналь; в) 1-пропин; г) 1,2-пропадиен; д) 1-пентин-2-он; е) 4-гидрокси-3-оксобутановая кислота.
2.Определите гибридизацию каждого атома углерода и изобразите
перекрывание орбиталей при образовании всех связей в молекулах следующих соединений: а) пропен; б) пропин; в) 1,3-бутадиен; г) 1,2-
пропадиен.
3. Определите и обозначьте соответствующими стрелками все полярные связи в молекулах следующих веществ: а) 2-хлорпропан; б) 1-
хлор-3-пентанол: в) 2-гексен; г) 2-бутанон; д) 1-нитропентан; е) 3-
фторпропановая кислота; ж) этиллитий; з) втор-бутилметиловый эфир.
4. Изобразите и назовите эффекты заместителей, приводящие к электронным смещениям в молекулах следующих соединений: а) 1-
хлорпропан; б) 2-хлорпропен; в) 2-метил-2-бутен; г) 3-хлор-1-бутен; д)
пропаналь; е) пропеналь; ж) 2-метокси-1-пентен; з) 2-бутеновая кислота; и)
винилдиметиламин; к) 3-этокси-2-бутеналь.
5. Изобразите набор граничных структур для описания делокализации связей в следующих соединениях: а) 2-хлорпропен; б) 3-бутен-2-он; в) 2-
бутеналь; г) винилэтиловый эфир.
6.Изобразите и назовите все структурные изомеры следующих составов: а) С4Н8; б) С4Н8О.
7.Изобразите наиболее устойчивую конформацию для следующих соединений: а) пропан – относительно связи С(1)-С(2); б) 2-метилпропан –
относительно связи С(1)-С(2); в) 2-метилбутан – относительно связи С(2)-
С(3); г) 2,3-диметилбутан – относительно связи С(2)-С(3).
http://www.mitht.ru/e-library
8.Изобразите и назовите все структурные изомеры общей формулы С7Н16. Определите, для каких структур возможна конфигурационная изомерия?
9.В следующих структурах отметьте звездочкой асимметрические атомы углерода, если они имеются: а) 2-пропанол; б) 2-бутанол; в) 3-
хлоргексан; г) 2-бром-2-хлорпропан; д) 1,2-дибромпропан; е) 3-
гидроксипропаналь; ж) 2,3-дигидроксибутаналь; з) 1,2,3-пропантриол.
10. Для следующих структур изобразите двумя способами формулы пространственных изомеров и определите конфигурации хиральных атомов: а) 1,2-пропандиол; б) 2-бромпропановая кислота; в) 3-амино-2-
нитропропаналь; г) 3-метил-1-пентен.
11. Для следующих структур изобразите проекционные формулы Фишера пространственных изомеров и определите конфигурации асимметрических атомов углерода: а) 2,3-дигидроксибутаналь; б) 1,2,3,4-
бутантетраол; в) 1,2-дибром-3-хлорбутан.
http://www.mitht.ru/e-library

ОСНОВЫ ТЕОРИИ ОРГАНИЧЕСКИХ РЕАКЦИЙ
1. Классификация органических реакций по типу разрыва связи
При взаимодействии органических соединений с различными реагентами происходят процессы, связанные с разрывом ковалентных связей в субстрате и реагенте и с образованием новых связей.
Большинство органических реакций в зависимости от того, каким образом происходит разрыв связи, разделяют на два типа.
1.1. Гомолитические или свободнорадикальные реакции
Если при разрыве ковалентной связи обобществленная пара электронов распаривается, и образуются фрагменты, на каждом из которых остается один неспаренный электрон, такой разрыв связи называют гомолитическим или
свободнорадикальным, поскольку образующиеся фрагменты являются
свободными радикалами.
A B 
 A
A +
+  B
B
Гомолитический разрыв (или гомолиз) характерен, прежде всего, для неполярных и слабополярных связей, т.е. для связей между атомами, мало отличающимися по электроотрицательности. Гомолитический разрыв связи происходит чаще всего либо при термическом воздействии на вещество
(термическое расщепление), либо при воздействии на вещество электромагнитного излучения с достаточной для разрыва связи энергией
(фотохимическое расщепление). Так при нагревании алканов до высоких температур (>500О С) происходит гомолиз С-С-связей (крекинг алканов).
Например, молекула этана может расщепиться на два метильных радикала.
t  CH3 CH3
CH3 CH3 
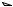 2 CH3
2 CH3
При взаимодействии алканов с хлором под действием ультрафиолетового света происходит фотолиз связи в молекуле хлора.
Cl Cl |
h |
2Cl |
http://www.mitht.ru/e-library

Реакции, которые происходят с гомолитическим разрывом связи,
называют гомолитическими или свободнорадикальными. Образующиеся в процессе таких реакций углеродные радикалы представляют собой крайне неустойчивые соединения, которые существуют очень короткое время только как промежуточные частицы (интермедиаты) и претерпевают быстрое превращение в продукты реакции.
Устойчивость свободных радикалов зависит от их строения. Так,
например, первичные алкильные радикалы менее устойчивы, чем вторичные, а
те в свою очередь менее устойчивы, чем третичные.
CH3 CH3  CH3
CH3 CH2
CH2 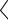 CH3
CH3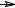 CH
CH  CH3
CH3 C
C CH3 CH3
CH3 CH3
Этот ряд увеличения устойчивости свободных радикалов можно объяснить электронодонорным влиянием метильных групп (+I-эффект алкильных групп, связанных с sp2-гибридным атомом), которые уменьшают
«неспаренность» электрона.
Устойчивость свободных радикалов возрастает при возможности делокализации неспаренного электрона в результате сопряжения орбиталей.
Так, например, аллильный радикал более устойчив, чем простые алкильные радикалы, из-за сопряжения р-орбитали, на которой находится один электрон, с π-связью (р-π-сопряжение).
CH2=CH CH2 
 CH2 CH=CH2
CH2 CH=CH2
При реакциях свободных радикалов образуются либо устойчивые продукты, либо другие радикалы, вступающие в дальнейшие реакции.
Устойчивые продукты могут образоваться в результате рекомбинации двух радикалов (одинаковых или разных), т.е. в результате процесса образования ковалентной связи между атомами, обобществляющими свои неспаренные электроны. Например, из двух метильных радикалов получается молекула этана, а из метильного радикала и атома хлора – хлорметан.
CH3 +
+  CH3
CH3  CH3 CH3
CH3 CH3
CH3 +
+  Cl
Cl  CH3 Cl
CH3 Cl
http://www.mitht.ru/e-library

Кроме того, возможно также диспропорционирование радикалов:
2CH3 CH2  CH3 CH3 + CH2=CH2
CH3 CH3 + CH2=CH2
Другие радикалы могут образоваться, например, при отрыве радикалом атома от молекулы (1), при присоединении радикала к двойной связи (2) или в результате разложения радикала (3).
Cl |
+ CH4 |
|
|
H |
|
Cl + CH3 |
(1) |
||||||||||||||
|
|
|
|||||||||||||||||||
CH3 |
|
CH2 + |
CH2=CH2 |
|
|
|
CH3 |
|
CH2 |
|
CH2 |
|
CH2 |
(2) |
|||||||
|
|
|
|
|
|
|
|||||||||||||||
CH3 |
|
C |
|
O |
|
|
CH3 |
|
+ CO2 |
(3) |
|||||||||||
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
1.2. Гетеролитические или ионные реакции
Если при разрыве ковалентной связи оба электрона остаются на одном из связанных атомов, такой разрыв связи называется гетеролитическим. При таком разрыве связи образуются ионы, поэтому реакции, протекающие с переносом пары электронов, называют гетеролитическими или ионными.
A B 
 A +
A +  B
B
Гетеролитический разрыв характерен прежде всего для полярных ковалентных связей, причем связь разрывается с образованием наиболее устойчивых заряженных частиц. Это значит, что, например, при гетеролизе связи между атомами углерода и хлора образуется хлорид-анион и катион с положительным зарядом на атоме углерода (карбокатион), а не наоборот,
поскольку атом галогена более электроотрицателен, чем атом углерода.
|
|
CH3CH + Cl Обратите внимание на использование |
|
CH3CH |
Cl |
||
CH3 |
|
CH3 |
стрелок: |
|
|
|
|
стрелка по σ-связи показывает полярность связи, а изогнутая стрелка от пары электронов связи к атому хлора означает гетеролитический разрыв связи с переносом пары электронов на атом хлора.
Следует сразу отметить, что в гетеролитических реакциях не всегда встречаются ионные промежуточные частицы (интермедиаты), однако всегда
http://www.mitht.ru/e-library

происходит перенос пары электронов. Реагирующие между собой в гетеролитических реакциях вещества принято различать по их участию в образовании новой связи. Реагенты, предоставляющие пару электронов для образования связи, называют нуклеофилами (любящие ядро). Реагенты, которые при образовании ковалентной связи в гетеролитической реакции принимают электронную пару, называют электрофилами (любящие электроны).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Нуклеофилы |
Электрофилы |
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Нейтральные молекулы: |
Нейтральные молекулы: |
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2 |
O, ROH, NH3, NR3, H2S, RSH |
BF3, AlCl3, ZnCl2, FeCl3, SO3 и т.п. |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
СН2=СН2, бензол и т.п. |
Катионы: |
|||||||||||||||||||||||||||||
Анионы: |
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
, R |
|
|
, Cl |
|
|
, |
|
|
NO2 , RC=O, SO3H и т.п. |
|||||||||||||||||||
HO , RO
, RO



 , H
, H ,
,  Cl
Cl
 , HS , NO2 и т.п.
, HS , NO2 и т.п.
Как видно из табл. 3, в которой приведены некоторые типичные нуклеофилы и электрофилы, признаком нуклеофила является наличие у частицы либо неподеленной пары электронов, т.е. имеется заполненная несвязывающая орбиталь, либо π-электронов, которые могут быть предоставлены для образования связи. Электрофильная частица характеризуется наличием вакантной орбитали, независимо от того, имеется на частице заряд, или она нейтральна. Так, например, трифторид бора является электрофилом, поскольку у атома бора имеется вакантная орбиталь.
Нуклеофильность определяется тем, насколько легко частица отдает пару электронов на образование связей, поэтому она зависит от электроотрицательности атома, а также от того, имеется на атоме заряд или нет.
Чем меньше электроотрицательность атома, проявляющего нуклеофильные свойства, тем выше нуклеофильность частицы. Поэтому вода менее нуклеофильна, чем аммиак. С другой стороны, гидроксид-анион проявляет более сильные нуклеофильные свойства, чем вода, поскольку в нем на атоме кислорода из-за наличия отрицательного заряда электронная плотность гораздо
http://www.mitht.ru/e-library

больше и, следовательно, способность отдать ее часть в виде пары электронов тоже выше, чем у нейтрального атома кислорода в молекуле воды.
Такой же подход может быть применен и для оценки электрофильных свойств, которые зависят от величины электронного дефицита и от способности электрофильного центра притягивать электроны. Поэтому, например, хлор-
катион является более сильным электрофилом, чем алкил-катион.
Гетеролитический разрыв связи характерен прежде всего для полярных связей, а также для неполярных, но легко поляризуемых связей. Так, например,
в нормальных условиях взаимодействие этилена с хлором происходит с гетеролитическим разрывом связей (см. ниже).
2. Классификация реакций по типу превращения
При классификации по типу превращения производится сравнение продукта реакции с субстратом и реагентом. При этом могут происходить следующие превращения:
реакции присоединения (этот тип реакций обозначают буквами Аd), в
которых происходит присоединение фрагментов реагента к кратной (двойной или тройной) связи субстрата, при этом в зависимости от типа разрыва связи и от природы присоединяющегося реагента различают свободнорадикальное присоединение (АdR), электрофильное присоединение (АdЕ) и нуклеофильное присоединение (АdN), например:
CH2=CH2 |
+ |
Cl Cl |
h |
CH2 |
CH2 |
|
|
|
||
|
|
|
|
|
Cl |
|
Cl |
|
|
АdR |
|
|
|
|
|
|
|
|
|
|
|
CH2=CH2 |
|
|
|
|
CH2 |
CH2 + Cl |
CH2 |
CH2 |
|
|
+ Cl |
Cl |
|
|
|||||||
|
|
|
|
|
|
Cl |
|
Cl |
Cl |
АdЕ |
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
+ NH |
|
CH |
O |
H |
OH |
|
|
CH=O |
|
CH NH |
CH CH NH |
|
||||||
3 |
|
|
3 |
|
3 |
|
2 |
3 |
2 АdN |
|
реакции отщепления или элиминирования (этот тип реакций обозначают латинской буквой Е), например:
http://www.mitht.ru/e-library

CH3 CH CH2 + OH |
CH3 CH=CH2 + H2O+ Cl |
 Cl H
Cl H
реакции замещения (этот тип реакций обозначают буквой S), причем в зависимости от типа разрыва связи и от природы замещающего регента различают свободнорадикальное замещение (SR), электрофильное замещение
(SE) и нуклеофильное замещение (SN), например:
CH3 CH3 |
+ |
Cl |
Cl |
h |
CH3 |
CH2 + |
HCl |
|
|||||||
|
|
|
|
|
|
Cl |
SR |
H |
|
|
|
|
|
|
Cl |
+ |
Cl |
Cl |
+ |
AlCl3 |
|
|
+ H + AlCl4 |
SE
CH3 Br + C N |
CH3 C N + Br |
SN
реакции окисления и восстановления, например:
|
|
|
|
|
|
|
|
|
|
|
H2, Ni |
|
|
|
|
|
|
|
|
|
|||||
CH3 |
|
|
C |
|
CH3 |
|
|
|
|
CH3 |
|
|
CH |
|
|
CH3 |
восстановление |
||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
O |
|
|
|
|
|
|
OH |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
CH3 |
|
|
|
|
CH |
|
CH3 |
K2Cr2O7 |
CH3 |
|
|
C |
|
CH3 |
окисление |
||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
H2SO4 |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
OH |
|
|
O |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
3.Кислоты и основания в органической химии
Ворганической химии используются обе теории кислот и оснований:
теория Бренстеда и теория Льюиса.
3.1.Кислоты и основания Бренстеда
Втеории Бренстеда кислота выступает донором протона, а основание –
акцептором протона. Кислотой может быть любое соединение, в котором есть атом водорода, а основанием – соединение, в котором имеется пара электронов,
которая может быть предоставлена для образования связи с протоном. Чаще всего это неподеленная пара электронов или электроны π-связи.
http://www.mitht.ru/e-library

При взаимодействии кислоты Н-А с основанием В происходит перенос протона от кислоты на основание с образованием новой кислоты, сопряженной основанию В, и нового основания, сопряженного кислоте Н-А.
H A +
A + 

 B
B 

 A + H B
A + H B
Положение кислотно-основного равновесия определяется константой равновесия и зависит от силы кислоты и основания.
Сила кислоты – это мера способности отдавать протон, а сила основания
– мера способности присоединять протон. Силу кислоты характеризуют либо величиной константы кислотной диссоциации в воде, либо величиной рКа,
равной отрицательному десятичному логарифму этой константы.
H A + H2O 

 A + H3O
A + H3O
K = |
A H3O ; – lgK = pKa |
|
H A H2O |
Силу основания характеризуют величиной рКа сопряженной кислоты.
Чем сильнее кислота, тем слабее сопряженное ей основание. Так, например,
силу уксусной кислоты как кислоты и силу ацетат-аниона как основания можно охарактеризовать одной величиной рКа, равной 4,76 (по отношению к воде).
Чем сильнее кислота, тем меньше значение ее рКа. Чем сильнее основание, тем больше значение рКа, которым его характеризуют.
Поскольку сила кислоты зависит от положения кислотно-основного равновесия, а оно в свою очередь – от устойчивости сопряженного основания,
то чем более устойчиво сопряженное основание, тем оно слабее и,
следовательно, тем сильнее кислота. Так, для соединений элементов 2-го периода с водородом кислотные свойства возрастают слева направо, (например,
в ряду боран, метан, аммиак, вода, фтороводород), поскольку увеличивается электроотрицательность элементов, и в сопряженных этим кислотам основаниях отрицательный заряд оказывается на все более
http://www.mitht.ru/e-library
