
Краткий курс органической химии. Часть 2
.pdfМинистерство образования Российской Федерации
МОСКОВСКАЯ ГОСУДАРСТВЕННАЯ АКАДЕМИЯ ТОНКОЙ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ
ИМ. М.В. ЛОМОНОСОВА
Кафедра органической химии
Помогаев А.И.
КРАТКИЙ КУРС ОРГАНИЧЕСКОЙ ХИМИИ
Учебное пособие
Часть 2
Углеводороды
Москва 2003
http://www.mitht.ru/e-library
УДК 547
ББК 24.2
Помогаев А.И.
Краткий курс органической химии Часть 2
Углеводороды.
Учебное пособие М., МИТХТ им. М.В.Ломоносова, 2003 – 80 с.
Издание 2-ое.
Утверждено Библиотечно-издательской комиссией МИТХТ им.
М.В.Ломоносова в качестве учебного пособия.
Данное методическое пособие предназначено для студентов 3 курса направления бакалавриата «Материаловедение и технология новых материалов», изучающих органическую химию в течение одного учебного семестра.
Пособие представляет собой изложение материала, не выходящего в основном за пределы учебной программы по органической химии для этого направления. В конце каждого раздела приводятся упражнения и типичные задачи, самостоятельное решение которых поможет студенту подготовиться как к контрольным работам, так и к экзамену.
Подготовлено на кафедре органической химии МИТХТ им. М.В. Ломоносова.
© Московская Государственная Академия Тонкой Химической Технологии им. М.В. Ломоносова
http://www.mitht.ru/e-library
Оглавление
АЛКАНЫ _______________________________________________ 5
1. Строение |
5 |
2.Способы получения______________________________________________5
2.1.Гидрирование ненасыщенных углеводородов ______________________5
2.2.Восстановление функциональных производных алканов_____________6
2.3.Реакция Вюрца________________________________________________7
2.4.Электрохимический синтез Кольбе_______________________________7
2.5.Сплавление солей карбоновых кислот со щелочью__________________8
3.Химические свойства ____________________________________________8
3.1.Реакции свободно-радикального замещения _______________________8
3.2.Дегидрирование______________________________________________14
3.3.Крекинг_____________________________________________________14
4.Задачи и упражнения ___________________________________________15
ЦИКЛОАЛКАНЫ_______________________________________ 17
1.Особенности строения и конформации____________________________18
1.1.Циклопропан ________________________________________________18
1.2.Циклобутан и циклопентан ____________________________________18
1.3.Циклогексан _________________________________________________19
2.Способы получения_____________________________________________21
3.Особенности химического поведения _____________________________23
4.Задачи и упражнения ___________________________________________24
АЛКЕНЫ_______________________________________________ 25
1.Строение и номенклатура _____________________________________25
2.Способы получения___________________________________________26
2.1.Дегидрирование алканов_______________________________________26
2.2.Дегидрогалогенирование галогеналканов ________________________26
2.3.Дегидратация спиртов ________________________________________27
2.4.Дегалогенирование вицинальных дигалогеналканов_______________28
3.Химические свойства ___________________________________________28
3.1.Реакции электрофильного присоединения ________________________28
3.2.Гомолитические реакции алкенов _______________________________33
3.3.Окисление алкенов ___________________________________________34
3.4.Восстановление алкенов_______________________________________36
3.5.Полимеризация ______________________________________________37
4.Задачи и упражнения ___________________________________________38
СОПРЯЖЕННЫЕ АЛКАДИЕНЫ _________________________ 40
1. Строение сопряженных диенов __________________________________40
http://www.mitht.ru/e-library
2.Способы получения_____________________________________________41
2.1.Дегидрирование алканов и алкенов______________________________41
2.2.Дегидратация и дегидрогалогенирование_________________________42
2.3.Получение бутадиена и изопрена из ацетилена____________________42
3.Химические свойства ___________________________________________43
3.1.Реакции электрофильного присоединения ________________________43
3.2.Реакция Дильса-Альдера_______________________________________45
3.3.Полимеризация ______________________________________________46
4.Задачи и упражнения ___________________________________________47
АЛКИНЫ ______________________________________________ 49
1.Способы получения_____________________________________________49
2.Химические свойства ___________________________________________50
2.1.Кислотные свойства ацетилена и моноалкилацетиленов ____________50
2.2.Алкилирование ацетилена и алкинов с концевой тройной связью ____51
2.3.Реакции присоединения _______________________________________52
2.4.Реакции с альдегидами и кетонами ______________________________55
2.5.Восстановление и окисление алкинов____________________________55
Окисление алкинов_______________________________________________56
3.Задачи и упражнения ___________________________________________56
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ ___________________ 58
1.Строение бензола_______________________________________________58
2.Номенклатура бензоидных ароматических соединений_____________59
3.Получение бензола и его гомологов_______________________________60
4.Реакции электрофильного замещения ____________________________61
4.1.Общий механизм электрофильного замещения____________________61
4.2.Галогенирование _____________________________________________62
4.3.Нитрование__________________________________________________63
4.4.Сульфирование ______________________________________________64
4.5.Алкилирование_______________________________________________65
4.6.Ацилирование по Фриделю-Крафтсу ____________________________66
4.7.Влияние заместителей в бензольном ядре на электрофильное замещение
________________________________________________________________68
5.Другие реакции бензола и его гомологов__________________________73
5.1.Свободно-радикальные реакции ________________________________73
5.2.Окисление бензола и его гомологов _____________________________74
5.3.Восстановление бензола и его гомологов_________________________75
6.Задачи и упражнения ___________________________________________75
http://www.mitht.ru/e-library

АЛКАНЫ
1. Строение
Алканы представляют собой насыщенные углеводороды общей формулы СnН2n+2. sp3-Гибридные орбитали атомов углерода перекрываются с s-
орбиталями атомов водорода или с sp3-гибридными орбиталями соседних атомов углерода с образованием σ-связей (осевое перекрывание). Связи углерод-углерод неполярны, длина их составляет 1,54 А . Полярность связей углерод-водород очень мала, их длина – 1,12 А . Валентные углы в молекулах алканов близки к теоретическому значению для тетраэдрической модели атома углерода в sp3-гибридизации (109,5 ).
Для алканов характерна как структурная, так и пространственная изомерия. Конформации алканов подробно рассмотрены в разделе
«Конформационная изомерия».
2. Способы получения
2.1. Гидрирование ненасыщенных углеводородов
Алканы могут быть получены при гидрировании алкенов или алкинов на катализаторах (никель, платина, палладий и др.). Реакция заключается в присоединении к атомам углерода, связанным двойной или тройной связью,
атомов водорода до насыщения. Например, гидрирование этилена на никеле приводит к образованию этана, а бутан может быть получен каталитическим гидрированием как 1-бутена, так и 2-бутена.
CH2=CH2 |
|
H2 |
CH3 |
|
CH3 |
||
|
|
|
|||||
|
|
|
Ni |
|
|
|
|
CH2=CHCH2CH3 |
|
|
H2 |
CH3CH2CH2CH3 |
|||
|
|||||||
CH3CH=CHCH3 |
|
|
Pt |
||||
|
|
|
|
|
|||
|
|
|
|
||||
Алкины при каталитическом гидрировании присоединяют два
эквивалента водорода и превращаются в алканы.
R |
|
C |
|
C |
|
R' |
2H2 |
R |
|
CH |
|
CH |
|
R' |
|
|
|||||||||||||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
Pt |
2 |
2 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
http://www.mitht.ru/e-library

2.2. Восстановление функциональных производных алканов
2.2.1.Восстановление галогенопроизводных
Превращение галогенопроизводных в алканы заключается в замещении
атома галогена на атом водорода. Это может быть осуществлено различными способами:
восстановление водородом в момент выделения, например:
Zn
CH3CH2CH2Br  CH3CH2CH3
CH3CH2CH3
HCl
1-бромпропан |
пропан |
каталитический гидрогенолиз, например: |
|
H2, Ni
CH3CH2Cl _HCl CH3CH3
хлорэтан этан
восстановление комплексными гидридами, например, алюмогидридом
лития:
CH3 |
CHCH2Br |
LiAlH4 |
|
||
|
CH CHCH |
||||
|
|||||
|
|
3 |
|
3 |
|
|
CH3 |
|
|
CH3 |
|
через магнийорганические соединения, например:
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
Mg |
|
|
H |
|
OH |
|
|||||
|
|
|
|
|
|
|
||||||||
CH3CH2CH3 |
|
Br |
|
CH3CH2CH2 |
|
|
|
MgBr _ |
|
|
|
CH3CH2CH3 |
||
|
|
|
|
|
|
Mg(OH)Br |
||||||||
1-бромпропан |
пропилмагнийбромид |
|
|
|
пропан |
|||||||||
2.2.2. Восстановление альдегидов и кетонов
Карбонильные соединения – альдегиды и кетоны – могут быть
восстановлены до алканов двумя методами: |
|
|
|
|
|
|
|||||||||||||||||
восстановление по Клемменсену действием |
амальгамы цинка в соляной |
||||||||||||||||||||||
кислоте |
|
|
|
|
|
|
|
Zn/Hg |
|
|
|
|
|
|
|
|
|
|
|||||
R |
|
|
|
C |
|
R' |
|
|
R |
|
|
CH2 |
|
|
R' |
||||||||
|
|
|
|
|
HCl |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
восстановление по Кижнеру – Вольфу нагреванием с гидразином и КОН |
|||||||||||||||||||||||
R |
|
C |
|
|
R' |
NH2NH2, t |
|
R |
|
|
CH2 |
|
|
R' |
|||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
KOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
http://www.mitht.ru/e-library
Так, например, 2-метилбутан можно получить из 2-метилбутаналя
восстановлением по Клемменсену или из 3-метил-2-бутанона по Кижнеру –
Вольфу. |
CH3CH2CHCH=O |
Zn/Hg |
CH3CH2CHCH3 |
|||||||
|
HCl |
|||||||||
|
|
|
|
|
|
|
|
|
||
|
|
|
CH3 |
CH3 |
||||||
|
O |
|
|
|
||||||
|
|
|
|
|
NH2NH2, t |
|
|
|
||
|
|
|
|
|
|
|
||||
|
CH3CCHCH3 |
CH3CH2 |
|
CHCH3 |
||||||
|
KOH |
|
|
|||||||
|
|
|
||||||||
|
|
|
CH3 |
CH3 |
||||||
2.3. Реакция Вюрца
При воздействии металлического натрия на галогенопроизводные
образуются алканы.
2R X + 2Na  R R + 2NaX
R R + 2NaX
Предполагается, что вначале галогенопроизводное образует с натрием очень реакционноспособное металлорганическое соединение – алкилнатрий,
которое затем взаимодействует со второй молекулой галогенопроизводного.
R |
|
|
|
X |
+ |
2Na |
|
|
|
|
R |
|
Na |
+ |
NaX |
||||||||
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
R |
|
|
|
|
Na |
+ |
R |
|
|
|
X |
|
|
R |
|
|
R |
+ |
NaX |
||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
Для получения бутана реакцией Вюрца необходимо подвергнуть действию натрия этилхлорид, а из изопропилбромида образуется 2,3-
диметилбутан.
2CH3CH2Cl + 2Na  CH3CH2CH2CH3 + 2NaCl
CH3CH2CH2CH3 + 2NaCl
2CH3CH |
|
Br |
|
|
2Na |
|
|
CH3 |
|
|
|
|
|
|
|
||||||
|
|
|
CH CHCHCH |
|||||||
|
_ |
|
||||||||
|
|
|
|
2NaBr |
3 |
|
|
3 |
||
CH3 |
|
|
CH3 |
|
||||||
|
|
|
|
|||||||
2.4. Электрохимический синтез Кольбе
При электролизе растворов или расплавов солей карбоновых кислот на аноде происходит образование алканов.
2 R COO Na
Na анод
анод R R + 2CO2
R R + 2CO2
Анион – кислотный остаток карбоновой кислоты – на аноде разряжается,
отдавая один электрон и превращаясь в свободный радикал, от которого
http://www.mitht.ru/e-library

отщепляется диоксид углерода с образованием алкильного радикала. Два таких радикала соединяются в молекулу алкана.
_ |
2e |
2R |
R R |
2R COO |
2 R COO _ |
||
|
|
2CO2 |
|
Так, например, при электролизе ацетата натрия образуется этан, а для получения 2,3-диметилбутана необходимо подвергнуть электролизу натриевую соль 2-метилпропановой кислоты.
2CH3 COO Na
Na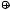 анод
анод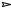 CH3 CH3 + 2CO2
CH3 CH3 + 2CO2
2CH CH |
|
COO |
|
Na |
|
|
|
|
анод |
CH CH |
|
CHCH |
|
CO |
||||
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||
3 |
|
|
|
|
|
|
|
|
|
|
3 |
CH3 |
|
3 |
+ |
2 |
2 |
|
|
CH3 |
|
|
|
|
|
|
CH3 |
|
|
|
|||||||
2.5. Сплавление солей карбоновых кислот со щелочью
Алканы образуются при сплавлении солей карбоновых кислот с едким
натром.
t
R COONa + NaOH  R H + Na2CO3
R H + Na2CO3
Так, например, при нагревании ацетата натрия с едким натром выделяется метан.
|
|
|
t |
|
|
CH3 |
|
COONa + NaOH |
|
CH4 + |
Na2CO3 |
|
|
||||
Этот метод применим только для получения низших алканов.
3. Химические свойства
Алканы из-за их насыщенного характера и практически неполярных связей С-Н и неполярных связей С-С вступают в реакции, протекающие с гомолитическим разрывом связей. Наиболее характерными для алканов являются реакции свободно-радикального замещения (SR), дегидрирования и крекинга.
3.1. Реакции свободно-радикального замещения
3.1.1.Галогенирование алканов
а) Хлорирование
http://www.mitht.ru/e-library

При обычных условиях алканы не взаимодействуют с хлором, однако при освещении смеси алкана и хлора ультрафиолетовым светом происходит реакция хлорирования – замещения атома водорода на атом хлора.
R H + Cl2 |
h |
R Cl + |
HCl |
|
Реакция протекает по свободно-радикальному механизму. Энергия кванта света поглощается молекулой хлора, связь между атомами в которой при этом подвергается гомолитическому расщеплению с образованием атомов хлора.
Эту стадию процесса хлорирования, в которой образуются свободные радикалы, называют стадией инициирования цепной реакции.
|
|
|
h |
|
Cl |
|
Cl |
|
2Cl |
|
|
|||
|
|
|||
Радикал хлора атакует молекулу алкана и вызывает гомолитическое расщепление связи углерод-водород. Образуется алкил-радикал, а атом водорода и атом хлора спаривают свои неспаренные электроны и образуют молекулу хлороводорода. Алкил-радикал представляет собой чрезвычайно неустойчивую частицу, стремящуюся спарить свой неспаренный электрон. Он атакует молекулу хлора, вызывая гомолиз связи, отрывая от нее атом хлора и спаривая его неспаренный электрон со своим с образованием ковалентной
связи углерод-хлор. |
R |
H |
+ |
Cl |
R |
+ H |
Cl |
|
|||||||
|
R |
+ |
Cl |
Cl |
R |
Cl + |
Cl |
Эти две стадии представляют собой звено цепной реакции, поскольку атом хлора с неспаренным электроном, образовавшийся на второй стадии,
может снова повторить первую стадию, после чего алкильный радикал снова
«породит» новый радикал хлора и т.д. до тех пор, пока цепная реакция не оборвется в результате рекомбинации радикалов (стадии обрыва цепи).
2Cl
 Cl Cl
Cl Cl
R + Cl
+ Cl
 R Cl
R Cl
R + R
+ R
 R R
R R
Таким образом, хлорирование алканов, инициируемое освещением,
представляет собой цепную свободно-радикальную реакцию.
http://www.mitht.ru/e-library

При хлорировании метана образуется метилхлорид (хлорметан), который может быть далее прохлорирован до хлористого метилена (дихлорметан),
хлороформа (трихлорметан) и четыреххлористого углерода (тетрахлорметан).
CH4 |
Cl2,h |
CH3Cl |
Cl2,h |
CH2Cl2 |
Cl2,h |
CHCl3 |
Cl2,h |
CCl4 |
||||
_ |
HCl |
_ |
HCl |
_ |
HCl |
_ |
HCl |
|||||
|
|
|
|
|
|
|
|
|
||||
Образующиеся в процессе хлорирования углеводородные радикалы представляют собой неустойчивые промежуточные частицы (интермедиаты),
стабильность которых зависит от их строения. Стабильность алкильных радикалов растет в ряду: метильный < первичный < вторичный < третичный,
что обусловлено увеличением в этом ряду степени компенсации дефицита электронов у радикала алкильными группами, проявляющими +I-эффект.
Поэтому, например, изопропил-радикал является более устойчивым, чем этил-
радикал, а трет-бутил-радикал более устойчив, чем изопропил-радикал.
CH3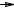 CH2 < CH3
CH2 < CH3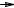 CH
CH CH3 < CH3
CH3 < CH3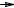 C
C CH3
CH3
CH3
При монохлорировании алканов, имеющих неэквивалентные атомы водорода, образуются смеси монохлорпроизводных, соотношение которых в смеси зависит от условий реакции. Так, например, при хлорировании пропана образуются 1-хлорпропан и 2-хлорпропан как продукты замещения на атом хлора одного из шести первичных атомов водорода или одного из двух вторичных атомов водорода.
CH3CH2CH3 Cl_ 2,h 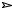 CH3CH2CH2Cl + CH3CHCH3
CH3CH2CH2Cl + CH3CHCH3
HCl
Cl
При высоких температурах 1-хлорпропан и 2-хлорпропан образуются в соотношении 3:1, поскольку вероятность образования пропил-радикала в три раза выше, чем вероятность образования изопропил-радикала. Однако при нормальных условиях реакции (комнатная температура) соотношение продуктов монохлорирования пропана изменяется: 1-хлорпропан и 2-
хлорпропан образуются примерно в равных количествах (1:1). Это значит, что при низкой температуре кроме фактора статистической вероятности на
http://www.mitht.ru/e-library
