
КХ часть 4
.pdfУчебное пособие
И. А. Туторский
ВВЕДЕНИЕ В КОЛЛОИДНУЮ ХИМИЮ. ЧАСТЬ 4.
ЭЛЕКТРОПОВЕРХНОСТНЫЕ СВОЙСТВА ДИСПЕРСНЫХ СИСТЕМ.
УСТОЙЧИВОСТЬ И КОАГУЛЯЦИЯ КОЛЛОИДНЫХ СИСТЕМ
Подписано в печать…………..Формат 60x90/16. Бумага писчая. Отпечатано на ризографе. Уч. изд. Тираж 500 экз. Заказ №………..
Московская государственная академия тонкой химической технологии им. М. В. Ломоносова
Издательско-полиграфический центр. 119571 Москва, пр. Вернадского 86
60
Федеральное агентство по образованию Российской Федерации
Московская государственная академия тонкой химической технологии
им. М. В. Ломоносова
Кафедра коллоидной химии
И. А. Туторский
ВВЕДЕНИЕ В КОЛЛОИДНУЮ ХИМИЮ.
ЧАСТЬ 4.
ЭЛЕКТРОПОВЕРХНОСТНЫЕ СВОЙСТВА ДИСПЕРСНЫХ СИСТЕМ.
УСТОЙЧИВОСТЬ И КОАГУЛЯЦИЯ КОЛЛОИДНЫХ СИСТЕМ.
Учебное пособие
Москва 2008
www.mitht.ru/e-library
ББК 23.9 УДК 541.183
И. А. Туторский
ВВЕДЕНИЕ В КОЛЛОИДНУЮ ХИМИЮ. Часть 4.
Электроповерхностные свойства дисперсных систем. Устойчивость и коагуляция коллоидных систем. Учебное пособие М., МИТХТ им. М. В. Ломоносова, 2008 – 60 с.
Рецензент проф. Тверской В.А.
Данное учебное пособие соответствует программе лекционных курсов “Коллоидная химия” и “Поверхностные явления и дисперсные системы” для студентов 3 и 4 курсов для направления бакалавриата 510500 «Химия», 550800 «Химическая технология и биотехнология», 553500 «Защита окружающей среды», 551600 «Материаловедение и технология новых материалов», и по специальностям 070100 «Биотехнология», 250400 «Химическая технология природных энергоносителей и углеродных материалов», 250500 «Химическая технология высокомолекулярных соединений».
Утверждено Библиотечно-издательской комиссией МИТХТ в качестве учебного пособия.
© МИТХТ им. М. В. Ломоносова, 2008
2
Содержание. |
|
11. Электроповерхностные свойства дисперсных систем...................... |
3 |
11.1. Значение электрокинетических явлений в природе и технике...... |
3 |
11.2. Причины и механизмы возникновения заряда на поверхности в |
|
лиозолях................................................................................................... |
4 |
11.3. Связь поверхностного натяжения с электрическим потенциалом. |
|
Уравнение Липпмана............................................................................... |
7 |
11.4 Строение двойного электрического слоя........................................ |
9 |
11.5. Электрокинетические явления...................................................... |
16 |
11.6. Электрокинетический потенциал.................................................. |
19 |
11.7. Влияние электролитов на двойной электрический слой. |
|
Индифферентные электролиты............................................................ |
22 |
11.9. Влияние температуры и разбавления на ДЭС............................. |
32 |
12. Устойчивость и коагуляция коллоидных систем............................. |
34 |
12.1. Понятие об устойчивости.............................................................. |
34 |
12.2. Расклинивающее давление.......................................................... |
36 |
12.3. Теория агрегативной устойчивости и коагуляции лиофобных |
|
дисперсных систем (теория ДЛФО)....................................................... |
43 |
12.4.Коагуляция...................................................................................... |
52 |
Содержание. .......................................................................................... |
59 |
59
www.mitht.ru/e-library

некоторому критическому значению -потенциала, лежащему в пределах 25÷40 мВ.
12.4.3.Правила коагуляции электролитами.
1.Коагуляцию вызывают все электролиты.
2.Коагулирующим действием обладает ион, противоположный по знаку заряду частицы.
3.Коагуляция начинается при достижении критической концентрации,
называемой порогом коагуляции (Сk ).
4. Коагулирующая сила иона увеличивается при увеличении
K
валентности иона согласно правилу Дерягина-Ландау: Cб z6 ,
где Cб – порог быстрой коагуляции, z – валентность иона.
5.Коагулирующая сила ионов одинаковой валентности увеличивается при увеличении радиуса иона.
6.Коагуляция начинается не в изоэлектрической точке, а при критическом значении -потенциала, равном 25-40 мВ.
7.В осадках, получаемых при коагуляции электролитами, всегда присутствуют ионы, вызывающие ее.
58
11. Электроповерхностные свойства дисперсных систем
11.1. Значение электрокинетических явлений в
природе и технике
Электрические явления протекают на поверхностях частиц любого размера, в том числе и на макроповерхностях. Так, при трении листа бумаги о поверхность стола бумага прилипает к столу вследствие образования заряда поверхности (трибоэлектрический эффект). В дисперсных системах значение электроповерхностных явлений особенно велико, что связано с существованием особой группы явлений, называемых электрокинетическими. К
электрокинетическим явлениям относятся электрофорез,
электроосмос, потенциал течения и потенциал седиментации. Этот раздел тесно связан с такими разделами коллоидной химии, как образование ионно-стабилизованных систем, адсорбция,
структурообразование, устойчивость и коагуляция, и имеет большое теоретическое значение.
Электрокинетические явления имеют большое значение в биологии. Растительные и животные организмы состоят из капиллярных систем, по которым со значительной скоростью циркулируют электролиты – кровь, лимфа, клеточный сок. Вследствие этого в организме возникают биотоки. В электрокардиографии существенную роль играет потенциал течения. Один из пиков электрокардиограммы (зубец Q) обуславливает потенциал течения крови в коронарной системе. Электрокинетические явления проявляются также в геологии (электроразведка), почвоведении и агрохимии.
3
www.mitht.ru/e-library

Техническое применение электрокинетических явлений непрерывно возрастает вследствие возросшей электрификации всех отраслей техники и успехов слаботочной техники. Электроосмос применяется для осушки и укрепления грунта, извлечения нефти,
осушки зданий, обезвоживания древесины, для очистки коллоидных растворов от примесей (например, при получении Al2O3 ), очистки глицерина, сахарных сиропов, желатина, при дублении кожи,
Электрофорез применяют для обезвоживания торфа, очистки глины и каолина, осаждения каучука и латекса. Знание электрокинетических свойств поверхностей и управление ими необходимо в технологии для безопасного ведения процесса. Так, например, потенциал течения,
возникающий при перекачивании технических жидких углеводородов по трубам и шлангам, приводит к образованию высокой разноcти потенциалов, что служит причиной взрывов и пожаров. Для предотвращения этого применяют анодное заземление трубопроводов и введение антистатиков в состав материалов, из которых изготавливаются трубы и шланги.
Основными теоретическими вопросами этого раздела являются теория ДЭС и электрокинетического потенциала.
11.2. Причины и механизмы возникновения заряда на
поверхности в лиозолях.
Заряд поверхностей возникает при их взаимодействии благодаря избыточной поверхностной энергии. Поверхностная энергия стремится уменьшиться вследствие ориентации молекул, ионов и электронов в поверхностном слое. Это приводит к увеличению электрической энергии системы и к возникновению заряда.
Существует несколько механизмов возникновения заряда поверхности.
4
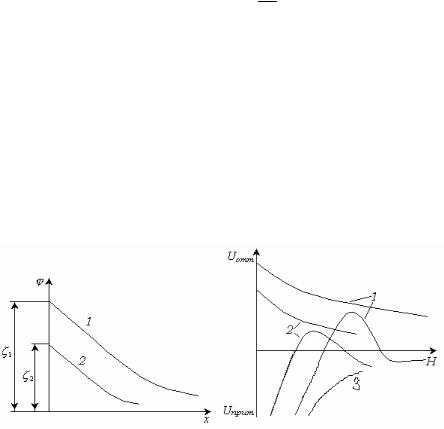
Рис. 12.14. Потенциальные кривые для дисперсных систем с разной
устойчивостью.
Кривая 1 соответствует такому состоянию дисперсной системы,
когда при любом расстоянии между частицами энергия притяжения преобладает над энергией отталкивания. При таком состоянии системы наблюдается быстрая коагуляция.
Энергетический барьер и вторичный минимум на кривой 2
указывают на такое состояние системы, когда возможна обратимая коагуляция. Высокий потенциальный барьер и отсутствие минимума на кривой 3 соответствует агрегативно устойчивой системе, когда вероятность образования агрегатов частиц крайне мала.
При концентрации электролита, равной порогу быстрой коагуляции, потенциальная кривая находится в области отрицательных значений энергии и имеет максимум, отвечающий нулевому потенциальному барьеру и расположенному на оси абсцисс
(пунктирная кривая 4 на рис. 12.14). Точке касания потенциальной кривой оси абсцисс соответствуют два условия: равенство нулю суммарной энергии взаимодействия частиц и ее U 0 и dU /dH 0. Эти условия отвечают не изоэлектрической точке, а
57
www.mitht.ru/e-library

Энергия отталкивания изменяется, а |
значение Umax |
на |
результирующей кривой уменьшается. Когда |
Umax достигает |
KT , |
происходит нейтрализационная коагуляция.
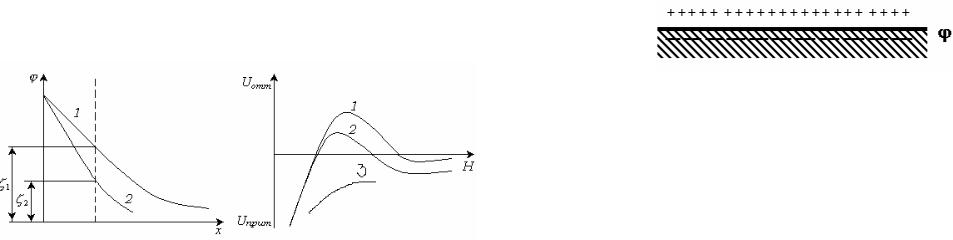
Наименьшая концентрация электролита, при которой начинается коагуляция, называется порогом коагуляции. Порог коагуляции зависит от метода его определения и от концентрации золя. На рис.12.13 показана зависимость скорости коагуляции от концентрации электролита.
Рис. 12.13. Зависимость скорости коагуляции от концентрации электролита.
В области 1 система является устойчивой, в области 2
происходит медленная коагуляция, в области 3 – быстрая коагуляция.
Точки перегиба соответствуют порогам медленнрй (См ) и быстрой
(Сб ) коагуляции.
Введение электролита в дисперсную систему снижает потенциальный барьер, который при определенной концентрации,
соответствующей порогу быстрой коагуляции, становится равным нулю, а скорость коагуляции – максимальной.
Трем состояниям устойчивости дисперсных систем отвечают три характерных вида потенциальных кривых (рис. 12.14).
56
В поверхностном слое происходит адсорбция, причем могут
адсорбироваться и ионы, несущие заряд, например, ионы ПАВ.
|
Достройка |
поверхности |
кристалла |
потенциалопределяющими |
|
ионами. Так поверхность |
AgI |
в избытке |
KI достраивается ионами |
||
I . |
Ионы I |
входят в |
состав кристаллической решетки AgI и |
||
определяют потенциал поверхности, поэтому они оказываются потенциалопределяющими. Потенциалопрелеящими ионами могут быть также ионы, изоморфные ионам, входящим в состав дисперсной фазы, или органические ионы с большой адсорбционной способностью. Ионы, несущие противоположный заряд (противоионы)
частично притягиваются поверхностью, частично находятся в
растворе. Ионы Ag гидратируются сильнее, чем ионы I , поэтому
они больше переходят в раствор, что вызывает дополнительный заряд поверхности.
3. Заряд поверхности может образоваться по механизму диссоциации молекул, находящихся на поверхности с переходом одного из ионов в раствор. Так, поверхность частицы гидролизуется и заряжается отрицательными ионами.
SiO2 H2O H22 SiO32 2H SiO32
Рис. 11.1. Схема образования заряда на поверхности.
Формула мицеллы золя SiO2 имеет следующий вид:
5
www.mitht.ru/e-library
{mSiO2nSiO32 (2n x)H }xH
4. Заряд может образоваться по механизму поверхностной ионизации металла вследствие эмиссии электронов поверхностью металла, которая заряжается положительно:
Me e Me
Отмеченные выше механизмы образования заряда поверхности являются электронно-ионными. Но существует механизм образования
заряда поверхности, не связанный с переходом электронов или ионов.
5. Поверхность может заряжаться вследствие ориентации дипольных молекул в поверхностном слое. Так заряжаются поверхности диэлектриков, приведенные в контакт и подвергаются
трению.
На поверхности происходит пространственное разделение заряда между фазами, то есть образуется двойной электрический слой (ДЭС), состоящий из потенциалообразующих ионов и противоионов. Между поверхностью и раствором образуется разность
потенциалов. Потенциал поверхности 0 по мере удаления от
поверхности частиц вглубь дисперсионной среды уменьшается, так как
он компенсируется находящимися в растворе ионами противоположного знака.
Потенциальная энергия иона U в любой точке определяется значением электрического потенциала в этой точке , заряда
граммиона и равна U z e Na , |
где z – |
валентность иона, e - |
||||||
заряд электрона. |
Вероятность |
нахождения |
иона |
в |
данной точке |
|||
|
|
|
|
|
|
z e |
|
|
|
|
|
|
|
|
|||
пропорциональна |
множителю |
Больцмана |
P e |
k T , то есть |
||||
распределение |
ионов по |
мере |
удаления |
от |
поверхности |
|||
|
|
6 |
|
|
|
|
|
|
Энергия отталкивания изменяется симбатно изменению потенциала, т.е. кривая идет круче с введением электролита. При
введении электролита величина Umax уменьшается, и |
когда |
Umax KT , происходит концентрационная коагуляция, |
т.е. |
коагуляция, происходящая при введении индифферентного электролита и обусловленная повышением концентрации противоионов. Концентрационная коагуляция происходит при
K
достижении порога коагуляции CK z6 , где z – валентность
добавляемого иона.
Коагуляция под действием неиндифферентных электролитов называется нейтрализационной, т.к. она вызвана нейтрализацией заряда поверхности при введении неиндифферентного электролита. Ионы неиндифферентного электролита достраивают кристаллическую решетку поверхности частицы. Если потенциалобразующий ион вводимого электролита имеет знак,
противоположный заряду частицы, то значение 0 и уменьшаются
(рис. 12.12).
Рис. 12.12. Нейтрализационная коагуляция: 1-исходное состояние; 2-после введения
электролита; 3-быстрая коагуляция.
55
www.mitht.ru/e-library
12.4.2. Коагулирующее действие электролитов.
Выше говорилось о том, что электростатическое отталкивание частиц обусловлено наличием двойного электрического слоя. Энергия отталкивания зависит от параметров ДЭС – его толщины, потенциала поверхности 0 и -потенциала. Чем выше значение и -
потенциалов, тем сильнее происходит отталкивание при перекрывании ДЭС.
При введении электролита изменяются параметры ДЭС,
следовательно, изменяется устойчивость дисперсной системы, и
может произойти коагуляция. Рассмотрим коагуляцию под действием индифферентных электролитов, неспособных химически взаимодействовать с поверхностью. При их введении значение потенциала поверхности не меняется, а -потенциал уменьшается,
ДЭС сжимается, т.к. вследствие повышения концентрации противоиона компенсация заряда потенциалобразующих ионов происходит в слое меньшей толщины.
Рис. 12.11. Концентрационная коагуляция: 1-исходное состояние; 2-после введения
электролита; 3-быстрая коагуляция.
54
больцмановское, так же, как распределение молекул в поле силы тяжести согласно гипсометрическому закону. Самопроизвольное образование ДЭС происходит вследствие уменьшения свободной энергии поверхности, которое приводит к увеличению электрической энергии.
11.3. Связь поверхностного натяжения с
электрическим потенциалом. Уравнение Липпмана.
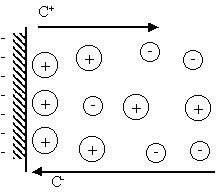
Поверхностная энергия характеризуется поверхностным натяжением , а электрическая энергия поверхности – ее электрическим потенциалом . Связь между потенциалом поверхности и величиной поверхностного натяжения описывается уравнением Липпмана. Вывод этого уравнения основан на том, что поверхность раздела фаз представляет собой плоский конденсатор
(рис. 11.2), поверхность которого равна s , заряд - q, а потенциал - .
При увеличении поверхности на ds заряд увеличивается на dq.
s+ds
q+dq
Рис. 11.2. К выводу уравнения Липпмана.
Максимальная изотермическая работа процесса равна
изменению свободной энергии:
|
dFs |
ds dq (11.1) |
где произведение ds |
равно работе увеличения поверхности, |
|
а величина dq |
равна |
электрической работе. Так как dq |
пропорционально ds , |
не зависит от ds , а не зависит от dq, |
|
можно проинтегрировать это уравнение, получив:
7
www.mitht.ru/e-library

Fs s q (11.2)
Рассмотрим любые возможные изменения системы, то есть получим полный дифференциал Fs , который равен:
dFs ds s d dq q d (11.3)
Уравнение (11.1) и (11.3) получены независимо и справедливы при условии, что
s d q d 0 (11.4)
или
d q qs (11.5) d s
Величина qs называется поверхностной плотностью заряда.
Очевидно, что поверхностная плотность заряда определяется зарядом грамм иона и величиной адсорбции
qs z e Na Г z F Г ,
где F e Na |
– число Фарадея, z F – заряд одного грамм |
иона, Г – величина адсорбции.
Рис. 11.3. Действие сил поверхностного натяжения и электрических сил на
поверхность.
Из этого уравнения следует, что с увеличением потенциала поверхности поверхностное натяжение уменьшается. Физическая сущность этого уравнения заключается в том, что уменьшение свободной поверхностной энергии системы приводит к увеличению
8
Если происходит.
Если Umax KT , то происходит коагуляция. При этом вероятность слипания , т.е. отношение числа слипаний к числу столкновений, равна единице, каждое столкновение приводит к слипанию, что соответствует быстрой коагуляции, которая протекает при отсутствии на поверхности частицы защитного слоя. При
Umax KT некоторые частицы, для которых KT , слипаются, другие,
для которых Umax KT , не слипаются. При вероятности слипания
1 происходит медленная коагуляция. В этом случае кинетическая энергия частиц различна, а на поверхности в отдельных местах сохраняется защитный слой. Следует отметить, что быстрая коагуляция может происходить медленно при малой концентрации, а
медленная быстро при перемешивании.
Величина U''min определяет обратимое слипание или агрегацию
частиц. Частицы притягиваются друг к другу, но при этом сохраняются
прослойки жидкости между ними, H 0 и агрегаты вновь
разрушаются вследствие теплового движения. Если U''min KT , то
частицы не |
фиксируются в |
дальней |
яме, и если |
при этом |
Umax KT , |
то разойдутся, |
а если |
Umax KT , то |
попадут в |
ближнюю потенциальную яму. Если U''min KT , то частицы фиксируются в дальней яме, происходит обратимая агрегация частиц,
дальнодействующее притяжение.
53
www.mitht.ru/e-library
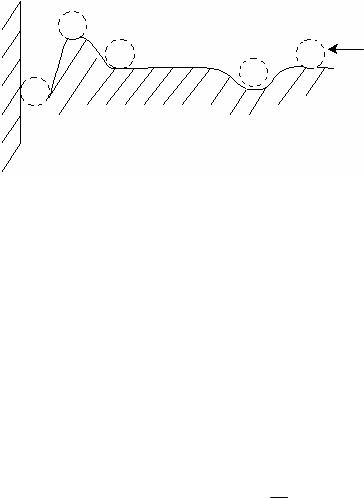
Рис. 12.10. Механическая модель взаимодействия частиц.
12.4.Коагуляция.
Различают коагуляцию явную, наблюдаемую невооруженным глазом, и скрытую, наблюдаемую при помощи приборов. Коагуляция может быть вызвана действием различных факторов: температуры,
механических воздействий, введения электролитов и других веществ.
Агрегативная устойчивость резко изменяется при малых добавках электролитов. При критической концентрации наступает быстрая коагуляция. Значение критической концентрации, или порога коагуляции, резко уменьшается с ростом заряда противоионов в
B
соответствии с правилом Дерягина-Ландау: CU z6 .
12.1.1. Механизм коагуляции электролитами по теории
ДЛФО.
Возможность коагуляции, т.е. необратимого слипания частиц,
зависит от соотношения двух энергетических характеристик: U и KT .
52
электрической энергии. Одноименные заряды стремятся растянуть
поверхность, то есть препятствуют поверхностному натяжению,
сжимающему поверхность (Рис. 11.3).
11.4 Строение двойного электрического слоя.
Гермгольц и Перрен представляли ДЭС как плоский конденсатор, потенциал между обкладками которого изменяется по линейному закону. С появлением теории электролитической диссоциации простейший моделью ДЭС стал плоский конденсатор,
одной обкладкой которого является поверхность, а второй ионы,
находящиеся в растворе. Сумма зарядов поверхности равна сумме зарядов ионов.
11.4.1 Внешняя часть ДЭС
Согласно современным представлениям, ДЭС существует в двух областях внутренней, состоящей из адсорбированных ионов, и
внешней, диффузной, в которой ионы распределены под действием электрических сил и теплового движения. Рассмотрим вначале диффузную часть ДЭС. Простейшей количественной моделью диффузной части ДЭС, является модель Гуи и Чемпена, основанная на следующих положениях:
Поверхность представляет собой плоскость неопределенных размеров и однородно заряженную.
Ионы диффузной части представляют собой точечные заряды с распределением по Больцману, то есть раствор ионов рассматривается как идеальный. Ионы находятся в тепловом движении и могут подходить к поверхности сколь угодно близко.
Работа переноса иона из объема в двойной электрический слой имеет чисто электростатический характер, то есть равна работе
против сил электростатического взаимодействия.
9
www.mitht.ru/e-library
Растворитель влияет на ДЭС посредством диэлектрической постоянной, которая одинакова по всей диффузной части.
Строение части ДЭС определяется соотношением потенциальной энергии притяжения противоионов к заряженной поверхности и кинетической энергии их теплового движения.
Рис.11.4. Изменение концентрации ионов вблизи заряженной поверхности.
Модель Гуи-Чемпена основана на идее подвижности ионов.
Противоионы удерживаются у поверхности силами электрического притяжения и совершают тепловое движение. Поэтому концентрация противоионов убывает по мере удаления от поверхности. При равновесном распределении ионов у поверхности образуется облако электрических зарядов с убывающей плотностью.
Слой раствора с измененными значениями концентрации ионов вблизи поверхности называется диффузным. Этот термин показывает,
что причиной пространственной размытости слоя является диффузия.
Сумма зарядов диффузной части ДЭС равна противоположному по знаку заряду поверхности. Толщина диффузного слоя изменяется в зависимости от условий от 10-10 до 10-4м.
10
преобладают силы электростатического отталкивания. В этой области происходит перекрывание ДЭС соседних частиц, и силы отталкивания велики. Это определяет существование на результирующей кривой энергетического барьера Umax , величина которого определяет
вероятность слипания частиц. Чем выше Umax , тем меньше
вероятность его преодоления, тем устойчивее система.
Энергия отталкивания является экспоненциальной функцией расстояния между частицами, а энергия притяжения – степенной
функцией. |
Экспоненциальная зависимость y a e x при |
больших |
значениях |
x убывает быстрее степеннойy x a . |
Поэтому |
притяжение будет преобладать при больших расстояниях между
частицами. В области больших расстояний H 100 нм
преобладают силы притяжения, т.к. они убывают по степенной функции медленнее, чем силы отталкивания. В результате этого на результирующей кривой появляется вторичный минимум, U''min , или дальняя потенциальная яма. U''min определяет обратимую агрегацию частиц, в том числе явление тиксотропии. Существование U''min
объясняет ряд других явлений. Так, малые частицы, прилипшие к стенке, совершают около нее интенсивное броуновское движение. В
латексах можно наблюдать движение мелких частиц вокруг более крупных.
Результирующая потенциальная кривая взаимодействия частиц может быть представлена грубой механической моделью в виде шара,
находящегося на рельефной поверхности (рис. 12.10).
51
www.mitht.ru/e-library
