
КХ часть 1
.pdf
Рис. 4.1. Решение уравнения Ленгмюра.
По первому способу по изотерме находят значение max . Затем продолжают начальный прямолинейный участок изотермы до
пересечения с линией |
max |
и из точки |
пересечения |
опускают |
||||
перпендикуляр до точки |
p' на оси абсцисс. |
При малых p |
значение |
|||||
K p 1, |
и им знаменателе можно пренебречь. Тогда уравнение |
|||||||
принимает |
вид: max K p'. |
При max |
K p' 1. |
Отсюда |
||||
K |
1 |
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
p' |
|
|
|
|
|
|
|
Второй способ решения уравнения Ленгмюра применяется, когда экспериментальная изотерма не имеет третьего линейного участка, т.
е. значение max неизвестно. Уравнение преобразуется в уравнение
прямой:
1 |
|
1 Kp |
1 |
|
1 |
|
p |
1 |
|
p |
|
||
|
|
|
|
|
|
|
; |
|
|
|
|
|
(4.5) |
|
maxKp |
maxKp |
max |
|
maxK |
max |
|||||||
78
ln P ln P |
|
2 VM |
; ln P |
ln P |
|
2 VM |
, |
(1.2) |
||
|
|
|||||||||
r |
S |
|
r R T |
r |
S |
|
r R T |
|
||
где PS |
и Pr |
- |
давление |
насыщенного пара над |
ровной и |
|||||
искривленной поверхностью, VM - мольный объем жидкости.
Величина 1/r характеризует кривизну поверхности сферической частицы. Чем больше кривизна, тем легче молекулы отрываются от поверхности и интенсивнее протекает испарение капель. Вследствие этого над мелкими каплями упругость пара больше, чем над крупными.
Поэтому в атмосфере насыщенного пара мелкие капли переходят в крупные вследствие изотермической перегонки. Изменение химического потенциала вследствие кривизны поверхности приводит к росту растворимости с увеличением дисперсности, которое
описывается уравнением Гиббса-Фрейндлиха-Оствальда:
lnCr lnC |
2 VM |
(1.3) |
r R T |
Вследствие этого растворимость мелких твердых частиц больше,
чем крупных. Происходит процесс растворения мелких частиц и рекристаллизации их на крупных, то есть изотермическая переконденсация, называемая Оствальдовским созреванием и
описываемая уравнением:
|
|
|
1 |
1 |
|
2 VM |
|
|
Cr1 Cr2 |
|
|
|
|
|
|
|
|
|
|
r |
R T |
(1.4) |
||||
r |
|
|||||||
|
|
|
1 |
2 |
|
|
|
|
При спекании металлических порошков происходит постепенная ликвидация пор. Над малой порой повышена концентрация микропустот (вакансий) в частицах. Это приводит к их диффузии от малых пор к большим и к поверхности раздела металла с воздухом.
Под действием лапласовых сил поры исчезают, заполняются
11
www.mitht.ru/e-library

металлом. Этот процесс сопровождается уменьшением поверхности раздела фаз.
Другими примерами физических поверхностных явлений являются
смачивание и, как следствие этого, существование вогнутого и выпуклого менисков жидкости и перемещение жидкости в капилляре. В
дисперсных системах смачивание уменьшает взаимодействие частиц.
Если частицы имеют ультрамикроскопические размеры, то смачивание способствует образованию золей. Когда частица достаточно велика и оседает, смачивание способствует скольжению частиц друг относительно друга, приводя к более плотной упаковке осадка. Если смачивание неполное, то при взаимодействии частиц происходит преобразование пространственных структур (каркасов и рыхлых осадков).
При смачивании процесс сопровождается изменением свойств поверхности. Поверхность твердое тело - газ заменяется поверхностью твердое тело - жидкость, поверхностное натяжение уменьшается.
К физическим поверхностным явлениям относятся также образование и рост зародышей в растворе и диспергирование.
Примерами химических поверхностных явлений являются
адсорбция и коррозия. Тончайшие слои адсорбированного вещества изменяют свойства поверхности - ее смачивание, возможность взаимодействия с другими веществами. В коллоидных системах,
обладающих большой поверхностью, роль адсорбции особенно велика. При адсорбции на поверхность из объемной фазы диффундирует тот компонент, который уменьшает поверхностное натяжение.
12
слоя, т. е. емкость монослоя. K - константа адсорбционного равновесия, связанная с теплотой адсорбции. K характеризует
энергию взаимодействия адсорбата с адсорбентом, т. е. химическое сродство. Для любой химической реакции справедливо выражение:
G R T lnK ; G H T S ;
H Q;
|
G |
e |
H T S |
e S R eQ RT |
g eQ RT |
|
|
|
|
|
(4.3) |
||||
K e RT |
RT |
||||||
Анализ уравнения Ленгмюра
Рассмотрим насколько хорошо описывает уравнение Ленгмюра изотерму адсорбции на всех ее участках.
На изотерме адсорбции, изображенной на рис. 3.40 можно выделить три участка. При малых значениях p всегда можно выбрать такое значение p , когда значение K p 1, и уравнение Ленгмюра принимает вид:
max K p |
(4.4) |
|
То есть пропорциональна p , что соответствует начальному |
||
линейному участку кривой. При больших |
значениях |
p можно |
подобрать такие значения p , когда величина |
K p 1 |
и max , |
что соответствует третьему участку изотермы. Второй криволинейный участок изотермы описывается полным уравнением Ленгмюра. Таким образом, это уравнение хорошо описывает всю изотерму адсорбции, в
отличие от уравнения Фрейндлиха.
Существует два способа графического решения уравнения Ленгмюра (рис 4.1).
77
www.mitht.ru/e-library

поверхности не зависит от того, занят соседний активный центр или нет.
Ленгмюр рассматривал адсорбцию как квазихимическую реакцию между газом и активными центрами с образованием адсорбционного комплекса.
молекулагаза свободныйактивныйцентр адсорбционный комплекс
p |
0 |
|
Обозначим |
давление газа через |
p , концентрацию свободных |
активных центров через 0 , концентрацию занятых активных центров
через . Тогда константа равновесия K |
|
|
|
|
|
||||
|
|
. |
|
|
|||||
|
|
|
|||||||
|
|
|
|
|
|
p O |
|
|
|
K p O ; |
O max ; |
K p max |
|
||||||
K p max |
k P ; K p K p max |
||||||||
1 Kp K p max |
; |
|
K p max |
|
(4.1) |
||||
|
|
1 K p |
|
||||||
|
|
|
|
|
|
|
|||
Очевидно, величина равна поверхностной концентрации адсорбата, т. е. количеству адсорбированного вещества а, т.к. один активный центр занимает одна молекула адсорбата.
a K p amax ; Иногда числитель и знаменатель этого
1 K p
выражения делят на K .
a |
amax p |
|
amax p |
(4.2) |
||
|
|
|||||
|
|
1 |
p |
|
A p |
|
|
|
|
|
|||
K
Константы уравнения Ленгмюра имеют следующий смысл. max -
это максимальная адсорбция при образовании мономолекулярного
76
Рассмотрение этих примеров показывает, что все поверхностные
явления протекают с уменьшением поверхности или поверхностного
натяжения.
1.5. Основные признаки объектов коллоидной химии
Рассмотрим подробнее два основных признака объектов коллоидной химии: гетерогенность и дисперсность. Все свойства объектов коллоидной химии зависят от этих признаков. Эти признаки неотделимы друг от друга. Каждый из них является необходимым, но недостаточным для отнесения системы к коллоидной. Так, истинные растворы дисперсны, но гомогенны, у них нет поверхности раздела,
поэтому они не изучаются в коллоидной химии. Гетерогенность или многофазность является признаком, обеспечивающим наличие межфазной поверхности, поверхностного слоя. Это важнейший признак коллоидного состояния вещества, с ним связаны самые существенные свойства коллоидов. Гетерогенность указывает на качественную сторону объектов коллоидной химии - наличие межфазной поверхности и качество этой поверхности. Поверхность раздела представляет собой пример единства противоположностей.
Молекулы на поверхности принадлежат к обеим фазам.
Существование межфазной поверхности предполагает наличие поверхностного натяжения . Величина поверхностного натяжения определяет степень различия между соприкасающимися фазами. Чем сильнее выражена гетерогенность, т. е. чем более резко отличаются фазы по своей природе, тем больше величина поверхностного натяжения. При отсутствии гетерогенности поверхностное натяжение равно 0.
Характеризуя гетерогенность как признак коллоидных систем,
связанный с поверхностью, необходимо отметить отличия молекул на
13
www.mitht.ru/e-library
поверхности от молекул в объеме. Молекулы, находящиеся на поверхности, сильно отличаются от молекул, находящихся в объеме.
Первое отличие состоит в том, что молекулы на поверхности находятся в ином энергетическом состоянии по сравнению с молекулами в объеме, т. е. обладают избыточной свободной энергией.
Молекулы в этом слое находятся в несимметричном силовом поле.
Молекулярные силы в поверхностном слое некомпенсированы, и
поэтому молекулы на поверхности обладают избытком свободной энергии Fs. Мерой этого избытка является поверхностное натяжение ,
т.е. свободная поверхностная энергия, приходящаяся на 1см2
величины поверхности s. Fs= sмол. Избыток свободной энергии на поверхности делает систему термодинамически неравновесной.
Поэтому все поверхностные процессы протекают самопроизвольно в сторону уменьшения Fs, что достигается уменьшением sмол или .
Второе отличие состоит в том, что молекулы, находящиеся в объеме и на поверхности, по-разному ориентируются. Средняя конформация молекулы в объеме и на поверхности различна. Так,
пленка стеариновой кислоты, отлитая на стекле, со стороны воздуха гидрофобна, а со стороны стекла гидрофильна.
Суть третьего отличия состоит в том, что в кристаллических телах молекулы и атомы, находящиеся на поверхности, имеют иную электронную структуру по сравнению с молекулами и атомами расположенными в объеме.
Четвертое отличие заключается в том, что в случае многокомпонентных систем состав поверхностного слоя и объема различен вследствие адсорбции.
Дисперсность или раздробленность является количественным признаком объектов коллоидной химии. Применяются следующие количественные параметры раздробленности: размер частиц α,
14
4. Адсорбция газов и паров на твердой поверхности
4.1. Теория мономолекулярной адсорбции Ленгмюра
Ленгмюр и Поляни одновременно в 1915 году разработали теории адсорбции газов и паров на твердой поверхности. Эти теории являются ограниченными. Они применяются в зависимости от природы адсорбента и адсорбата и условий адсорбции. Теория Ленгмюра рассматривает физическую и химическую адсорбцию при малом давлении и температуре ниже критической. Она неприменима к тонкопористым сорбентам. Теория Поляни применима только к физической адсорбции.
Теория Ленгмюра учитывает ограниченность поверхности адсорбента, что приводит к адсорбционному насыщению поверхности по мере увеличения концентрации адсорбата.
При разработке этой теории Ленгмюром были сделаны следующие допущения:
1.Адсорбция локализована, адсорбционные силы близки к химическим.
2.Адсорбция происходит на активных центрах адсорбента,
которые энергетически эквивалентны.
3.Радиус действия адсорбционных сил мал, и один активный центр адсорбирует одну молекулу адсорбата, причем образуется мономолекулярный адсорбционный слой.
4.Устанавливается динамическое равновесие адсорбция десорбция.
5.Между адсорбированными молекулами отсутствует взаимодействие, вследствие чего время пребывания на
75
www.mitht.ru/e-library

3.9. Кинетика адсорбции
Кинетика адсорбции подчиняется уравнению первого порядка, т.к.
чаще всего лимитирующей стадией адсорбции является диффузия.
Чем больше насыщение поверхности, т. е. меньше разность (a at ),
тем меньше скорость адсорбции.
da |
k a |
равн |
а |
(3.12) |
|
||||
d |
|
|
||
|
|
|
||
Сповышением температуры скорость адсорбции увеличивается,
аравновесная адсорбция уменьшается (рис. 3.13) .
Рис. 3. 13. Кинетические кривые адсорбции при различной температуре.
Константа K зависит от теплоты адсорбции, температуры и коэффициента диффузии адсорбата. Температурный коэффициент адсорбции мал, т. к. энергия активации физической адсорбции равна
0.
74
дисперсность Д, удельная поверхность sуд. В зависимости от формы частицы берется ее характеристический размер: для сферы – диаметр d, для куба – ребро l. Для частиц неправильной формы в качестве количественной характеристики раздробленности применяются радиус эквивалентной сферы r и u.
Между этими характеристиками существуют простые соотношения.
1 |
|
1 |
|
||||
Д |
|
; |
|
|
|
(1.5) |
|
а |
|||||||
|
|||||||
|
|
|
м |
|
|||
Для пористых или ячеистых тел, дисперсной фазой которых является газ, дисперсность выражается отношением числа атомов,
находящихся на поверхности, ns, к общему числу атомов, n0:
Äns n0
Удельная поверхность sуд - это отношение поверхности к объему или массе. При расчете удельной поверхности на единицу объема дисперсной фазы:
s |
|
|
s |
12 |
; |
м2 |
, |
1 |
(1.6) |
óä |
|
м3 |
|
||||||
|
|
V |
|
м |
|||||
Иногда удельную поверхность относят к единице массы:
s |
|
|
s |
м2 |
|||
óä |
12 |
; |
|
(1.7) |
|||
|
|||||||
|
|||||||
|
|
V1 |
кг |
||||
Для монодисперсной системы, содержащей n частиц сферической формы радиуса r :
s |
óä |
|
|
4 r2 |
n |
|
3 |
|
6 |
(1.8) |
||
|
4 |
|
|
|
r |
|
||||||
|
|
|
r |
3 |
n |
|
|
d |
||||
|
|
|
|
3 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
15
www.mitht.ru/e-library

В общем случае s |
óä |
|
K |
, где K - коэффициент формы частицы. |
|
||||
|
|
a |
||
Для полидисперсной системы:
s |
|
|
3 n r2 |
|
|
|
óä |
|
i i |
, |
(1.9) |
||
n r3 |
||||||
|
|
|
|
|||
|
|
|
i i |
|
|
где ni - число частиц радиуса ri .
Диспергирование можно производить уменьшением одного,
двух или трех измерений (рис. 1.4).
Рис. 1.4. Форма дисперсий, образующихся при изменении размеров куба в одном,
двух или трех измерениях.
В зависимости от этого образуются различные дисперсии: пленки,
нити или частицы. Раздробленность определяется наименьшим базовым размером a.
Поверхностные явления возникают на любых поверхностях,
независимо от их протяженности. Увеличение дисперсности приводит к увеличению роли поверхностных явлений в системе.
Дисперсность или удельная поверхность является термодинамическим параметром состояния, изменение которого вызывает изменение других равновесных свойств. В качестве примера рассмотрим гетерогенную смесь воды с бензолом, содержащую
16
Я.Б.Зельдович показал, что при экспоненциальном распределении неоднородностей поверхности и среднем заполнении уравнение Фрейндлиха может быть получено теоретически.
Существует 5 основных типов изотерм адсорбции (рис. 3.12).
Рис. 3.12. Изотермы физической адсорбции.
Изотерма адсорбции 1 типа описывается уравнением Ленгмюра:
|
max k p |
(3.11) |
|
1 k p |
|||
|
|
Этот тип изотермы соответствует мономолекулярной адсорбции.
Остальные типы изотерм соответствуют полимолекулярной адсорбции: 2 – S-образная кривая с линейным участком в области средних давлений; 3 – кривая, вогнутая к оси адсорбции без перегибов
da
с монотонным увеличением |
|
; 4, 5 – кривые типов 2, 3, |
|
dp
осложненные капиллярной конденсацией, сопровождающей полимолекулярную адсорбцию.
73
www.mitht.ru/e-library
|
|
|
|
|
|
1 |
1, и а |
|||
изотермы. На начальном, линейном участке изотермы |
|
|||||||||
n |
||||||||||
|
|
|
|
|
|
|
|
|
||
пропорциональна |
p . На |
третьем |
участке |
1 |
0 и |
a const . |
||||
|
||||||||||
|
|
|
|
|
|
n |
|
|||
Следовательно, |
показатель |
степени |
1 |
характеризует |
кривизну |
|||||
|
|
|||||||||
|
|
|
|
n |
|
|
|
|
||
криволинейного участка изотермы адсорбции. Это правильная дробь,
характеризующая степень приближения изотермы к прямой. Чем
1
больше значение , тем круче криволинейный участок изотермы n
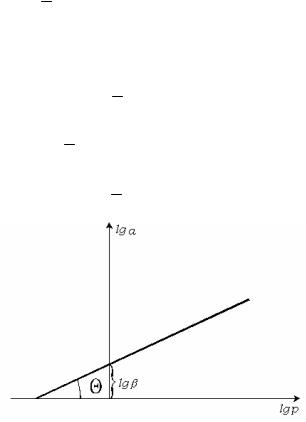
адсорбции. Для определения констант уравнения Фрейндлиха применяют логарифмирование. После логарифимирования уравнение
1
принимает вид lga lg lg p. Из графической зависимости n
1
находят константы и . Отрезок, отсекаемый прямой линией на оси n
1
ординат, равен lg , а tg (рис. 3.11). n
Рис. 3.11. Решение уравнения Фрейндлиха.
72
небольшое количество поверхностно-активного вещества. В высоком узком цилиндре, где межфазная поверхность вода - бензол невелика,
смесь характеризуется определенным равновесным распределением ПАВ между поверхностью и объемом. Если эту смесь перелить в противень, то межфазная поверхность увеличится, количество ПАВ на поверхности увеличится, а концентрация в объеме уменьшится.
Равновесие в системе изменится только за счет изменения дисперсности, или удельной поверхности при постоянстве других параметров (объема, массы, температуры, давления, числа компонентов). Это изменение является обратимым.
Если пренебречь влиянием поверхности, то, согласно правилу фаз Гиббса F K Ф 2, число степеней свободы F при постоянных температуре и давлении равно 1, т. е. можно изменять только количество ПАВ в системе. При постоянном содержании ПАВ F=0. С
учетом влияния поверхности, т. е. дисперсности, появляется дополнительная степень свободы. Из приведенного примера следует,
что изменение поверхности приводит к изменению распределения ПАВ, т. е. система обладает дополнительной степенью свободы, и
правило фаз записывается следующим образом: F K Ф 3.
Дисперсность характеризует количество поверхности, она является количественной характеристикой, указывающей на степень раздробленности, величину межфазной поверхности.
17
www.mitht.ru/e-library
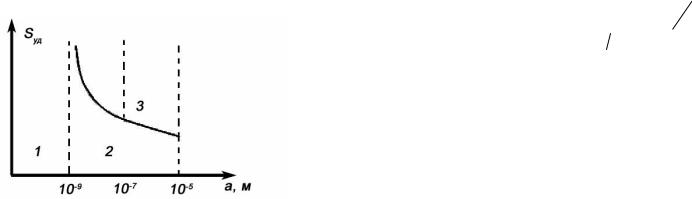
Таблица 1.1. Дисперсность коллоидных систем
|
|
|
|
|
1 |
|
||
|
Система |
|
|
а, м |
Д , |
|
|
|
|
|
|
м |
|||||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
||
Коллоидная |
(наноразмерная, |
|
|
|
|
|
||
ультрамикрогетерогенная), частицы видимы в |
10 |
9 ÷10 7 |
109 ÷107 |
|||||
электронный микроскоп и в атомный силовой |
||||||||
|
|
|
|
|
||||
микроскоп |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Микрогетерогенная, |
частицы |
видны в |
10 |
7 ÷10 5 |
107 ÷105 |
|||
обычный микроскоп |
|
|
||||||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
Грубодисперсная, |
частицы |
видны |
10 5 |
105 |
||||
невооруженным глазом |
|
|||||||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
Системы, изучаемые в коллоидной химии, характеризуются широким диапазоном дисперсности, значения которой приведены в табл.1.1.
Зависимость удельной поверхности от размера частиц приведена на рис. 1.5.
Рис. 1.5. Зависимость удельной поверхности от размера частиц.
18
Таблица 3.1. Теплота и время прибывания молекулы на
поверхности для физической адсорбции и хемосорбции.
Физическая адсорбция |
Хемосорбция |
||
|
|
|
|
qa , кДж/моль |
, с |
qa , кДж/моль |
, с |
|
|
|
|
1,6 |
1,1 10-12 |
60 |
2 10-2 |
6 |
1,3 10-12 |
80 |
1 102 |
24 |
1 10-10 |
100 |
6 105 |
40 |
-6 |
120 |
9 |
|
3 10 |
160 |
4 10 |
|
|
17 |
|
|
|
808 |
10 |
|
|
126 |
|
|
|
|
10 |
|
|
|
|
При адсорбции газов на гладкой поверхности равновесие устанавливается очень быстро, в течение долей секунды. При адсорбции на твердой пористой поверхности адсорбция замедляется вследствие проникновения адсорбата в поры адсорбента,
контролируемого диффузией.
Объединяя уравнения (3.7), (3.8) и (3.9), получим закон Генри:
|
N p |
0 exp(qa |
R |
T |
) |
k P |
(3.10) |
|
|
|
|
|
|
|
|||
|
|
|
|
|||||
 2 M R T
2 M R T
Участок 2, соответствующий средним давлениям является криволинейным, т.к. на этом участке достигается промежуточная степень заполнения поверхности адсорбента.
Изотерма адсорбции имеет вид параболы и описывается
|
1 |
|
1 |
|
||
|
|
|
|
|
||
эмпирическим уравнением Фрейндлиха: a pn , |
где и |
- |
||||
|
||||||
|
|
|
|
n |
||
константы, не имеющие физического смысла, но имеющие математический смысл. Эти константы не зависят от концентрации адсорбата. Это уравнение хорошо описывает среднюю часть
71
www.mitht.ru/e-library

При относительной влажности 10%, T 293K , P 1,75мм рт.ст.,
число молекул воды, сталкивающихся с поверхностью в секунду равно
1021 .
Площадь занимаемая молекулой воды на поверхности равна 10
Å2 , т. е. 10 15 см, следовательно, 1015 моль/см2 . Это означает,
что 10 6 сек, а скорость установления равновесия крайне велика,
монослой образуется практически мгновенно. За время пребывания на поверхности молекулы адсорбата обмениваются тепловой энергией с поверхностью адсорбента. Таким образом, без адсорбции теплообмен был бы невозможен. Роль адсорбции в теплообмене составляет одно из важнейших ее проявлений в технических и природных процессах.
Я.И.Френкель в 1924 году получил выражение для зависимости
от T .
qa |
|
oe RT |
(3.9) |
0 - константа, равная периоду колебаний в решетке адсорбента
порядка 10 13 сек . Как видно из уравнения, сильно зависит от T и qa , т. к. они стоят в показателе степени.
Ниже приведены значения , вычисленные для различных qa
при комнатной температуре.
Последнее значение больше возраста Земли и Солнечной системы. При qа 100кДж/ моль молекула живет на месте недели,
годы или тысячелетия, поэтому хемосорбция в большинстве случаев является локализованной.
70
Аналитически эта зависимость выражается формулой гиперболы.
На этом графике существуют три области: 1 - истинные растворы молекулярной степени дисперсности, 2 – высокодисперсные
(наноразмерные, ультрадисперсные) системы с размером частиц 10-9
÷10-7м, за которыми укрепилось название «золи», 3 -
микрогетерогенные и грубодисперсные системы с размером частиц 10- 7 ÷ 10-5 м. Эти системы представляют собой взвеси, которые со временем оседают и образуют структуры в осадке. Размер частиц в них настолько велик, что частицы видны в обычный микроскоп или даже невооруженным глазом. Поскольку крупные частицы отражают свет, эти системы обладают сильной мутностью.
1.6. Фундаментальные особенности
ультрадисперсного (коллоидного) состояния вещества
Ультрадисперсное состояние - это особый уровень состояния вещества, следующий за атомно-молекулярным уровнем, особое конденсированное состояние между молекулярным соединением и компактной массой материала. Отличия этого состояния настолько велики, что его называют пятым агрегатным состоянием вещества.
Причина этих отличий в том, что число атомов на поверхности ультрадисперсной частицы (УДЧ) равно числу атомов в ее объеме nS nV , а свободная поверхностная энергия становится равной
внутренней энергии частицы, т.е. |
Fs |
|
U |
. Колебания |
V |
|
|||
|
|
dV |
||
поверхностных атомов в УДЧ происходят с большей амплитудой и меньшей частотой, чем в объеме. Это обусловливает изменение колебательного спектра и увеличение теплоемкости УДЧ по сравнению с массивными образцами. Имеются также отличия в структуре частицы: отсутствие плотной упаковки, изменение
19
www.mitht.ru/e-library

расстояния между атомами. По структурным признакам область
размеров частиц от 100 до 300 A является переходной. В этой области в металлических частицах возникают два типа упаковки атомов:
внутренняя, соответствующая данному типу кристалла, и внешняя – икосаэдрическая (икосаэдр – двадцатигранник). Существует критический размер, выше которого поверхностные структуры становятся менее стабильными, чем внутренние, упаковка которых соответствует структуре данного компактного материала. Переход от поверхностной структуры к внутренней затруднен кинетически из-за необходимости перестройки окружения большого числа атомов, что делает структуру УДЧ метастабильной. Форма и структура УДЧ неравновесны и соответствуют энергонасышенному состоянию вещества. Насколько велика насыщенность энергией, говорит
следующий пример. При дроблении |
NaCl до 1 10 9 м |
энергия |
||
молекулярного взаимодействия увеличивается в 107 |
раз по |
|||
сравнению |
с |
компактными |
материалами. |
Большая |
энергонасыщенность приводит к усилению взаимодействия между частицами и к изменению физико-химических и физико-механических свойств вещества. Выделение избыточной энергии приводит к сильному взаимодействию с полимерной матрицей. Для неорганических композитов с УДЧ твердость возрастает в несколько
раз, возрастает также ударная вязкость.
Неравновесность или метастабильность ультрадисперсного
состояния приводит к двум следствиям. Первое следствие состоит в том, что УДЧ взаимодействуют с любыми веществами, в том числе кислородом, водой, азотом, инертными газами по механизму адсорбции и химического взаимодействия. Второе следствие состоит в том, что УДЧ, не имеющие защитного слоя на поверхности,
20
На кривой имеется три участка, расположенных в области низких,
средних и высоких давлений. При малых p наблюдается линейная зависимость адсорбции от давления или концентрации, т. к.
поверхность адсорбента свободна, идет активное заполнение поверхности. В этой области адсорбция прямо пропорциональна давлению в соответствии с законом Генри: k P. Уравнение Генри можно получить путем рассмотрения адсорбции из газовой фазы на основе кинетического подхода.
Рассмотрим динамическую картину адсорбционного процесса,
поведение молекул в поверхностном слое, т.е. кинетику адсорбции.
Кинетические закономерности адсорбции определяют скорость установления равновесия при адсорбции, или сокращенно, скорость адсорбции. При столкновении с поверхностью молекула либо отражается от поверхности под углом, равном углу падения, либо некоторое время остается на поверхности, затем десорбируется. Чем больше времени молекула находится на поверхности, тем длительнее устанавливается равновесие. Иными словами, скорость установления равновесия V увеличивается с уменьшением времени пребывания молекулы на поверхности .
Величина адсорбции равна произведению времени пребывания молекулы на поверхности на число молекул,
контактирующих с поверхностью в единицу времени. В этом и состоит динамическое уравнение адсорбции, которое записывается следующим образом:
|
n |
|
|
|
|
(3.7) |
||
Из кинетической теории следует, что |
|
|||||||
n |
|
|
N p |
|
|
мол |
(3.8) |
|
|
|
|
|
|
|
|
||
|
|
2 MRT см2 сек |
||||||
|
|
|
|
|||||
|
|
|
|
69 |
|
|||
www.mitht.ru/e-library
