
КХ часть 1
.pdf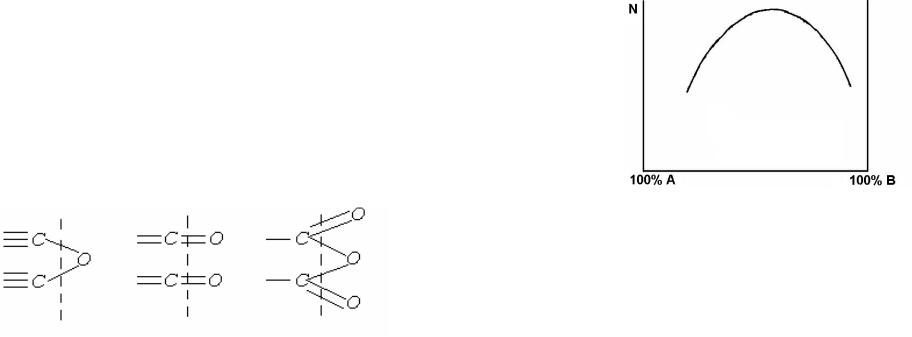
при хемосорбции образуются мономолекулярные слои. При этом следует иметь в виду, что в отличие обычной химической реакции,
протекающей на поверхности, когда возможны диффузия реагента вглубь объемной фазы, хемосорбция является процессом образования двумерного химического соединения, т. к.
хемосорбционный слой препятствует диффузии реагента.
В качестве примера рассмотрим хемосорбцию кислорода на угле.
Окисление поверхностных атомов углерода приводит к образованию
различных поверхностных оксидов:
Рис. 1.7. Зависимость динамической выносливости резины при определенном
составе смеси.
Рис. 3.4. Схема хемосорбции на угле.
Прочная пленка оксида препятствует дальнейшему проникновению кислорода вглубь твердой фазы.
Третье различие между физической адсорбцией и хемосорбцией состоит в различии кривых потенциальной энергии, вытекающем из разной природы связей, образующихся между адсорбентом и адсорбатом.
Кривые потенциальной энергии при адсорбции двухатомного газа
X2 на металле M показаны на рис. 3.5.
58 |
31 |
www.mitht.ru/e-library
2.Поверхностные явления и адсорбция
2.1.Классификация поверхностных явлений
Поверхностные явления следует рассматривать, как центральную часть курса коллоидной химии. Как уже указывалось выше, в
поверхностном слое появляется избыток свободной энергии -
поверхностная энергия FS . Это приводит к повышенной активности поверхностного слоя. Поверхностные явления определяются действием химических или межмолекулярных сил. Они могут также происходить при совместном действии молекулярных и внешних сил
(сил тяжести). Это наблюдается на границах раздела твердой и жидкой фаз и сопровождается искривлением жидких поверхностей раздела. Такие поверхностные явления называются капиллярными
(см. с.10).
Поверхностные явления в твердых телах происходят прежде всего на внешней поверхности тела. К таким явлениям относятся смачивание, адгезия (прилипание), трение, коррозия. Наряду с этим,
поверхностные явления происходят и на внутренних поверхностях,
образующихся вследствие дефектов кристаллической решетки,
зернистой структуры вещества.
Форма реализации поверхностных явлений не зависит от размера поверхности. Рассмотрим закономерности поверхностных явлений,
которые являются общими для микро- и макроповерхностей.
Объединенное уравнение 1-го и 2-го начал термодинамики позволяет классифицировать поверхностные явления. Запишем это уравнение в форме:
32
Вследствие высокого значения теплоты хемосорбции процесс хемосорбции трудно обратим. Физическая же адсорбция легко обратима, процесс идет без энергии активации и равновесие устанавливается быстро.
Необратимость хемосорбции связана также с ослаблением приповерхностных связей атомов адсорбента, вследствие чего при десорбции выделяется не адсорбат, а другое соединение. Так, при десорбции кислорода, хемосорбированного на угле, десорбируется не кислород, а оксиды углерода. Вследствие взаимодействия поверхностных атомов углерода с кислородом резко уменьшается прочность их связи с другими атомами углерода. Поэтому при десорбции отрывается оксид углерода, а не кислород.
Вещества, адсорбированные на ткани за счет физической адсорбции, могут быть легко удалены путем проветривания
(нафталин, бензин и др.). Если же вещества адсорбировались за счет хемосорбции, то удалить их чрезвычайно трудно или просто невозможно. Так, анализ волос Ньютона, проведенный в 1979 году,
показал повышенное содержание ртути в них. Действительно, Ньютон в течение 18 лет работал со ртутью, и это, возможно, послужило причиной его тяжелого заболевания за 33 года до смерти.
Волосы Наполеона содержали повышенное количество мышьяка,
источником которого, как считают историки, послужили обои его спальни. Очевидно, мышьяк и ртуть связаны с кератином, из которого состоят волосы, химическими связями, т.е. хемосорбционно.
Второе различие между физической адсорбцией и хемосорбцией состоит в том, что физическая адсорбция может быть как монослойной, так и многослойной. Многослойная физическая адсорбция протекает при давлении насыщенного пара и переходит в конденсацию. В отличие от этого, хемосорбция всегда монослойна,
57
www.mitht.ru/e-library
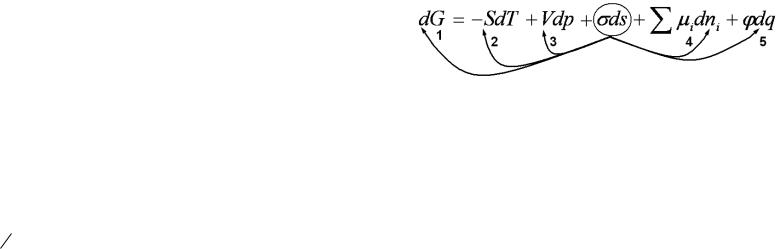
Так как адсорбция обратима, то она подчиняется правилу Ле Шателье. При повышении температуры процесс сдвигается в сторону десорбции, идущей с поглощением тепла, т. е. адсорбция уменьшается. Адсорбция имеет отрицательный температурный коэффициент. С повышением температуры равновесные значения адсорбции уменьшаются. Изотермы адсорбции при высокой температуре расположены ниже изотермы, соответствующей более низкой температуре (рис. 3.3).
Адсорбция возрастает с увеличением теплоты адсорбции в соответствии с уравнением:
q |
|
KP ge RT |
(3.4) |
где Kр - константа равновесия адсорбции, q - теплота адсорбции.
3.5.Физическая адсорбция и хемосорбция
Взависимости от природы адсорбционных сил различают
физическую адсорбцию и химическую адсорбцию, или хемосорбцию.
Физическая адсорбция обусловлена действием физических, т. е.
вандерваальсовых сил межмолекулярного взаимодействия.
Хемосорбция обусловлена образованием химических связей между адсорбентом и адсорбатом.
Между физической адсорбцией и хемосорбцией имеется ряд существенных различий. Первое различие состоит в том, что
теплоты физической адсорбции и хемосорбции сильно от-
личаются. Теплота физической адсорбции газов обычно равна теплоте их конденсации, а теплота хемосорбции много больше. Так,
при адсорбции азота на железе Hфиз 10кДж/ моль,
Hхим 150кДж/ моль, Hконд 5,7 кДж/ моль.
56
(2.1)
где G - энергия Гиббса, S - энтропия, T - температура, V -
объем, p - давление, - поверхностное натяжение, s - поверхность,
i - химический потенциал, ni - число молей, - электрический потенциал, q- заряд.
Уравнение (2.1) выражает приращение энергии Гиббса через алгебраическую сумму приращений других видов энергий.
Превращение поверхностной энергии в другой вид энергии отвечает определенным поверхностным явлениям.
Стрелкой 1 указан переход поверхностной энергии в энергию Гиббса. Такой переход имеет место при адсорбции, а также лежит в основе изменения реакционной способности с изменением дисперсности. Стрелка 2 обозначает переход поверхностной энергии в теплоту, который происходит при изотермической перегонке,
адсорбции и смачивании и выражается теплотой конденсации,
смачивания или адсорбции. Переход поверхностной энергии в механическую указан стрелкой 3. Такой переход наблюдается при адгезии, капиллярности, адсорбции. Стрелка 4 указывает на переход поверхностной энергии в химическую, что соответствует таким поверхностным явлениям, как адсорбция, коррозия. Наконец, переход поверхностной энергии в электрическую указан стрелкой 5. Такой переход приводит к образованию электрического заряда поверхности и двойного электрического слоя и соответствует группе электро-
кинетических явлений: электрофорезу, электросмосу, потенциалам течения и оседания.
33
www.mitht.ru/e-library
2.2. Основы термодинамики поверхностного слоя
Во введении отмечалось, что коллоидные системы обладают сильно развитой поверхностью раздела между фазами. В
поверхностном или межфазном слое молекулы принадлежат обеим фазам, они контактируют не только с себе подобными, но и с молекулами другой фазы. Поэтому вещество в поверхностном слое находится в особом состоянии, и необходимо определить вклад поверхностного слоя в термодинамические свойства всей системы.
Для этого необходимо рассмотреть свойства и состав поверхностных слоев, поверхностную энергию, и другие термодинамические функции.
При таком рассмотрении будем иметь в виду, что основные положения термодинамики объемных фаз применимы и к термодинамике поверхностного слоя.
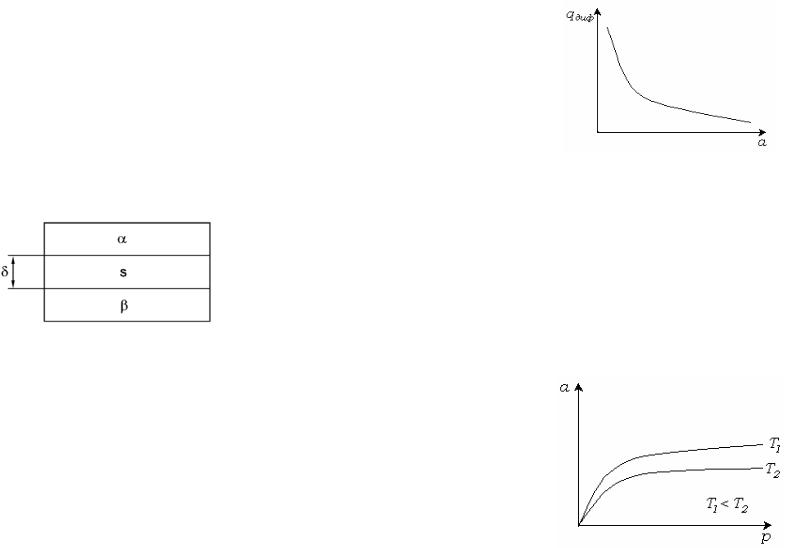
Рис. 2.1. Простейшая гетерогенная система.
Рассмотрим гетерогенную систему, состоящую из трех частей:
фазы , фазы и поверхностного слоя sмол . Между двумя
объемными фазами и образуется поверхностный или граничный межфазный слой. Толщина этого слоя равна . Поверхностный слой является переходной областью от одной фазы к другой: он имеет одну часть в первой фазе, в другую - во второй.
Отметим, что фазы и однородны на всем протяжении, тогда как межфазный слой неоднороден.
34
уменьшается (рис. 3.2). В первую очередь газ адсорбируется наиболее активными участками поверхности, и при этом выделяется наибольшее количество тепла. По мере насыщения активных центров адсорбция происходит на менее активных участках поверхности.
Рис.3.2. Зависимость дифференциальной теплоты адсорбции от величины
адсорбции.
При физической адсорбции значения теплоты адсорбции невелики. Так, значения дифференциальной теплоты адсорбции не превышает 10 ккал/моль. Поэтому физическая адсорбция является обратимым процессом, находящимся в равновесии с обратным процессом десорбции.
Причиной адсорбции являются межмолекулярные силы, причиной десорбции - тепловое движение молекул.
Рис. 3.3. Влияние температуры на изотерму адсорбции.
55
www.mitht.ru/e-library

Рис. 3.1. Зависимость теплоты адсорбции от величины адсорбции.
Различают дифференциальную и интегральную теплоту адсорбции. Интегральная теплота адсорбции - это общее количество тепла, выделившееся при адсорбции данного
количества |
адсорбата |
на |
1 |
кг |
адсорбента |
qинт ; |
||||||
Q |
|
Q |
|
|
Дж |
. |
Зависимость |
интегральной |
теплоты |
|||
m кг адсорбента |
||||||||||||
инт |
|
|
|
|
|
|
|
|||||
адсорбции от величины адсорбции не линейна (рис. 3.1), т. к.
поверхность адсорбента энергетически неоднородна. Вначале адсорбция идет на более активных центрах, и выделяется больше тепла, затем количество выделяющегося тепла снижается.
Дифференциальная теплота адсорбции - это тепло,
выделившееся при дополнительной адсорбции малого количества
dQ Дж
адсорбата в расчете на моль адсорбата qдиф da кг адсорбата .
Дифференциальная теплота адсорбции характеризует не весь адсорбционный процесс, а некоторую его стадию, для которой адсорбция достигла величины a. Дифференциальная теплота адсорбции с увеличением количества адсорбированного вещества
54
Рассмотрим основные отличия свойств поверхностного слоя от свойств объемных фаз и причины этих отличий.
1. Первое отличие межфазного слоя от объемных фаз состоит в том, что удельная внутренняя энергия слоя отличается от внутренней энергии объемных фаз, т. к. в каждой фазе взаи-
модействуют молекулы одного сорта, а в поверхностном слое взаимодействуют разные молекулы.
dU |
dU |
|
dU |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
dV s |
dV |
dV |
|||||||
2. Взаимодействие молекул в поверхностном слое происходит в |
|||||||||
несимметричном |
силовом |
|
|
поле. |
Равнодействующая |
||||
межмолекулярных сил, действующая на молекулу, находящуюся в поверхностном слое, не равна нулю. Поэтому молекулы стремятся уйти с поверхности в объем, и наоборот, при увеличении поверхности происходит вывод молекул из объема на поверхность,
при этом затрачивается работа против |
межмолекулярных сил |
dA dsмол . Эта работа равна |
увеличению свободной |
поверхностной энергии FS . Таким образом, в поверхностном слое происходит сгущение, увеличение свободной поверхностной
энергии dFS 0, FST,Ui,V S . Следовательно, плотность
свободной энергии в объемных фазах и поверхностном слое различна.
|
F |
|
F |
|
F |
|||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
V s |
|
V |
|
V |
|||
35
www.mitht.ru/e-library
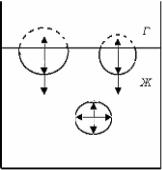
Рис.2.2. Межмолекулярные взаимодействия в объеме и на поверхности.
3. Вследствие избытка свободной поверхностной энергии происходит изменение концентрации компонентов в поверхностном слое. Это изменение может быть как положительным, так и отрицательным. Состав поверхностного слоя отличается от
|
|
n |
|
n |
|
n |
|
|||
состава объемных фаз |
|
i |
|
|
i |
|
|
i |
|
. В поверхностном |
|
|
|
||||||||
|
|
V s |
|
V |
|
V |
|
|||
слое концентрируется компонент, уменьшающий избыток свободной поверхностной энергии.
4. Значения удельной энтропии поверхностного слоя и объемных
|
|
S |
|
S |
|
S |
|
|||
фаз различны т.е |
|
|
|
|
|
|
|
|
|
. При контакте газа с |
|
|
|
||||||||
|
|
V s |
|
V |
|
V |
|
|||
жидкостью или твердым телом поверхностный слой разрыхлен. На поверхности жидкости постоянно протекают процессы испарения и конденсации. Так, например, среднее время жизни молекулы воды на поверхности составляет 10 7 сек. Из-за возможности выхода молекул в менее плотную фазу их число степеней свободы увеличено, поэтому
Sудs Sуд .
36
Адсорбция уменьшает небаланс сил притяжения, которые существуют на поверхности и, следовательно, свободную поверхностную энергию гетерогенной системы. Основное различие между твердыми и жидкими поверхностями заключается в том, что твердая поверхность неоднородна по активности и свойства ее в некоторой степени зависят от предыстории поверхности.
3.4. Адсорбция как обратимый экзотермический
процесс
В адсорбционном слое молекулы газа способны к перемещению лишь в двух измерениях, поэтому адсорбция газа сопровождается уменьшением энтропии, т. е. S 0. Условием протекания адсорбции как самопроизвольного процесса является уменьшение энергии Гиббса, т. е. G 0. Из термодинамической зависимости
следует, что теплота адсорбции должна быть отрицательной, т. е. адсорбция газов или паров на твердом теле всегда является экзотермическим процессом. Поэтому степень адсорбции газа в равновесных условиях увеличивается с понижением температуры. Теплота адсорбции может быть определена прямым калориметрическим методом и рассчитана из обратимой изотермы адсорбции по уравнению Вант-Гоффа
|
дlnP |
|
Hадс |
|
||
|
|
|
|
(3.3) |
||
дT |
RT2 |
|||||
|
|
V |
|
|||
|
|
|
|
|
||
Причиной выделения тепла при адсорбции является уменьшение энергии поверхности адсорбента.
53
www.mitht.ru/e-library

Основным законом, определяющим поведение компонентов при адсорбции, является закон распределения Нернста-Шилова .
Величина адсорбции компонентов зависит от температуры и концентрации или давления.
A f[T,C(или p)] |
(3.2) |
Поэтому различают следующие виды адсорбционных зависимостей: A f (C) или A f (p) при T const - изотерма
адсорбции; A (T) при p const - изобара адсобции и
P (T) или C (T) - изостера адсорбции
При рассмотрении адсорбции на различных поверхностях раздела: газа с твердым телом, раствора с твердым телом и раствора с газом следует отметить, что адсорбция газа на твердой поверхности является простейшим случаем, удобным для теоретического рассмотрения, т.к. в адсорбционном процессе участвуют только два компонента. Когда газ или пар приводятся в контакт с чистой твердой поверхностью, некоторое количество их связывается с поверхностью в форме адсорбционного слоя. Твердое тело является адсорбентом, а
газ или пар - адсорбатом. Одновременно может наблюдаться поглощение газа объемом твердого тела, т.е. абсорбция.
Степень адсорбции в состоянии равновесия зависит от температуры, давления газа и эффективной поверхности адсорбента.
Поэтому лучшими адсорбентами являются высокопористые вещества,
такие как активированный уголь и силикагель. Их удельная поверхность достигает 1000 м2/г. Зависимость между равновесным количеством адсорбированного газа при данной температуре и давлением газа называется изотермой адсорбции.
52
При контакте жидкости с твердым телом происходит ориентация молекул жидкости, энтропия уменьшается т.е.
образом, поверхностный слой характеризуется избытком термодинамических свойств, который может быть как положительным, так и отрицательным.
Рис. 2.3. Изменение энтропии в поверхностном слое.
2.3. Интенсивные свойства гетерогенных систем
Рассмотрим термодинамические свойства гетерогенной системы,
состоящей из трех частей: фаз , и поверхностного слоя S. Эти свойства делятся на интенсивные и экстенсивные. Интенсивными свойствами называются такие свойства, которые выравниваются при составлении сложной системы из более простых систем.
Интенсивные свойства - это такие физические характеристики,
численные значения которых не зависят от количества вещества. К
интенсивным свойствам относится давление P , температура T ,
химический потенциал , удельная энергия или плотность энергии,
G F
,.
V V
37
www.mitht.ru/e-library
Условия равновесия гетерогенной системы с поверхностным слоем таковы же, что и системы, состоящей из объемных фаз. Эти
условия выражаются уравнениями: T S T |
T , S i i i , |
ps p p . Происходит выравнивание |
интенсивных величин - |
температуры, химического потенциала и давления. Выравнивание этих величин буквально означает их равенство во всех частях системы. Выравнивание остальных интенсивных термодинамических свойств приводит к появлению избытка свойств в поверхностном слое.
Этот избыток может быть как положительным, так и отрицательным.
Рис. 2.4. Изменение плотности свободной энергии на межфазной границе
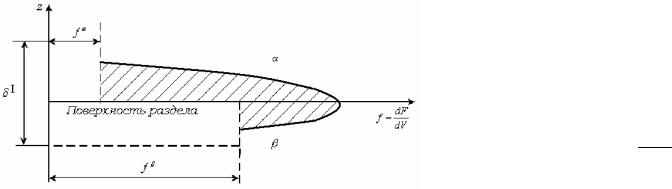
лиофобной системы.
z - расстояние от границы раздела фаз;
- толщина межфазного слоя.
Вкачестве примера изменения интенсивных свойств рассмотрим изменение плотности свободной поверхностной энергии f
лиофобных и лиофильных систем перпендикулярно границе раздела фаз и (рис 2.4, 2.5).
В объеме каждой фазы значение |
f |
постоянно и не зависит от |
расположения элемента объема, |
т. |
к. фаза характеризуется |
38 |
|
|
адсорбатом или адсорбтивом. Если адсорбент находится в виде
фазы, то адсорбат находится в молекулярно-дисперсном состоянии.
3.2 Количественные характеристики адсорбции
Избыточная концентрация i-го компонента расчитаная на единицу площади разделяющей поверхности называется гиббсовой адсорбцией:
|
|
ni |
|
моль |
(3.1) |
S |
|
м2 |
|||
i |
|
|
|
Гиббсова, или абсолютная адсорбция, является удельной величиной, применяемой для описания состава поверхностного слоя независимо от его площади.
Другой характеристикой адсорбции является поверхностная концентрация адсорбата , равная общей концентрации вещества в поверхностном слое рассчитанной на единицу площади поверхности и
|
моль |
выражаемая в |
м2 . При малых концентрациях адсорбата Гi и |
совпадают, при больших - различаются.
Когда поверхность адсорбента неизвестна, величину адсорбции
измеряют емкостью поверхностного слоя a и выражают в |
моль |
|
|
. |
|
|
||
|
кг |
|
Это также общее количество вещества в поверхностном слое,
рассчитанное на единицу массы.
3.3.Типы адсорбционных зависимостей
Стермодинамической точки зрения процессы адсорбции на различных границах раздела фаз не отличаются друг от друга.
Наблюдаемые различия относятся к структуре адсорбционного слоя и механизму процесса адсорбции.
51
www.mitht.ru/e-library
3.Общие закономерности адсорбции
3.1.Понятие об адсорбции
Для рассмотрения причин адсорбции важна зависимость
состава слоя (произведения i dniS ), изменение которого может
привести к изменению других характеристик поверхностного слоя.
Из фундаментального уравнения Гиббса для плоского поверхностного слоя следует, что межфазный слой обогащается тем компонентом, который характеризуется меньшей работой извлечения из объема и снижает поверхностное натяжение. Это приводит к убыли свободной поверхностной энергии dFS 0. Изменение концентрации компонента на поверхности раздела фаз по сравнению с
концентрацией в объеме называется адсорбцией.
Адсорбцию можно определить как процесс выравнивания химических потенциалов компонентов между поверхностью и объемом, приводящий к изменению концентрации на поверхности.
При установлении адсорбционного равновесия давление,
температура и химические потенциалы компонентов в поверхностном
слое и |
в |
объемных |
фазах |
выравниваются p p ps , |
T T |
TS ; |
|
S . В |
отличие от других процессов |
(диффузия, осмос) адсорбция идет не в сторону выравнивания концентраций, а в сторону их расхождения. Происходит накачка поверхностного слоя компонентом, снижающим поверхностное натяжение.
Фаза, на которой происходит адсорбция, называется
адсорбентом. Вещество, которое адсорбируется, называется
50
определенными и постоянными по объему физико-химическими
|
f |
F |
const, |
f |
|
f |
|
f |
|
|
свойствами. |
|
|
0; |
|
0; |
|
0. |
В |
||
V |
x |
y |
z |
|||||||
поверхностном слое f растет вследствие несимметричного силового
поля и сгущения свободной поверхностной энергии. Переход от
энергетического уровня одной фазы f к энергетическому уровню
другой фазы f происходит через энергетический барьер,
отвечающий избытку (сгущению) свободной энергии в поверхностном слое. Величина избытка свободной энергии равна площади заштрихованного «языка».
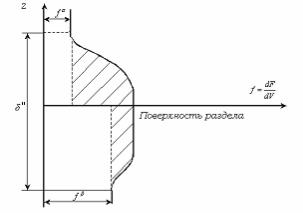
Рис. 2.5. Изменение плотности свободной энергии на межфазной границе лио-
фильной системы.
Когда f f 0, т.е. для лиофобных систем (рис 2.4), для
разнородных фаз при слабом их взаимодействии, избыток свободной энергии велик, заштрихованная площадь велика, но толщина межфазного слоя мала, т.к. молекулярные силы убывают с расстоянием, взаимодействие между фазами отсутствует или оно мало. Для лиофобных систем толщина межфазного слоя составляет
39
www.mitht.ru/e-library

всего (1÷10) 10-10 м. В лиофильных системах (рис 2.5) фазы являются
родственными, они сильно взаимодействуют, f f 0.
Значение межфазного поверхностного натяжения в лиофильных системах мало и составляет величину m 0,1эрг/см2 .
Избыток свободной поверхностной энергии в таких системах меньше, заштрихованная площадь меньше (рис 2.5).
Вследствие сильного взаимодействия фаз, проникновения молекулярного взаимодействия глубоко в объем каждой фазы,
толщина поверхностного слоя в лиофильных системах велика.
Поверхностный слой более размыт, имеет большую протяженность.
По энергетическим параметрам он приближается к фазам.
2.4. Экстенсивные свойства гетерогенных систем
Экстенсивными называются такие свойства, которые при составлении сложной системы из более простых систем суммируются. Экстенсивные свойства - это аддитивные характеристики, их численные значения зависят от количества вещества. К экстенсивным свойствам относятся масса m, объем V ,
поверхность s , количество любого компонента ni , внутренняя энергия
U , свободная энергия F , энтропия S . Для гетерогенной системы с поверхностным слоем каждое экстенсивное свойство является суммой трех величин, характеризующих фазы и поверхностный слой.
U U U U S
F F F FS
S S S SS
ni ni ni niS
40
Fs
3.Ni S,T,Nj Ni j .
Химический потенциал - это мольное приращение свободной энергии при постоянном объеме при переходе i-го компонента в поверхностный слой. Химический потенциал характеризует скорость,
с которой меняется свободная энергия при изменении концентрации данного вещества. Химический потенциал является движущей силой химических реакций. Аналогично поверхностному натяжению химический потенциал можно выразить как частную производную любой характеристической функции по концентрации.
49
www.mitht.ru/e-library
