
- •17-27 – Витамины, 28-30 – ферменты, 32-40 – гормоны, 42-44 – дых.Цепь, 47-48 свобод.Радикалы, 50-ц.Кребса, 69-75 –днк,рнк вопросы итоговой аттестации по биохимии
- •6. Строение триглицеридов. Роль триглицеридов в метаболизме.
- •7. Строение нуклеотидов. Роль нуклеотидов в метаболизме.
- •8. Строение фосфолипидов. Роль фосфолипидов в метаболизме.
- •9. Строение и функции эйкозаноидов.
- •10. Строение и функции холестерина.
- •13. Биологическая роль макро- и микроэлементов.
- •15. Роль фосфопиридоксаля в метаболизме
- •17.Биохимическая функция витамина в12.
- •18.Биологическая роль пантотеновой кислоты(в5)
- •19.Биологическая роль рибофлавина(в2)
- •20.Биологическая роль никотинамида.
- •21. Биохимические функции тиаминпирофосфата.
- •22. Биохимическая роль витамина с.
- •23. Биологическая роль тетрагидрофолиевой кислоты (тгфк).
- •24. Биологическая роль витамина d.
- •25. Биологическая роль витамина а.
- •26. Биологическая роль витамина е.
- •27. Биологическая роль витамина к .
- •29. Строение и классификация ферментов.
- •30. Конкурентное и неконкурентное ингибирование ферментов.
- •31. Особенности биологического катализа.
- •32. Классификация гормонов. Роль гормонов в регуляции метаболизма.
- •33. Гормоны надпочечников и их биохимические функции.
- •34. Гормоны гипофиза и их биологическая роль.
- •35. Биологическая роль половых гормонов.
- •36. Биологическая роль гормонов коры надпочечников.
- •37. Биологическая роль гормонов поджелудочной железы.
- •38. Гормоны щитовидной железы. Их влияние на метаболизм.
- •41. Биохимическая роль вторичных мессенджеров в метаболизме.
- •42.Макроэргические соединения и их роль в метаболизме.
- •43. Дыхательная цепь в митохондриях.
- •44. Последовательность расположения и строение переносчиков электронов в дыхательной цепи.
- •45. Процесс окислительного фосфорилирования, его биологическая роль.
- •47. Механизмы образования свободных радикалов. Антиоксидантные системы в клетках.
- •49. Биохимические механизмы окислительного декарбоксилирования пирувата.
- •50. Механизм реакций и биологическая роль цикла Кребса.
- •53. Глюконеогенез и его биологическая роль.
- •54. Пентозофосфатный путь окисления углеводов.
- •55. Особенности углеводного обмена у жвачных животных. Пути синтеза глюкозы у жвачных животных.
- •62. Синтез триацилглицеридов и фосфолипидов.
- •63. Кетоновые тела и их роль в метаболизме.
- •64. Физико-химические свойства белков. Изоэлектрическое состояние и изоэлектрическая точка аминокислот и белков.
- •65.Биохимические механизмы переваривания белков в жкт.
- •66.Механизмы реакций трансаминирования и дезаминирования аминокислот.
- •67.Декарбоксилирование аминокислот. Биологическая роль продуктов декарбоксилирования.
- •69.Биологические механизмы окисления нуклеотидов
- •70.Строение молекулы днк
- •71. Биохимические механизмы синтеза дн
- •72. Репликация и репарация.
- •73. Строение рнк. Виды рнк. Их роль в метаболизме.
- •74. Биохимические механизмы синтеза рнк.
- •75. Биохимические механизмы синтеза белка.
49. Биохимические механизмы окислительного декарбоксилирования пирувата.
Окисли́тельное декарбоксили́рование пирува́та — биохимический процесс, заключающийся в отщеплении одной молекулы углекислого газа (СО2) от молекулы пирувата и присоединения к декарбоксилированному пирувату кофермента А (СоА) с образованием ацетил-СоА; является промежуточным этапом между гликолизом и циклом трикарбоновых кислот.
Стадия 1 Первый атом углерода (С-1) пирувата уходит в виде СО2, а С-2, в пирувате находящийся в альдегидной форме, прикрепляется к ТРР в виде гидроксиэтильной группы (—СНОН—СН3). Первая стадия является наиболее медленной и поэтому ограничивает скорость всего процесса. Эта реакция осуществляется пируватдегидрогеназой.(E1)
Стадия 2. Гидроксиэтильная группа окисляется до карбоновой кислоты. Два электрона, освобождаемых при этой реакции, идут на восстановление связи —S—S— липоильной группы Е2 до двух тиольных (—SH) групп.
Стадия 3. Ацетильный остаток, образующийся в ходе окислительно-восстановительной реакции на стадии 2, сначала связывается тиоэфирной связью с липоильной —SH-группой, а затем переносится на СоА с образованием ацетил-СоА. Таким образом, энергия окисления идёт на образование высокоэнергетического тиоэфира ацетата. Стадии 2 и 3 катализируются дигидролипоилтрансацетилазой (Е2).
Стадия 4 и стадия 5 катализируются дигидролиполилдегидрогеназой (Е3). В ходе этих двух последних реакций восстановленный липоиллизин снова возвращается в окисленную форму, который снова может участвовать в следующем цикле. Электроны, изначально принадлежавшие гидроксиэтильной группе, при этом переносятся с липоиллизина сначала на FAD с образованием FADH2, а потом на NAD+ с образованием NADH + H+[8].
50. Механизм реакций и биологическая роль цикла Кребса.
Цикл Кребса протекает в митохондриях клеток, где он тесно связан с процессами биологического окисления и окислительного фосфорилирования. Поэтому хотя цикл может «крутиться» и в отсутствии кислорода, практически он зависит от его поступления в ткани. Остановка тканевого дыхания из-за отсутствия кислорода приводит к накоплению восстановленных НАД и ФАД и к остановке цикла.
Цикл Кребса занимает центральное место в метаболизме клетки, так как в нем завершаются процессы полного окисления углеводов, жиров и белков. Так как в этом цикле используется ацетил-КоА образующийся как в процессе распада глюкозы, так и жирных кислот, то между двумя этими метаболитами наблюдается конкуренция за использование цикла Кребса.
Цикл Кребса выполняет не только катаболитическую функцию, но и анаболическую, так как в нем образуется ряд продуктов необходимых для образования важных метаболитов. Например, 2-кетоглутарат и оксалоацетат используются для образования глутамата и аспартата, цитрат -для синтеза внемитохондрального ацетил-КоА, используемого для образования жирных кислот, сукцинил-КоА -для биосинтеза гема и др. Интенсивное использование метаболитов цикла Кребса для процессов биосинтеза может привести к их недостатку для выполнения энергетических функций. Поэтому существует ряд реакций, восполняющих эту убыль. К их числу относятся реакции образования оксалоацетата из пирувата или (особенно у беспозвоночных) из фосфоенолпирувата, образование оксалоацетата и 2-кетоглутарата из аспартата и глутамата и др.
Особенностью цикла Кребса является то, что промежуточные вещества в нем не накапливаются и не расходуются, при отсутствии обмена с остальными метаболическими путями, происходит распад только ацетильных остатков. Если цикл Кребса рассматривать изолирование, то его можно рассматривать, как своеобразный ферментный комплекс катализирующий расщепление ацетил-КоА. Поэтому чтобы ускорить окисление ацетил-КоА нужно ускорить оборот цикла Кребса. Отсюда следует, что для регуляции цикла Кребса один или несколько ферментов должны существовать в двух формах - активной и малоактивной. В цикле Кребса известны 3 таких фермента: цитратсинтаза, НАД-изоцитратдегидрогеназа и 2-оксоглута-ратдегидрогеназа. Активность этих ферментов регулируется KoA-SH и соотношением АТФ, АДФ и фосфатом неорганическим.
цикл Кребса – общий конечный путь окисления ацетильных групп (в виде ацетил-КоА), в которые превращается в процессе катаболизма большая часть органических молекул, играющих роль «клеточного топлива»: углеводов, жирных кислот и аминокислот.
Образовавшийся в результате окислительного декарбоксилирования пирувата в митохондриях ацетил-КоА вступает в цикл Кребса. Данный цикл происходит в матриксе митохондрий и состоит из восьми последовательных реакций .Начинается цикл с присоединения ацетил-КоА к оксалоацетату и образования лимонной кислоты (цитрата). Затем лимонная кислота (шестиуглеродное соединение) путем ряда дегидрирований (отнятие водорода) и двухдекарбоксилирований (отщепление СО2) теряет два углеродных атома и снова в цикле Кребса превращается в оксалоацетат (четырехуглеродное соединение), т.е. в результате полного оборота цикла одна молекула ацетил-КоА сгорает до СО2 и Н2О, а молекула окса-лоацетата регенерируется. Рассмотрим все восемь последовательных реакций (этапов) цикла Кребса.
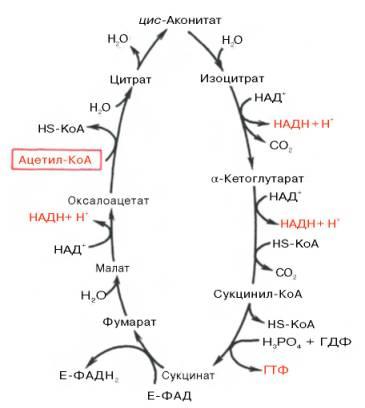
Первая реакция катализируется ферментом цит-рат-синтазой, при этом ацетильная группа ацетил-КоА конденсируется с оксалоацетатом, в результате чего образуется лимонная кислота:
По-видимому, в данной реакции в качестве промежуточного продукта образуется связанный с ферментом цитрил-КоА. Затем последний самопроизвольно и необратимо гидролизуется с образованием цитрата и HS-KoA.
В результате второй реакции образовавшаяся лимонная кислота подвергается дегидратированию с образованием цис-аконитовой кислоты, которая, присоединяя молекулу воды, переходит в изолимонную кислоту (изоцитрат). Катализирует эти обратимые реакции гидратации–дегидратации фермент аконитатгидратаза (аконитаза). В результате происходит взаимоперемещение Н и ОН в молекуле цитрата:
Третья реакция, по-видимому, лимитирует скорость цикла Кребса. Изолимонная кислота дегидрируется в присутствии НАД-зависимой изо-цитратдегидрогеназы.
В ходе изоцитратдегидрогеназной реакции изолимонная кислота одновременно декарбоксилируется. НАД-зависимая изоцитратдегидрогеназа является аллостерическим ферментом, которому в качестве специфического активаторанеобходим АДФ. Кроме того, фермент для проявления своей активности нуждается в ионах Mg2+или Мn2+.
Во время четвертой реакции происходит окислительное декарбокси-лирование α-кетоглутаровой кислоты с образованием высокоэнергетического соединения сукцинил-КоА. Механизм этой реакции сходен с таковым реакцииокислительного декарбоксилирования пирувата до ацетил-КоА, α-кетоглутаратдегидрогеназный комплекс напоминает по своей структуре пируватдегидрогеназный комплекс. Как в одном, так и в другом случае в реакции принимают участие 5 коферментов: ТПФ, амид липоевой кислоты, HS-KoA, ФАД и НАД+.
Пятая реакция катализируется ферментом сукцинил-КоА-синтета-зой. В ходе этой реакции сукцинил-КоА при участии ГТФ и неорганического фосфата превращается в янтарную кислоту (сукцинат). Одновременно происходит образование высокоэргической фосфатной связи ГТФ за счет высокоэргической тиоэфирной связи сукцинил-КоА:
В результате шестой реакции сукцинат дегидрируется в фумаровую кислоту. Окисление сукцината катализируетсясукцинатдегидрогеназой, в молекуле которой с белком прочно (ковалентно) связан кофермент ФАД. В свою очередьсукцинатдегидрогеназа прочно связана с внутренней ми-тохондриальной мембраной:
Седьмая реакция осуществляется под влиянием фермента фума-ратгидратазы (фумаразы). Образовавшаяся при этом фумаровая кислота гидратируется, продуктом реакции является яблочная кислота (малат). Следует отметить, что фумаратгидратаза обладает стереоспецифичностью (см. главу 4) – в ходе реакции образуется L-яблочнаякислота:
Наконец, в ходе восьмой реакции цикла трикарбоновых кислот под влиянием митохондриальной НАД-зависимоймалатдегидрогеназы происходит окисление L-малата в оксалоацетат.
Восьмишаговый циклический процесс окисления простой ацетильной двухуглеродной группы до СO2 может показаться излишне сложным и не отвечающим биологическому принципу максимальной экономии. Однако роль цикла трикарбоновых кислот не исчерпывается окислением ацетат-иона (а значит, и углеводов, жирных кислот и некоторых аминокислот, при окислении которых он образуется). Этот путь составляет сердцевину метаболизма промежуточных соединений. Четырёх- и пятиуглеродные конечные продукты многих катаболических процессов вступают в цикл на промежуточных этапах. Оксалоацетат и α-кетоглутарат, например, являются продуктами катаболизма аспарагиновой и глутаминовой кислот, которые образуются при расщеплении белков. В некоторых метаболических процессах задействованы многие промежуточные соединения цикла, они служат предшественниками во многих анаболических процессах. Таким образом, цикл трикарбоновых кислот является амфиболическим путём, он связывает катаболические и анаболические процессы[23].
Катаболические пути
Пируват является продуктом окисления углеводов. Далее пируват превращается в ацетил-СоА и вовлекается в цикл трикарбоновых кислот. Кроме того, ацетил-СоА является также продуктом окисления жирных кислот, так что цикл трикарбоновых кислот участвует и в катаболизме жиров[24]. Стоит отметить, что пируват может вовлекаться в цикл трикарбоновых кислот и без превращения в ацетил-СоА, а преобразовавшись в малат под действием малат-фермента
Анаболические пути
Из α-кетоглутарата, образующегося в цикле трикарбоновых кислот, синтезируются аминокислоты глутамин, глутамат, пролин и аргинин. Сукцинил-СоА выступает в качестве предшественника при синтезе порфиринов и гема. Цитрат участвует в синтезе жирных кислот[en] и стеролов (из цитрата образуется ацетил-СоА, кроме того, он выступает в роли регулятора[26]). Малат может транспортироваться из митохондрий в цитоплазму, где он обратимо превращается в оксалоацетат. Получившийся оксалоацетат может служить предшественником для синтеза аминокислот аспартата, аспарагина, метионина, треонина и изолейцина, а также пиримидинов. Он может также превратиться в фосфоенолпируват с затратой GTP, а фосфоенолпируват (ФЕП) может служить предшественником в биосинтезе фенилаланина, тирозина,триптофана, серина, глицина и цистеина. Пируват, получающийся из ФЕП в процессе гликолиза, может стать предшественником аланина, лейцина и валина, а также может участвовать в глюконеогенезе[24][25].
Анаплеротические пути
Промежуточные соединения цикла трикарбоновых кислот, покинувшие цикл и задействованные в синтезе различных соединений, замещаются за счёт специальныханаплеротических реакций[en]. В нормальных условиях реакции, в ходе которых промежуточные соединения цикла вовлекаются в другие метаболические пути, и реакции, возмещающие их уход, находятся в динамическом равновесии, поэтому концентрация промежуточных соединений цикла трикарбоновых кислот поддерживается постоянной
51. Биосинтез гликогена.
Тут проще будет изобразить эти реакции схемой.
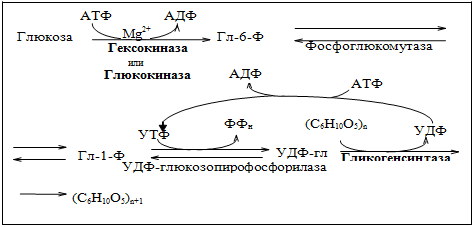
Первая реакция: Глюкоза под действием гексокиназы превращается в Глюкозо-6-фосфат
Вторая реакция: Глюкозо-6-фосфат превращается в Глюкозо-1-фосфат под действием фосфоглюкомутазы
В ходе третьей реакции Глюкозо-1-фосфат взаимодействуем с УТФ с образованием УДФ-глюкозы, фермент – УДФ-глюкозопирофосфорилаза.
И наконец, в ходе четвертой реакции из УДФ-глюкозы образуется гликоген под действием фермента Гликогенсинтазы.
52. Гликолиз и его биологическое значение.
Гликолиз – это цепь последовательных ферментативных реакций, приводящих к превращению глюкозы в пируват с одновременным образованием АТФ.
Первой ферментативной реакцией гликолиза является фосфорилирование, т. е. перенос остатка ортофосфата на глюкозу за счет АТФ. Реакция катализируется ферментом гексокиназой. В результате образуется глюкозо-6-фосфат.
Второй реакцией гликолиза является превращение глюкозо-6-фосфата под действием фермента гексозофосфатизомеразы во фруктозо-6-фосфат.
В третьей реакции образовавшийся фруктозо-6-фосфат вновь фосфорилируется за счет второй молекулы АТФ. Реакция катализируется ферментом фосфофруктокиназой. В результате образуется фруктозо-1,6-дифосфат.
Четвертую реакцию гликолиза катализирует фермент альдолаза. Под влиянием этого фермента фруктозо-1,6-дифосфат расщепляется на две фосфотриозы - (дигидроксиацетонфосфата и глицеральдегид-3-фосфата.
Пятая реакция — реакция изомеризации триозофосфатов. Катализируется эта реакция ферментом триозофосфатизомеразой. В ходе этой реакции дигидроксиацентонфосфат превращается в глицеральдегид-3-фосфат.
В шестой реакции глицеральдегид-3-фосфат в присутствии фермента глицеральдегидфосфатдегидрогеназы, кофермента НАД и неорганического фосфата подвергается своеобразному окислению с образованием 1,3-дифосфоглицериновой кислоты и восстановленной формы НАД (НАДН2).
В седьмой реакции, которая катализируется фосфоглицераткиназой, происходит передача богатой энергией фосфатного остатка (фосфатной группы в положении 1) на АДФ с образованием АТФ и 3-фосфоглицериновой кислоты (3-фосфоглицерата).
В восьмой реакции происходит внутримолекулярный перенос оставшейся фосфатной группы и 3-фосфоглицериновая кислота превращается в 2-фосфоглицериновую кислоту (2-фосфоглицерат).
В девятой реакции 2-фосфоглицериновая кислота в результате отщепления молекулы воды переходит в фосфоенолпировиноградную кислоту (фосфоенолпируват). Реакция катализируется ферментом енолазой.
В десятой реакции происходят разрыв высокоэргической связи и перенос фосфатного остатка от фосфоенолпировиноградной кислоты на АДФ, и образуется пировиноградная кислота. Катализируется эта реакция ферментом пируваткиназой.
В одиннадцатой реакции в результате восстановления пировиноградной кислоты образуется молочная кислота. Реакция протекает при участии фермента лактатдегидрогеназы и кофермента НАДН2+.
Биологическое значение процесса гликолиза прежде всего заключается в образовании богатых энергией фосфорных соединений. В первой стадии гликолиза затрачиваются две молекулы АТФ (гексокиназная и фосфофруктокиназная реакции). Во второй стадии образуются четыре молекулы АТФ (фосфоглицераткиназная и пируваткиназная реакции).
Таким образом, энергетическая эффективность гликолиза составляет две молекулы АТФ на одну молекулу глюкозы.
