
- •Глава 2 Важнейшие классы неорганических соединений
- •2.1. Разделы теоретического курса для повторения
- •2.2. Теоретическая часть.
- •2.2.1. Оксиды
- •Классификация оксидов.
- •Номенклатура оксидов
- •Графическое изображение формул оксидов
- •Физические свойства оксидов
- •Химические свойства оксидов
- •1. Основные оксиды взаимодействуют:
- •2. Кислотные оксиды взаимодействуют:
- •3. Амфотерные оксиды взаимодействуют:
- •2.2.2. Основания
- •Гидроксид натрия катион натрия гидроксид-ион
- •Графическое изображение формул оснований
- •Номенклатура оснований
- •Химические свойства оснований
- •3. Основания взаимодействуют с кислотными оксидами.
- •Амфотерные гидроксиды
- •Способы получения оснований
- •Области применения оснований
- •2.2.3. Кислоты
- •Классификация кислот
- •Многоосновные кислоты
- •Номенклатура кислот
- •Графическое изображение формул кислот
- •Физические свойства кислот
- •Химические свойства кислот
- •Способы получения кислот
- •Области применения кислот
- •2.2.4. Соли
- •Классификация солей
- •Номенклатура солей
- •Наиболее распространенных кислот
- •Графическое изображение формул солей
- •Физические свойства солей
- •Химические свойства солей
- •Способы получения солей
- •Применение солей
- •Генетическая связь между основными классами неорганических соединений
- •Типичный металл,
- •Названия некоторых бинарных соединений
- •2.3. Варианты тестированного контроля знаний
- •Вариант № 3
- •1) Барий, 2) цинк, 4) сера, 8) хром, 16) хлор.
- •1) Оксид натрия, 2) серная кислота, 4) вода, 8) соляная кислота, 16) гидроксид бария 32) гидроксид натрия.
- •1) Соляная кислота, 2) гидроксид калия, 4) оксид кремния (IV),
- •8) Серная кислота, 16) гидроксид бария, 32) вода.
- •1) Синий, 2) желтый, 3) бесцветный, 4) малиновый?
- •1) Синий, 2) желтый, 3) бесцветный, 4) малиновый?
- •1) Синий, 2) желтый, 3) бесцветный, 4) малиновый?
- •1) Добавить раствор хлорида натрия, 2) добавить раствор соляной кислоты, 4) добавить раствор гидроксида калия
- •8) Добавить раствор азотной кислоты?
- •1) Гашеная известь, 2) негашеная известь, 3) натронная известь, 4) каустик, 5) едкий натр.
- •1) Цинк, 2) медь, 4) натрий, 8) серебро, 16) алюминий, 32) золото?
- •1) HBr, 2) hClO4, 4) h2so4 (разбавл.), 8) ch3cooh,
- •16) Hno3 (разбавл.), 32) h2so4 (концентр.).
- •1) Азотная кислота, 2) хлорная кислота, 3) хлорноватая кислота,
- •4) Хлорноватистая кислота, 5) серная кислота?
- •1) Koh (раствор), 2) NaOh (расплав),
- •4) BaO тв. (при нагревании), 8) н2so4, 16) Al2o3.
- •1)Раствор перманганата калия, 2) раствор соляной кислоты,
- •3) Раствор хлорида бария, 4) раствор аммиака,
- •5) Раствор гидроксида натрия?
- •1) Цинк и магний, 2) медь и цинк, 4) железо и медь,
- •8) Ртуть и серебро, 16) натрий и никель.
- •2.5. Ответы на вопросы тестированного контроля знаний по теме « Основные классы неорганических соединений» Вариант № 1
- •Вариант № 2
- •Вариант № 3
2.2.2. Основания
Оcнованиями называются химические вещества, распадающиеся (диссоциирующие) в водном растворе (или в расплаве) на положительно заряженные ионы металла и отрицательно заряженные ионы гидроксила (определение Аррениуса).
Например:
NaOH Na + + OH
Гидроксид натрия катион натрия гидроксид-ион
Основаниями являются сложные вещества, образующиеся при гидратации основных оксидов.
Например:
CaO + H2O = Ca(OH)2 – гидроксид кальция,
BaO + H2O = Ва(ОН)2 – гидроксид бария.
Классификация оснований
По растворимости в воде все основания можно подразделить на растворимые в воде и нерастворимые.
Основания, растворимые в воде, называются щелочами(см. табл. 6 приложения).
Большинство оснований в воде нерастворимы.
Основания различаются по кислотности. Они бывают однокислотными и многокислотными.
Кислотность оснований определяется количеством гидроксильных групп, которые могут быть замещены на кислотные остатки.
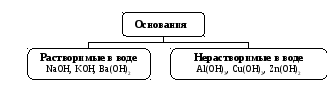

Рис. 2.4. Классификация оснований
Однокислотные основания образуются от одновалентных металлов, а многокислотные основания – от поливалентных металлов.
Например:
LiОН – однокислотное основание,
Са(ОН)2 – двухкислотное основание,
A1(ОН)3 – трехкислотное основание и т.д.
Графическое изображение формул оснований
При графическом изображении формул оснований следует иметь в виду, что число гидроксильных групп определяется валентностью металла и, что атом водорода связан с металлом через атом кислорода:
Например:
![]()
Ca(OH)2 H-O-Ca-O-H
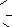 O-H
O-H
Al(OH)3 Al O-H
O-H
Номенклатура оснований
По международной номенклатуре названия оснований складываются из слова «гидроксид», названия металла и, если металл проявляет переменную валентность, то в скобках указывается его валентность.
Например:
КОН – гидроксид калия,
Сu(ОН)2 – гидроксид меди (II),
Fе(ОН)3 – гидроксид железа (III).
Для ряда оснований используются тривиальные названия.
Например:
NaОН – едкий натр, каустическая сода, каустик,
КОН – едкое кали,
Bа(ОН)2 – едкий барий,
Са(ОН)2 – гашеная известь.
Химические свойства оснований
Растворы щелочей – мыльные на ощупь и меняют окраску индикаторов:
а) фиолетовый раствор лакмуса – в синий цвет,
б) бесцветный раствор фенолфталеина – в малиновый цвет.
1. Большинство малорастворимых оснований при нагревании легко разлагаются на оксид и воду.
Например:
Сu(ОН)2
![]() СuО + Н2О,
СuО + Н2О,
Sn(OH)2
![]() SnO + Н2О.
SnO + Н2О.
Основания щелочных металлов термически устойчивы. Так, гидроксид натрия NaОН кипит при Т = 1400 C без разложения.
2. Основания взаимодействуют с кислотами (реакция нейтрализации), образуя соль и воду.
Например:
NaОН + НС1 = NaС1 + Н2О,
Сu(ОН)2 + Н2SO4 = СuSO4 + 2H2O,
Мg(ОН)2 + 2НNO3 = Мg(NO3)2 + 2Н2О.
3. Основания взаимодействуют с кислотными оксидами.
Например:
Са(ОН)2 + СO2 = СаСО3 ↓+ Н2О,
Ва(OH)2 + SO3 = ВаSO4 ↓+ Н2О,
6NaОН + Р2О5 = 2NaЗPO4 + 3H2O.
4. Растворимые в воде основания (щелочи) взаимодействуют с амфотерными оксидами, образуя при сплавлении соответствующие соли.
Например:
Al2O3
+ 2NaOH ![]() NаА1O2
+ Н2О,
NаА1O2
+ Н2О,
ZnO + 2КОН
![]() K2ZnO2
+ H2O.
K2ZnO2
+ H2O.
При взаимодействии амфотерных оксидов с концентрированными растворами щелочей образуются гидроксокомплексы.
ZnO
+ 2КОН + H2O
![]() K2[Zn(OH)4].
K2[Zn(OH)4].
тетрагидроксоцинкат калия
5. Щелочи взаимодействуют с растворами солей, образуя новое основание и новую соль.
Например:
2NaОН + СuSО4 = Сu(ОH)2 ↓+ Na2SО4,
ЗNH4ОН + АlСl3 = А1(ОН)3 ↓+ 3NH4Cl,
2КОН + МnС12 = Мn(ОН)2 ↓+ 2КС.
