
- •Глава 2 Важнейшие классы неорганических соединений
- •2.1. Разделы теоретического курса для повторения
- •2.2. Теоретическая часть.
- •2.2.1. Оксиды
- •Классификация оксидов.
- •Номенклатура оксидов
- •Графическое изображение формул оксидов
- •Физические свойства оксидов
- •Химические свойства оксидов
- •1. Основные оксиды взаимодействуют:
- •2. Кислотные оксиды взаимодействуют:
- •3. Амфотерные оксиды взаимодействуют:
- •2.2.2. Основания
- •Гидроксид натрия катион натрия гидроксид-ион
- •Графическое изображение формул оснований
- •Номенклатура оснований
- •Химические свойства оснований
- •3. Основания взаимодействуют с кислотными оксидами.
- •Амфотерные гидроксиды
- •Способы получения оснований
- •Области применения оснований
- •2.2.3. Кислоты
- •Классификация кислот
- •Многоосновные кислоты
- •Номенклатура кислот
- •Графическое изображение формул кислот
- •Физические свойства кислот
- •Химические свойства кислот
- •Способы получения кислот
- •Области применения кислот
- •2.2.4. Соли
- •Классификация солей
- •Номенклатура солей
- •Наиболее распространенных кислот
- •Графическое изображение формул солей
- •Физические свойства солей
- •Химические свойства солей
- •Способы получения солей
- •Применение солей
- •Генетическая связь между основными классами неорганических соединений
- •Типичный металл,
- •Названия некоторых бинарных соединений
- •2.3. Варианты тестированного контроля знаний
- •Вариант № 3
- •1) Барий, 2) цинк, 4) сера, 8) хром, 16) хлор.
- •1) Оксид натрия, 2) серная кислота, 4) вода, 8) соляная кислота, 16) гидроксид бария 32) гидроксид натрия.
- •1) Соляная кислота, 2) гидроксид калия, 4) оксид кремния (IV),
- •8) Серная кислота, 16) гидроксид бария, 32) вода.
- •1) Синий, 2) желтый, 3) бесцветный, 4) малиновый?
- •1) Синий, 2) желтый, 3) бесцветный, 4) малиновый?
- •1) Синий, 2) желтый, 3) бесцветный, 4) малиновый?
- •1) Добавить раствор хлорида натрия, 2) добавить раствор соляной кислоты, 4) добавить раствор гидроксида калия
- •8) Добавить раствор азотной кислоты?
- •1) Гашеная известь, 2) негашеная известь, 3) натронная известь, 4) каустик, 5) едкий натр.
- •1) Цинк, 2) медь, 4) натрий, 8) серебро, 16) алюминий, 32) золото?
- •1) HBr, 2) hClO4, 4) h2so4 (разбавл.), 8) ch3cooh,
- •16) Hno3 (разбавл.), 32) h2so4 (концентр.).
- •1) Азотная кислота, 2) хлорная кислота, 3) хлорноватая кислота,
- •4) Хлорноватистая кислота, 5) серная кислота?
- •1) Koh (раствор), 2) NaOh (расплав),
- •4) BaO тв. (при нагревании), 8) н2so4, 16) Al2o3.
- •1)Раствор перманганата калия, 2) раствор соляной кислоты,
- •3) Раствор хлорида бария, 4) раствор аммиака,
- •5) Раствор гидроксида натрия?
- •1) Цинк и магний, 2) медь и цинк, 4) железо и медь,
- •8) Ртуть и серебро, 16) натрий и никель.
- •2.5. Ответы на вопросы тестированного контроля знаний по теме « Основные классы неорганических соединений» Вариант № 1
- •Вариант № 2
- •Вариант № 3
Графическое изображение формул кислот
В бескислородных кислотах атомы водорода непосредственно связаны с атомом неметалла.
Например:
HCl H2S HBr
 H
– Cl H H - Br
H
– Cl H H - Br
S
H
В кислородсодержащих кислотах атомы водорода, определяющие основность кислоты, связаны с атомом кислотообразующего элемента через атом кислорода. Атомы кислорода, не связанные с водородом, соединены c атомом кислотообразующего элемента кратными связями или же образуют кислородные мостики.
Например:
![]()
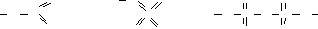 O H O O O
O
O H O O O
O
H

 O N S H O
Cr O Cr O H
O N S H O
Cr O Cr O H
O H O O O O
Физические свойства кислот
Большинство кислот представляют собой жидкости (Н2SО4, НNО3 и др.) или твердые вещества (H3PO4, H2SiO3, H3BO3). Растворимые в воде кислоты придают раствору кислый вкус (за счет свободных ионов водорода), разъедают растительные и животные ткани, окрашивают индикаторы (лакмус, метилоранж и метилрот) в красный цвет.
Химические свойства кислот
1. Кислоты взаимодействуют с основаниями (реакция нейтрализации), образуя соль и воду.
Например:
H2SO4 + 2КОН = K2SO4 + 2Н2О,
2НNО3 + Мg(ОН)2 = Мg(NO3)2 + 2Н2О.
2. Кислоты взаимодействуют с основными и амфотерными оксидами, образуя соль и воду.
Например:
Н2SО4 + СuO = СuSO4 + Н2О,
6НС1 + Al2O3 = 2AlCl3 + ЗН2О.
3. Кислоты могут взаимодействовать с солями более слабых или более летучих кислот, образуя новую соль и новую кислоту.
Например:
2НС1 + K2CO3= 2КС1 + H2CO3 (H2O + CO2),
Н2SО4 + 2NаС1 = Na2SO4 + 2НС1↑
В первой реакции сильная хлороводородная кислота (НСl) вытесняет более слабую угольную кислоту (Н2СО3), а во второй реакции сильная и нелетучая серная кислота (Н2SО4) вытесняет тоже сильную, но более летучую хлороводородную кислоту.
4. Кислоты реагируют с активными металлами с образованием соли и водорода.
Например:
2HCl + Мg = MgCl2 + Н2↑,
Са + 2СН3СООН = Са(СН3СОО)2 + Н2↑.
Так реакции будут протекать с любой растворимой в воде и не проявляющей специфического окислительного действия кислотой.
При реакциях металлов с кислотами окислителями, например, Н2SO4 (концентрированный раствор) или HNO3 (раствор любой концентрации) водород практически не выделяется.
Например:
Cu + 2H2SO4(конц.)= CuSO4+ SO2↑ + 2H2O,
8HNO3 (конц.)+ 3Мg = 3Mg(NO3)2+ 2NO↑ + 4H2O.
Такие реакции специфичны и рассматриваются в теме «Окислительно-восстановительные реакции» (см. главу 10).
Способы получения кислот
1. Бескислородные кислоты могут быть получены непосредственным синтезом из элементов, с последующим растворением полученного соединения в воде.
Например:
Н2 + С12 = 2НС1,
Н2 + S = H2S.
2. Кислородсодержащие кислоты могут быть получены взаимодействием некоторых кислотных оксидов (ангидридов кислот) с водой.
Например:
SO3 + H2O = Н2SО4,
N2O5 + Н2О = 2HNO3.
3. Как бескислородные, так и кислородсодержащие кислоты можно получить по реакции обмена между солями и кислотами.
Например:
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3↓,
AgNO3 + HCl = AgCl↓ + НNO3,
FeS + 2HCI = FeCl2 + H2S↑,
CuSO4 + H2S = CuS↓ + H2SO4.
