- •Введение
- •1 Бинарные соединения рения
- •1.1 Оксиды
- •Галогениды рения
- •Сульфиды и селениды рения
- •Нитриды, силициды, фосфиды, арсениды, карбиды, бориды рения
- •Рениевая кислота и ее соли
- •Комплексные соединения рения
- •Галогенидные комплексы
- •Фторидные комплексные соединения рения
- •Хлоридные комплексные соединения рения
- •Бромидные комплексные соединения рения
- •Йодидные комплексные соединения рения
- •Цианидные комплексные соединения рения
- •Роданидные комплексные соединения рения
- •Комплексные соединения рения с оксикислотами
- •Комплексные соединения рения с аминами
- •Комплексные соединения рения с тиомочевинной и ее производными
- •Комплексные соединения рения с третичными фосфинами и арсинами
- •Металлорганические соединения рения
- •Заключение
- •Литература
Нитриды, силициды, фосфиды, арсениды, карбиды, бориды рения
Порошкообразный рений при достаточно сильном нагревании реагирует с кремнием, фосфором, углеродом, бором и другими элементами; при этом образуются соответственно силициды, фосфиды, бориды, арсениды, карбиды.
Нитрид рения составом ReN0,43 был получен восстановлением NH4ReO4 или ReCl3 аммиаком.
Силициды рения образуются при спекании металлического рения и кремния в тиглях из углерода или BeO. Получен ряд силицидов: ReSi, Re3Si, Re2Si, ReSi2. Наибольшее значение имеет дисилицид, который обладает полупроводниковыми свойствами.
Рений взаимодействует с фосфором при температурах выше 750-800° С с образованием ReP3, ReP2 и монофосфидов ReP и Re2P.
Долгое время считалось, что рений не образует карбидов в отличие от таких элементов, как молибден, вольфрам, тантал, ниобий, и проявляет аналогию с платиновыми элементами. Однако удалось синтезировать монокарбид ReC в условиях высокой температуры.
Рениевая кислота и ее соли
Рениевая кислота и ее соли – перренаты – являются важными соединениями семивалентного рения. В виде HReO4 и растворимых перренатов рений находится в естественных и промышленных водах, которые являются сырьевыми источниками получения рения. Перевод рения из малорастворимых соединений, таких, как ReO и ReS2, в раствор осуществляется кислотным разложением или щелочным сплавлением с образованием растворимых перренатов или рениевой кислоты. И наоборот, извлечение рения из растворов проводят осаждением его в виде малорастворимых перренатов калия, цезия, таллия и др. Большое промышленное значение имеет перренат аммония, из которого посредством восстановления водородом получают металлический рений. Ряд перренатов с органическими и комплексными катионами используют в аналитической химии рения при определении его весовыми или экстракционно-фотометрическими методами. Собственное светопоглощение перренат-иона использовано для его определения спектрометрическим методом.
Кроме того,
большинство экстракционных и
хроматографических методов отделения
рения от других элементов основано на
свойстве Re
(VII)
образовывать анион
![]()
Рениевая кислота получается при растворении Re2O7 в воде:
Re2O7 + H2O = 2HReO4.
Растворы рениевой кислоты получены также растворением металлического рения в перекиси водорода, бромной воде и азотной кислоте. Избыток перекиси удаляют кипячением. Рениевая кислота получается при окислении низших оксидов и сульфидов, из перренатов с использованием ионного обмена и электродиализа. Для удобства в таблице 2 приведены значения плотностей растворов рениевой кислоты.
Таблица 2 – Значения плотностей растворов рениевой кислоты в воде
|
Плотность,
г/ |
HReO4, г/л |
Плотность,
г/ |
HReO4, г/л |
Плотность,
г/ |
HReO4, г/л |
Плотность,
г/ |
HReO4, г/л |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
1,025 |
30 |
1,25 |
305 |
1,55 |
670 |
1,85 |
1040 |
|
1,05 |
60 |
1,30 |
370 |
1,60 |
735 |
1,90 |
1160 |
|
1,075 |
90 |
1,35 |
480 |
1,65 |
795 |
2,00 |
1220 |
|
1,10 |
120 |
1,40 |
490 |
1,70 |
755 |
2,05 |
1280 |
|
1,15 |
180 |
1,46 |
560 |
1,75 |
920 |
2,10 |
1340 |
|
1,20 |
240 |
1,50 |
610 |
1,80 |
980 |
2,15 |
1400 |
Рениевую кислоту можно титровать щелочами с обычными индикаторами, например фенолфталеином. Раствор кислоты с концентрацией свыше 60% имеет желто-зеленую окраску и трудно титруется.
Рениевая кислота устойчива. В отличие от хлорной и марганцевой кислот обладает очень слабыми окислительными свойствами. Восстановление ее проходит обычно медленно. В качестве восстановителей используются амальгамы металлов, химические агенты.
Перренаты менее растворимы и термически более устойчивы, чем соответствующие перхлораты и перманганаты.
В таблице 3 приведены некоторые свойства перренатов.
Таблица 3 – Свойства перренатов
|
Соединение |
Т пл., °С |
Плотность,
г/ |
Растворимость, г-моль/100г H2O | ||
|
0°C |
30°C |
50°C | |||
|
1 |
2 |
3 |
4 |
5 |
6 |
|
LiReO4 |
436 |
4,61 |
- |
- |
- |
|
NaReO4 |
414 |
5,24 |
0,378 |
0,532 |
0,636 |
|
KReO4 |
555 |
4,38 |
|
|
|
|
NH4ReO4 |
Разлагается |
3,55 |
|
|
|
|
RbReO4 |
598 |
4,73 |
|
|
|
|
CsReO4 |
616 |
4,76 |
|
|
|
|
Растворимость, г/100 г H2O | |||||
|
Mg(ReO4)2 |
930 |
5,01 |
- |
283,6 |
- |
|
Ca(ReO4)2 |
934 |
4,94 |
- |
187 |
- |
|
Sr(ReO4)2 |
884 |
4,95 |
- |
110,1 |
- |
|
Ba(ReO4)2 |
799 |
5,91 |
1,52 |
8,13 |
21,51 |
|
Zn(ReO4)2 |
701 |
5,46 |
- |
313,6 |
- |
|
Cd(ReO4)2 |
624 |
5,99 |
- |
497,5 |
- |
|
Hg(ReO4)2 |
431 |
6,95 |
- |
- |
- |
|
Cu(ReO4)2 |
- |
- |
- |
210,4 |
- |
|
Pb(ReO4)2 |
562 |
6,93 |
4,14 |
14,81 |
29,63 |
|
AgReO4 |
455 |
6,96 |
0,43 |
1,39 |
2,71 |
|
TlReO4 |
525 |
6,89 |
1,115 |
0,298 |
0,555 |
|
Co(ReO4)2 |
816 |
5,33 |
- |
299 |
|
|
Hg2(ReO4)2 |
561 |
7,23 |
- |
- |
- |
|
Ni(ReO4)2 |
- |
- |
- |
310 |
- |
|
Mn(ReO4)2 |
861 |
5,12 |
- |
340 |
- |
|
Fe(ReO4)2 |
- |
- |
- |
233 |
- |
|
(ReO4)3 |
- |
- |
- |
270 |
- |
Наименьшей растворимостью обладают перренаты таллия, цезия, рубидия и калия.
Важнейшими и наиболее устойчивыми солями кислородных кислот рения являются соли рениевой кислоты – перренаты. Перренаты щелочных металлов, аммония, серебра, таллия кристаллизуются из растворов в безводном состоянии; перренаты щелочноземельных металлов, цинка кадмия, свинца образуют кристаллогидраты с 2 или 4 молекулами воды, перренаты редкоземельных металлов – с 4, а также с 1 или 2, перренат алюминия – с 1,3 или 7 молекулами воды.
Перренаты Tl,
Rb,
Cs,
K,
Ag
– малорастворимые вещества, перренаты
![]() ,Ba,
Pb
(II)
обладают средней растворимостью,
перренаты Mg,
Ca,
Cu,
Zn,
Cd
и т.п. очень хорошо растворяются в воде.
В составе перренатов калия и аммония
рений выделяется из промышленных
растворов.
,Ba,
Pb
(II)
обладают средней растворимостью,
перренаты Mg,
Ca,
Cu,
Zn,
Cd
и т.п. очень хорошо растворяются в воде.
В составе перренатов калия и аммония
рений выделяется из промышленных
растворов.
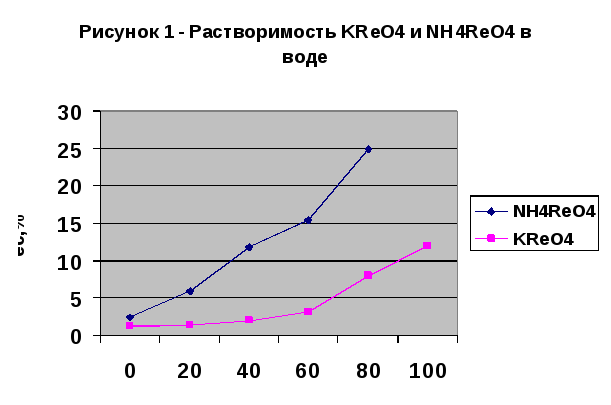
Перренат калия KReO4 – мелкие бесцветные гексагональные кристаллы. Плавится без разложения при 555°, при более высокой температуре улетучивается, частично диссоциируя. Температура кипения KReO4 1370°. Растворимость его в воде представлена на рисунке 1. Растворимость соли в водном растворе рениевой кислоты выше, чем в воде, тогда как в присутствии H2SO4 она практически не меняется.
Перренат аммония NH4ReO4 получается при нейтрализации рениевой кислоты аммиаком. Сравнительно хорошо растворяется в воде. При кристаллизации из растворов образует с KReO4 непрерывные твердые растворы. При нагревании на воздухе разлагается, начиная с 200°, давая возгон, содержащий Re2O7 и черный остаток ReO2. При разложении в инертной атмосфере образуется только оксид рения (IV) по реакции:
2NH4ReO4 = 2ReO2 + N2 + 4H2O.
При восстановлении соли водородом получается металл.
Из солей рениевой кислоты с органическими основаниями отметим перренат нитрона C20H17N4ReО4, обладающий очень малой растворимостью в ацетатных растворах, особенно в присутствии избытка ацетата нитрона. Образование этой соли используется для количественного определения рения.
Кроме перренатов
описанного состава (метаперренатов)
существуют мезоперренаты типа
![]() и ортоперренаты типа
и ортоперренаты типа![]() .
Это желтые или красные соединения. Могут
быть получены сухим путем (или в сильно
щелочной среде); легко разлагаются
водой.
.
Это желтые или красные соединения. Могут
быть получены сухим путем (или в сильно
щелочной среде); легко разлагаются
водой.
Производные оксида
рения (III)
– так называемые ренаты типа
![]() - зеленые, являются одними из продуктов
сплавления порошка рения со щелочью.
При растворении в воде диспропорционируют:
- зеленые, являются одними из продуктов
сплавления порошка рения со щелочью.
При растворении в воде диспропорционируют:
2K2ReO4 + 2H2O = 2KReO4 + ReO2 + 4KOH.
Кроме того, описаны
соли, отвечающие пятивалентному рению
(гипоренаты) желтого цвета, и коричневые
рениты
![]() - производныеRe
(IV).
Все они разлагаются водой. Синтезированы
некоторые сложные соединения со смешанной
валентностью рения, например соль
La4Re6O19
с кластерным строением. Синтезированы
рениевые бронзы типа
- производныеRe
(IV).
Все они разлагаются водой. Синтезированы
некоторые сложные соединения со смешанной
валентностью рения, например соль
La4Re6O19
с кластерным строением. Синтезированы
рениевые бронзы типа
![]() .
.