
Сера (8 из Химии Элементов)
.docxБИЛЕТ №14 (химия элементов)
Сера, общая характеристика; физ. и хим. активность. Сероводород, сульфиды, КО и ОВ характеристика. Оксиды серы и их гидроксиды. ОВ и КО характеристика.
Сера – твердое, хрупкое желтое вещество; молекула содержит 8 атомов (S8) и имеет циклическую форму. Пары серы состоят из молекул, состав которых может быть S8, S6, S4, S2. При температуре больше 1200C в основном состоят из димерных молекул.
Сера способна изменяться при плавлении:
-
При температуре около 120 - сера плавится, образуя жидкость винтарного цвета;
-
При температуре 160 - цвет меняется на красно-коричневый, вязкость растет, достигая максимума при температуре 200. Сера настолько вязка при данной температуре, что её невозможно вылить из сосуда, в котором плавится.
Полагают, что по мере нагревания разрываются кольца S8 и образуются цепеобразные полимерные молекулы.
Сера в соединениях проявляет устойчивую степень окисления -2, +4, +6. В химическом плане довольно активна. Со многими простыми веществами и некоторыми соединениями сера реагирует непосредственно или в присутствии катализатора.
Например, ртуть вступает в реакцию с серой при небольшом растирании в ступке.
Активно реагируют с серой металлы (цинк, железо), при этом образуются сульфиды металлов.
-
Zn + S = ZnS
С водородом сера образует сероводород H2S – очень токсичное соединение с запахом тухлых яиц.
H2S можно получить при непосредственном взаимодействии H2 с S или при взаимодействии сульфидов в сильными кислотами.
-
H2 + S = H2S
-
FeS + 2HCl = H2S + FeCl2
H2S хорошо растворим в воде с образованием очень слабой сероводородной кислоты того же состава, которая являясь двухосновной кислотой, диссоциирует в 2 ступени, образуя 2 вида солей:
HS- - гидросульфиды и S2- - сульфиды;
Сероводород и его кислота в ОВР всегда проявляют свойства восстановителя, т.к. сера находится в низшей степени окисления.
H2S + HNO3 = SO2 + NO2 + H2O
Многие сульфиды не растворимы в воде, при этом образуются осадки разных цветов:
-
PbS – черный цвет;
-
CdS – телесного цвета;
Это позволяет использовать реакцию образования сульфидов в аналитической химии для качественных определений.
H2S горит и окисляется под действием катализатора:
-
2H2S + O2 = 2S + 2 H2О (под действием температуры);
-
2H2S + 3O2 = 2SO2 + 2H2O (под действием температуры и катализатора).
Сера образует 2 устойчивых оксида SO2 и SO3. Оба типичные кислотные; хорошо растворимы в воде с образованием соответствующих кислот: H2SO3 и H2SO4.
SO2 + H2O = H2SO3 – слабая;
SO3 + H2O = H2SO4 – сильная;
Оба этих оксида проявляют общие свойства кислотных оксидов.
В ОВР оксид серы (IV) проявляет О-В двойственность, т.к. сера находится в промежуточной степени окисления.
-
2SO2 + O2 = 2SO3 S+4 - 2
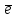
S+6
S+6 -
SO2 + H2S = 3S + H2O S+4 + 4
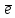
S0
S0
SO3 в ОВР проявляет только окислительные свойства, т.к. сера находится в высшей степени окисления.
5SO3 + 2NH3 + 2H2O = 5H2SO3 + 2NO
S+6
+ 2
S+4
2 5 – окислитель/восстановитель
S+4
2 5 – окислитель/восстановитель
N-3
- 5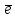
N+2
5
2
N+2
5
2
SO3 способен взаимодействовать с некоторыми кислотами (например, соляная) с образованием хлорсульфоновой кислоты.
SO3 + HCl = HSO3Cl – в водном растворе неустойчивая, гидролизуется до HCl и H2SO4.
HSO3Cl + Н2О = HCl + H2SO4
SO2 – ему соответствует H2SO3, которая проявляет все свойства кислот (+Ме до Н; основание; основные оксиды; соли).
В ОВР H2SO3 проявляет О-В двойственность:
2H2SO3
+ О2
= 2H2SO4
S+4
- 2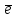
S+6
S+6
H2SO3
+ H2S
= H2О
+ S S+4
+ 4
S0
S0
SO3 – ему соответствует H2SO4 – проявляет все общие свойства кислот.
Особенностью H2SO4 является то, что в зависимости от степени разбавленности она по-разному реагирует с металлами:
-
Разбавленная H2SO4 – с металлами до Н с выделением H2;
-
Концентрированная H2SO4 – с любыми металлами до и после Н, но H2 никогда не выделяется. Может образоваться SO2, S, H2S.
Cu + H2SO4(разб) – не идёт
Cu + 2H2SO4(конц) - CuSO4 + SO2 + 2H2О
Концентрированная H2SO4 является очень сильным водоотнимающим средством, поглощение воды связано с образованием гидратов.
Например: H2SO4 * H2О; H2SO4 * 2H2О и т.д.
Оксид серы (IV) способен растворяться в концентрированной H2SO4 с образованием олеума, а из олеума можно получить кристаллы пиросерной кислоты H2S2O7, соли которой называются пиросульфатами.
Кроме этого известна надсерная кислота H2S2O8, соли которой персульфаты.
При действии на надсерную кислоту перекисью водорода получается мононадсерная кислота H2SО5 – очень сильный окислитель.
H2SО4, являясь двухосновной, образует 2 вида солей: сульфаты (SО42-) и гидросульфаты (НSО4-).
Биологическая роль.
Сера входит в состав АК:
-
цистеин;
-
цистин;
-
метионин;
+ глутатион;
Она играет важную роль в формировании третичной структуры белка, т.к. образует дисульфидные мостики.
