
- •Механика, молекулярная физика и термодинамика Учебное пособие Омск 2003
- •Введение
- •Содержание теоретического курса Введение
- •Реальные газы
- •I. Механика и элементы специальной теории относительности
- •Третий закон Ньютона: Силы, с которыми действуют друг на друга взаимодействующие тела, равны по величине и противоположны по направлению.
- •; .
- •Пусть в начальный момент времени начала координат обеих систем и направления соответствующих осей совпадают.
- •Тогда: . Здесь - скорость света в вакууме.
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •Контрольное задание №1
- •II. Основы молекулярной физики и термодинамики
- •Примеры решения задач
- •Для расчета средней квадратичной скорости выражение (1) удобно преобразовать, умножив числитель и знаменатель на na.
- •6,510-8 М.
- •1,210-5 .
- •На основании первого начала термодинамики
- •Так как координаты точек в и с удовлетворяют адиабате вс, то
- •Задачи, рекомендуемые для самостоятельного решения
- •Контрольное задание №2
- •Список литературы
- •Содержание Введение …………………………3
Примеры решения задач
Задача 1 Смесь азота и гелия при температуре 27 0С находится под давлением р=1,3102 Па. Масса азота составляет 70 % от общей массы смеси. Найти концентрацию молекул каждого из газов.
|
T = 300 К p = 1,3102Па M1 = 0,7 M |
Решение При данном давлении газ можно считать идеальным. Согласно основному уравнению молекулярно-кинетической теории: р=nkT, откуда n=p/kT. С одной стороны, масса каждого из газов: M1=c1M, (1) |
|
n1 - ? n2 - ? |
M2=c2M,
где M - масса смеси;
с1 и с2 – процентное содержание азота и гелия.
С другой стороны, масса каждого из газов:
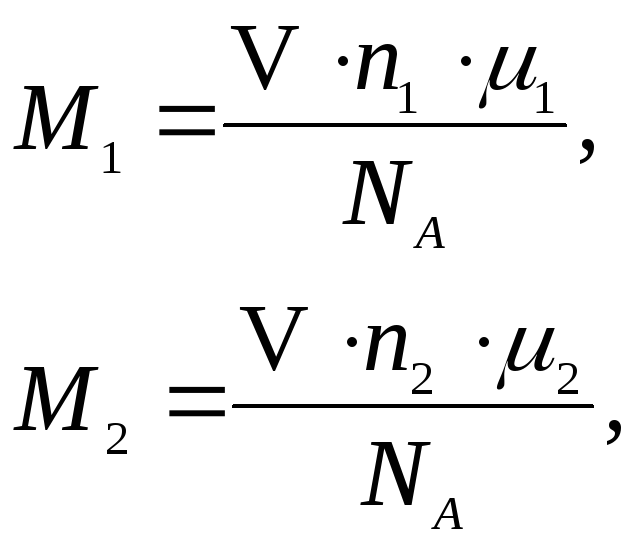 (2)
(2)
где V – объем газа;
- молярная масса газа;
i/NА – масса молекулы.
Приравнивая правые части уравнений (1) и (2), получим:
c1M=![]() ;
c2M=
;
c2M=![]() ;
;
откуда
n1/n2=![]() =1/3.
Так как n1+n2=n,
=1/3.
Так как n1+n2=n,
то
n1=![]() =0,81022
м-3, n2=
=0,81022
м-3, n2=![]() =2,41022
м-3.
=2,41022
м-3.
Ответ:
n1=![]() =0,81022
м-3, n2=
=0,81022
м-3, n2=![]() =2,41022
м-3.
=2,41022
м-3.
Задача 2 Найти среднюю квадратичную скорость, среднюю кинетическую энергию поступательного движения и среднюю полную кинетическую энергию молекул азота и гелия при температуре 27 0С. Определить полную энергию всех молекул 100 г каждого из газов.
|
T = 300 К M1 = 0,1 кг Не = 410-3 кг/моль N2 = 2810-3 кг/моль |
Решение Средняя кинетическая энергия поступательного движения одной молекулы идеального газа определяется как <Е>= <E>=6,210-21 Дж, причем средние энергии поступательного движения одной молекулы азота и гелия одинаковы. Средняя квадратичная скорость молекул газа зависит от массы его молекул:
|
|
<кв> - ? E - ? W - ? |
<кв>=![]() . (1)
. (1)
Для расчета средней квадратичной скорости выражение (1) удобно преобразовать, умножив числитель и знаменатель на na.
<кв>=![]() ;
;
<кв>=13,7102 м/с – для гелия;
<кв>=5,17102 м/с – для азота.
Средняя полная энергия молекулы зависит от числа степеней свободы молекулы:
<E0>=![]() .
.
Полная кинетическая энергия всех молекул, равная для идеального газа его внутренней энергии, может быть найдена как произведение Е0 на число всех молекул:
Е=U=Е0N;
N=![]() .
.
Гелий – одноатомный газ i=3, тогда <E0>=6,210-21 Дж.
Азот – двухатомный газ i=5, тогда <E0>=10,410-21 Дж.
Полная энергия всех молекул
Е=![]() .
.
Для гелия W=93,5103 Дж; для азота W=22,3103 Дж.
Ответ: для гелия W=93,5103 Дж; для азота W=22,3103 Дж
Задача 3 Рассчитать среднюю длину свободного пробега молекул азота, коэффициент диффузии и вязкость при давлении р=105 Па и температуре 17 0С. Как изменятся найденные величины в результате двукратного увеличения объема газа: 1) при постоянном давлении; 2) при постоянной температуре? Эффективный диаметр молекул азота d=3,710-8см.
|
p = 105 Па T = 300К V2 = 2V1
d = 3,710-10 м |
Решение Средняя длина свободного пробега и коэффициенты переноса могут быть рассчитаны по следующим формулам:
где n – концентрация молекул газа; <> - средняя скорость молекулы; m0 – масса одной молекулы; |
|
- ? D - ? - ? |
Концентрацию молекул можно определить из уравнения p=nkT:
n=p/kT подставим в уравнение (1):
