
- •Письменная консультация по теме:
- •1.1. Простое вещество (н2, f2, Cl2, Br2, i2)
- •1.2. Сложное вещество (hf, hCl, hBr, hi)
- •2. Трехатомные молекулы (4а подгруппа – SiCl2, PbBr2… и 6a подгруппа - н2s, н2Se…)
- •3. Четырехатомные молекулы (5а подгруппа –SbН3, pСl3, pн3, …)
- •4. С гибридизацией ао
- •4.4. В гибридизации участвуют не только ао связывающих электронов, но и ао неподеленных электронных пар (нп)
- •Взаимодействия между частицами вещества
- •Донорно-акцепторное взаимодействие молекул
- •Водородная межмолекулярная связь
- •Свойства твердых тел
- •Виды кристаллов и их свойства.
- •1. Молекулярный.
- •2. Ионный
- •3. Атомно-ковалентный
- •4. Металлический
- •Характеристики некоторых веществ в твердом кристаллическом состоянии
- •Типы кристаллических решеток
Письменная консультация по теме:
«Химическая связь»
Ковалентная связь - химическая связь, образованная путем обобществления пары электронов двумя атомами.
Виды ковалентной связи:
σ-связь (сигма)-образуется перекрыванием АО по линии, соединяющей ядра взаимодействующих атомов (любые АО)
π-связь (пи)- образуется перекрыванием АОнад и под воображаемой линией, соединяющей ядра взаимодействующих атомов (р-р,d-р,d-d,f-p,f-d,f-fАО)
δ-связь (дельта)- образуется перекрываниемd-орбиталей, лежащихв параллельных плоскостях (при наложении друг на друга и перекрывании всеми четырьмя лепесткамиd-облаков в 4-х областях)
Прочность связи уменьшается: >>, т.к. уменьшается степень перекрывания.
Существует два квантовомеханических подхода к описанию ковалентной связи:
Метод молекулярных орбиталей (МО) (образование химической связи – это результат перехода ē с АО на молекулярную (МО), охватывающую все атомы)
Метод валентных связей (ВС)
В рамках метода валентных связей (ВС) химическая связь рассматривается как локализованная, двухцентровая, двухэлектронная связь. Каждый из двух атомов предоставляет для формирования связи по одной атомной орбитали (АО), который перекрываются и в области связывания появляются два электрона с антипараллельными спинами. Связывающие электронные пары (СП) могут образовываться по обменному или донорно-акцепторному механизму
Механизмы образования ковалентной связи по методу ВС
Обменный(по одному электрону от каждого атома) – связь образуется за счет перекрывания АО, имеющих по одному неспаренному валентному электрону
Донорно-акцепторный- образование общей электронной пары за счет неподеленной пары электронов одного атома (донора) и вакантной орбитали другого атома (акцептора).
Особенности ковалентной связи:
Насыщаемость (образование атомами ограниченного число связей - образование общей пары е насыщает одну и другую орбитали). По принципу Паули запрещается использование дважды одной и той же АО для образования связи.Формирует состав молекул.
Направленность(перекрывание АО по определенным направлениям) – АО пространственно ориентированы вокруг ядра атома, поэтому их перекрывание происходит по определенным направлениям. Количественно выражается величиной валентных углов между направлениями химических связей. (Валентный угол - это угол между воображаемыми прямыми, проходящими через ядра химически связанных атомов).Формирует пространственную структуру молекул.
Полярность - общая пара е смещается в сторону атома с большей ЭО, образуется диполь.
Валентность -способность атома образовывать определенное число химических связей. Валентностьпо обменному механизмуравначислу внешних неспаренных электронов в атоме. Различают валентность восновном (В) ивозбужденном(В*) состоянии атома.
Кислород, азот и фтор – возбужденного состояния нет (нет 2d-подуровня)
Распаривание электронов возможно только в пределах одного энергетического уровня.
Хлор Cl – аналог фтора – валентности: В=1, В*= 3, 5, 7 - вследствие наличия свободныхd-орбиталей на третьем энергетическом уровне:
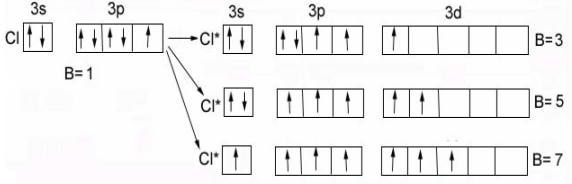
Cо…3d74s2 В0= 0 – нет внешних неспаренных электронов в основном состоянии
![]()
В возбужденном
состоянии:
![]()
ВЫВОД: Для большинства d-элементоввалентность восновномсостоянии равна 0, т.к. на внешнем уровне нет неспаренных электронов. При переходе ввозбужденное состояниеs-электроны распариваются,валентность возрастает. При этом кроме внешних валентными становятся неспаренныеd-электроны предвнешнего подуровня.
Характеристика ковалентной связи:
Неполярная ковалентная связь– в молекулах простых веществ:Н2, О2, N2, Cl2, и др., связывающая электронная пара равномерно распределена между атомами (∆ЭО = 0 и µсв=0) Связь образована атомами одного элемента (простое вещество) - ∆ЭО = 0:N2, Н2, О2и т.д.
Полярная ковалентная связь– в молекулах сложных веществ связывающая электронная пара смещена к атому с большей ЭО, например:HClЭО(Н) = 2,1 ˂ ЭО(Cl) = 3 (∆ЭО≠0 µсв≠0), электронная пара смещена к атому хлора и на нем возникаетэффективный отрицательный заряд–q, а у атома Н -эффективный положительный заряд+q.
В результате образуется электрический диполь – система из двух равных и противоположных по знаку зарядов.
Длина диполя lд - расстояние между центрами тяжести эффективных зарядов (δ-и δ+)
Электрический момент диполя связи(количественная мера полярности) µсв=q∙ lд (Кл∙м)
µсв-вектор, направленный к отрицательному полюсу. При ↑ ∆ЭО q ↑ и µсв↑
Чем больше ЭО, тем большесви, следовательно, связь более полярная
Полярность молекулыопределяется геометрической структурой молекулы и полярностью связей, их числом и направленностью и характеризуется значениемµм - электрического момента диполя молекулы, µм = ∑ µсв. Векторную сумму определяют сложением векторов µсвпо правилу параллелограмма сил. Чем ↑ µм, тем полярнее молекула.
Молекула неполярная ∑ µсв= 0 Молекула полярная ∑ µсв≠ 0
Двухатомные молекулы имеют линейную структуру, в простом веществе связи неполярны и молекула неполярна, двухатомная молекула сложного вещества всегда полярна.
Полярность многоатомной молекулы сложного вещества определяется ее геометрической структурой.
Гибридизация АО -смешение АОс разными (s-, p-, d-илиf-АО), но близкими энергетическими состояниями, вследствие которого возникает такое же число одинаковых по форме и энергии орбиталей, симметрично расположенных в пространстве
При гибридизации химические связи формируются электронами не «чистых», а «смешанных», или гибридных АО, электронная плотность в которых смещена в сторону образования связи. Поэтому перекрывание гибридных АО происходит в большей степени, чем негибридных орбиталей , химические связи прочнее и молекула более устойчива.
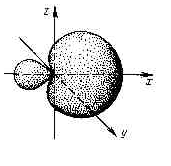
Гибридная АО
Пространственная структура молекул определяется числом и направленностью химических связей в молекуле.
Двухатомные молекулы – все двухатомные молекулы линейные
