
- •Письменная консультация по теме:
- •1.1. Простое вещество (н2, f2, Cl2, Br2, i2)
- •1.2. Сложное вещество (hf, hCl, hBr, hi)
- •2. Трехатомные молекулы (4а подгруппа – SiCl2, PbBr2… и 6a подгруппа - н2s, н2Se…)
- •3. Четырехатомные молекулы (5а подгруппа –SbН3, pСl3, pн3, …)
- •4. С гибридизацией ао
- •4.4. В гибридизации участвуют не только ао связывающих электронов, но и ао неподеленных электронных пар (нп)
- •Взаимодействия между частицами вещества
- •Донорно-акцепторное взаимодействие молекул
- •Водородная межмолекулярная связь
- •Свойства твердых тел
- •Виды кристаллов и их свойства.
- •1. Молекулярный.
- •2. Ионный
- •3. Атомно-ковалентный
- •4. Металлический
- •Характеристики некоторых веществ в твердом кристаллическом состоянии
- •Типы кристаллических решеток
Донорно-акцепторное взаимодействие молекул
происходит при наличии у атома одной молекулы – неподеленной пары ē, а у атома другой молекулы – свободной АО
KF + BF3 → K[BF4]
KF:F-… 2s22p6 (F-донор)
BF3: B*…2s12p2 (B* акцептор)
возникает ковалентная связь по донорно-акцепторному механизму.
Комплексные соединения - сложные соединения, содержащие комплекс, между частицами которого осуществляется ковалентная связь по донорно-акцепторному механизму
K[BF4] – тетрафтороборат калия
K[BF4] →K+ + [BF4]-
K+- внешняя сфера [BF4]--внутренняя сфера (комплекс)
Состав комплекса:
Комплексообразователь (в основном, катион металла)
Лиганды (анионы или молекулы)
Координационное число (к.ч.) – количество лигандов, координируемых комплексообразователем
Между внешней и внутренней сферой – электростатическое ион-ионное взаимодействие
Между комплексообразователем и лигандами – ковалентная связь по донорно-акцепторному механизму: донор – лиганд (поставщик пары электронов), акцептор – комплексообразователь (наличие свободных АО)
Водородная межмолекулярная связь
это связь, образованная положительно поляризованным атомом водорода одной молекулы - А-Н и электроотрицательным атомом В - другой молекулы
Межмолекулярная Н-связь: А- – Н+ + В- – R ® А- – Н+ ... В- – R
водородная связь
Атомы А и В – одинаковые: Нd+- Fd- + Нd+- Fd- ® H-F ... H-F
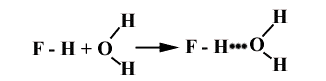 Атомы А и В – разные:
Атомы А и В – разные:
Признак водородной связи: расстояние между ядром Н и ядром атома В меньше, чем это расстояние при вандерваальсовом взаимодействии.
Наиболее прочные связи с элементами II периода: - Н ... F- > -Н ... O= > -Н ... N≡
Энергия водородной связи имеет промежуточное значение между энергией ковалентной связи и вандерваальсовыми силами.
Возникновение водородных связей приводит к ассоциации молекул: к образованию димеров, тримеров и других полимерных структур, зигзагообразных структур (НF)n, спиральных структур белков, кристаллического строения льда, кольцевой димерной структуры низших карбоновых кислот и др.
Межмолекулярные Н-связи изменяют свойства веществ: повышают вязкость, диэлектрическую постоянную, температуру кипения и плавления, теплоту плавления и парообразования вещества.
Н2О, НF и NН3 - аномально высокие Ткип и Тпл.
ПРИМЕР
Укажите все виды межмолекулярных взаимодействий в системе из молекул PH3 и в системе NH3.Чем Вы объясните более высокую ТкипNH3 ?
Обе молекулы – полярны. Между молекулами РН3 – вандерваальсовы взаимодействия, между молекулами NH3 кроме вандерваальсовых взаимодействий присутствуют межмолекулярные водородные связи, следовательно, во втором случае для фазового перехода нужно приложить больше энергии, чем в первом и ТкипNH3 выше.
Свойства твердых тел
Состояние вещества – твердое, жидкое, газообразное
Твердое вещество
– аморфное: нет определенной Тпл - существует интервал размягчения (смола, стекло, пластилин)
- кристаллическое: определенная Тпл (NaCl, графит, металлы)
Частицы твердого кристаллического тела:атомы, молекулы, ионы.
Положения частиц в кристалле–узлы. Трехмерное расположение узлов –кристалл.Простейшая часть кристалла –элементарная ячейка.
