
- •Письменная консультация по теме:
- •1.1. Простое вещество (н2, f2, Cl2, Br2, i2)
- •1.2. Сложное вещество (hf, hCl, hBr, hi)
- •2. Трехатомные молекулы (4а подгруппа – SiCl2, PbBr2… и 6a подгруппа - н2s, н2Se…)
- •3. Четырехатомные молекулы (5а подгруппа –SbН3, pСl3, pн3, …)
- •4. С гибридизацией ао
- •4.4. В гибридизации участвуют не только ао связывающих электронов, но и ао неподеленных электронных пар (нп)
- •Взаимодействия между частицами вещества
- •Донорно-акцепторное взаимодействие молекул
- •Водородная межмолекулярная связь
- •Свойства твердых тел
- •Виды кристаллов и их свойства.
- •1. Молекулярный.
- •2. Ионный
- •3. Атомно-ковалентный
- •4. Металлический
- •Характеристики некоторых веществ в твердом кристаллическом состоянии
- •Типы кристаллических решеток
4.4. В гибридизации участвуют не только ао связывающих электронов, но и ао неподеленных электронных пар (нп)
М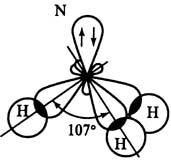 олекулы
NН3
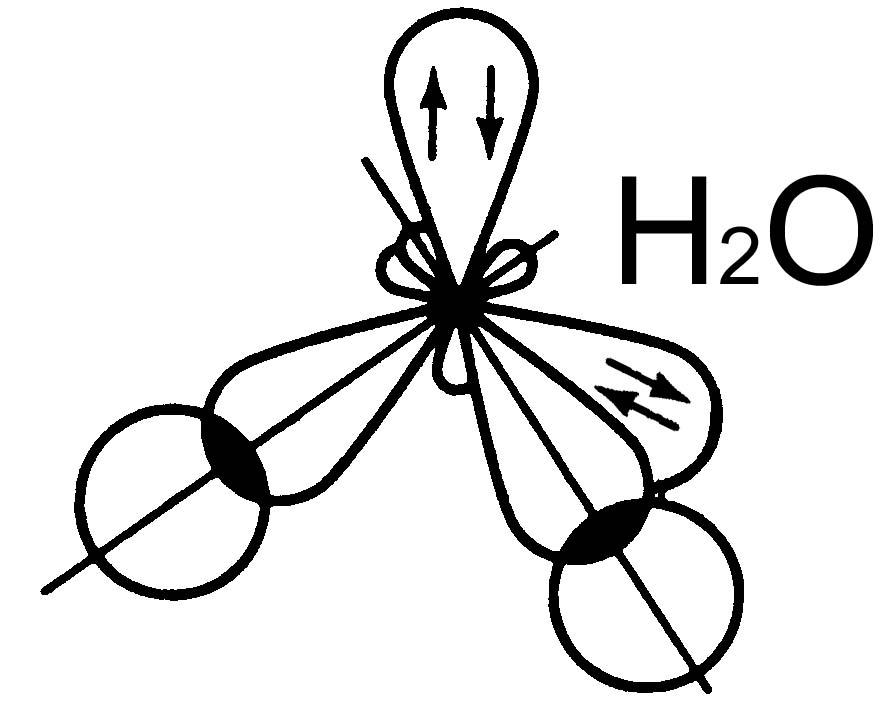
Н2О
олекулы
NН3
Н2О
N
 …2s22p3
O…2s22p4
…2s22p3
O…2s22p4
H 1s1 H 1s1 H1s1 Н 1s1 Н 1s1 Н2О NН3
Валентные углы для NH3 107,3º и Н2О 104,5º (близки к тетраэдрическому 109,3º)
Это позволяет предположить sp3–гибридизацию АОN в молекуле NН3 и Ов молекуле Н2О.
Неподеленные электронные пары (НП) влияют на величину валентных углов, силы отталкивания между ними больше, чем между относительно закрепленными связывающими электронными парами (СП).
В молекуле NН3 одна НП уменьшает тетраэдрический угол (109,3о) до 107о, а в молекуле Н2О две НП уменьшают его до 104,5о.
Ионная химическая связь
образуется при взаимодействии элементов значительно отличающихся по ЭО
При ∆ЭО > 1.7 - связь ионная, при ∆ЭО < 1.7 - связь ковалентная полярная. (Чисто ионных связей нет, т.к. нет полного перехода электронов.)
Na+ + Cl - → NaCl
Na - ē→ Na + (катион) Cl + ē→Cl- (анион)
Ионная химическая связь – это электростатическое взаимодействие между противоположно заряженными ионами.Свойства: - ненаправленность и ненасыщенность,
Металлическая химическая связь
притяжение между ионами в узлах кристалла и обобществленными (нелокализованными) валентными электронами.
Металлы имеют кристаллическое строение. В кристалле каждый атом (узлы кристалла)связан от 8 до 12 атомов-соседей особой металлической связью (МС), а обобществленные ē образуютэлектронный газ. Свойства МС – ненаправленна
Природа МС обуславливает металлические свойства:
Высокая электропроводность (Cu, Ag, Au, Al, Fe…) и теплопроводность (Ag, Cu…)
Ковкость (возможность придать форму) и пластичность (деформация без разрушения)
Металлический блеск (M һν↔ M*)
Взаимодействия между частицами вещества
Между частицами вещества в конденсированном состоянии действуют силы притяжения:
вандерваальсовы силы,
донорно-акцепторные взаимодействия,
водородные межмолекулярные связи.
Вандерваальсовы силы - силы межмолекулярного взаимодействия, проявляющиеся на расстояниях, превосходящих размеры частиц(электростатическая природа)
Еванд = Еинд+Еориен+Едисп Еванд << Ех.с
Три составляющих вандерваальсовых сил:
Ориентационная составляющая или диполь-дипольное взаимодействие -взаимодействие полярных молекул при их сближении
Индукционная составляющая- взаимодействие неполярной молекулы с полярной или внешним электрическим полем. Еинд Еориен
Электрическое поле диполя, действуя на неполярную молекулу, деформирует ее и превращает в индуцированный (наведенный) диполь
Дисперсионная составляющая (эффект Лондона) - взаимодействие мгновенных диполей, возникающих за счет флуктуации электрической плотности
Еинд Еориен Едисп
Едисп - единственная составляющая вандерваальсовых сил для неполярных молекул
С ↑ Е возрастет Ткипжидкостей, а также теплота их испарения.
Укажите все возможные виды межмолекулярных взаимодействий в системе из молекул HCl, HBr, HI.
Решение:
Эти молекулы - полярные, с аналогичной структурой – линейной. Между полярными молекулами возможны все виды вандерваальсовых взаимодействий: ориентационное, индукционное, дисперсионное.
Ткип.растет в ряду НCl–HBr–HI, т.к. в ряду растет энергия межмолекулярного взаимодействияЕHI >Е HBr >Е HCl.
