
- •Основные законы химии
- •Строение атома.
- •Химическая связь. Строение молекул.
- •Элементы химической термодинамики.
- •1 Порядок
- •2 Порядок
- •Химическое равновесие и закон действующих масс.
- •Растворы
- •Осмотическое давление.
- •Индикаторы
- •Гидролиз
- •Взаимно-усиливающий гидролиз
- •Окислительно-восстановительные реакции.
Строение атома.
Открытие в 1869 году Менделеевым термоядерного закона.
Открытие в 1879 катодных лучей Круксом.
В 1897 году Томсон назвал их электронами
1909 Милликем определил массу электронов и их заряд.
1886 Гольдштейн открыл гамма-лучи (полож. частицы).
1895 Открытие рентгеновских лучей
1896 Беккерель открыл радиоактивное
излучение
![]() .
.
1911 Резерфорд определил радиус ядра атома
1905 Томсон построил первую модель атома.
1911 Модель Резерфорда
1916 Модель Бора
![]()
![]()
![]()
![]() квант
действия.n=1, 2, 3 – главное
квантовое число.
квант
действия.n=1, 2, 3 – главное
квантовое число.![]() .
.![]() .
.
Движение электрона по эллиптической орбите является ускоренным.
e– Орбитальное квантовое число.
m– Магнитное квантовое число.
Квантово-Механическая модуляция основана на:
1924 Луи де Бройль высказывает мысли, что электрон обладает волновыми свойствами.
1927 Гейзенберг сформулировал принцип неопределенности
1927 Шредингер. Дифракция электронов.
![]()
![]()
![]()
![]()
![]() .
.
Принцип неопределенности: Произведение
неопределенности положения и импульса
не может быть меньше постоянной Планка.![]() .
.![]() .
.
Нельзя одновременно определить с одинаковой точностью положение частицы и её импульс.
В квантовой механике нельзя говорить о точном положении частиц, а можно о вероятности нахождения электрона в данном элементе пространства.
Орбиталь– часть и форма пространства, вероятность нахождения в котором электрона равняется наперед заряженной величине, обычно 90 %.
![]() .
.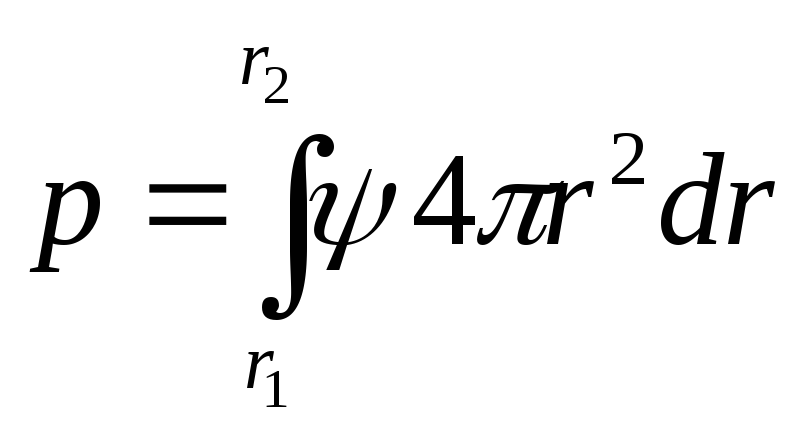
Квантовые числа. Их смысл и значение.
Цифра 1 2 3 4 5
Символ klmno.
Магнитное квантовое числохарактеризует распределение энергии электрона в пределах подуровня в зависимости от положения орбитали во внешнем магнитном поле.
Типовое квантовое число(ms) характеризует момент количества движения электрона при вращении вокруг своей оси.
1924 Принцип Паули. В атоме не может быть двух или более электронов, характеризующихся одинаковым набором значений четырех квантовых чисел.
Принцип Хунда: При возрастании заряда ядра атома электроны стремятся занять максимальное число орбиталей атомов, т.е. чтобы максимальная величина суммы значений типовых квантовых чисел была максимальна.
Принцип Ключевского.
1 правило. При возрастании заряда ядра, заполнение орбиталей происходит в порядке возрастания суммы n+l.l-орбитальное квантовое число.n– главное квантовое число.
2 правило. Если сумма значений n+lодинакова, то в первую очередь идет заполнение орбитали в порядке возрастания главного квантового числа.
![]() .
Последняя буква указывает на принадлежность
элемента к уровню.
.
Последняя буква указывает на принадлежность
элемента к уровню.
В связи с периодическим изменением электронных структур атомов, в связи с возрастанием заряда ядра периодически меняются: Атомные радиусы, потенциалы ионизации, сродство к электрону, электроотрицательность, валентность, степень окисления.
1) Радиус. Атомный радиус зависит не
только от заряда ядра, но и от того, в
какое соединение он входит. В связи с
этим используется понятиеэффективности
атомного радиуса(половина расстояния
между 2 атомами данного элемента в
кристаллической решетке). Измеряется
в нм и уменьшается в периоде![]() ,
в группах возрастает
,
в группах возрастает![]() .
.
2) Потенциал ионизации: (Минимальное
напряжение, которое необходимо свободному
электрону для удаления его из 1 моля
одиночных атомов). Э+J1=Э1++1![]() .J1-первый
потенциал ионизации.[эВ]
.J1-первый
потенциал ионизации.[эВ]
1
Слева направо потенциал растет
Be1s22s22p0
Зависит и от энергии
B 1s22sp22p1Состояние
![]()
|
Элемент |
Li |
Be |
B |
C |
N |
O |
F |
|
Заряд ядра |
+3 |
+4 |
+5 |
+6 |
+7 |
+8 |
+9 |
|
Потенциал ионизации |
5.4 |
9.3 |
8.3 |
11.3 |
14.5 |
13.6 |
17.4 |
3) Сродство к электрону.Это энергия, выделяемая при захвате одиночных электронов одним молем одиночных атомов.
Э+1![]() =Э1-
=Э1-![]() Е.
Е-энергия сродства к
Е.
Е-энергия сродства к
![]() .E0,6 0,4 0,3 1,3 -0,2 1,5 3.4
Растет слева направо.
.E0,6 0,4 0,3 1,3 -0,2 1,5 3.4
Растет слева направо.
LiBeBCNOF
Поль. 1931. Характеристика электроотрицательности.
Она бывает абсолютная Э1О=J+Eи относительная ЭО-![]() .
.![]() LiBeBCNOFВозрастает
LiBeBCNOFВозрастает![]() и
и![]() .
.
1 1.5 2 2.5 3 3.5 4
Типы связей: а) Неполярная
![]() б) Полярная
б) Полярная![]() в) Ионная
в) Ионная![]()
4) Провал
![]() .
Если у атома заполнениеfилиdподуровня близко к
заполнению наполовину или полностью,
то с выше лежащего уровня проваливается
.
Если у атома заполнениеfилиdподуровня близко к
заполнению наполовину или полностью,
то с выше лежащего уровня проваливается
![]() .
Полученное состояние является
энергетически выгодным (устойчивым).Cr, Cu, Ag, Me и f
элементы. Например:
29Сu
1s22s22p63s23p64s23d9
(d-элемент). Провал –3s23p64s13d10
или3s23p64s13d94p1
.
Полученное состояние является
энергетически выгодным (устойчивым).Cr, Cu, Ag, Me и f
элементы. Например:
29Сu
1s22s22p63s23p64s23d9
(d-элемент). Провал –3s23p64s13d10
или3s23p64s13d94p1
При возбуждении атомов элементов
разрешен переход электронов только в
пределах своего энергетического уровня
(за исключением провалов
![]() )
)
