
- •Основные законы химии
- •Строение атома.
- •Химическая связь. Строение молекул.
- •Элементы химической термодинамики.
- •1 Порядок
- •2 Порядок
- •Химическое равновесие и закон действующих масс.
- •Растворы
- •Осмотическое давление.
- •Индикаторы
- •Гидролиз
- •Взаимно-усиливающий гидролиз
- •Окислительно-восстановительные реакции.
Элементы химической термодинамики.
Занимается изучением макросистем.
Термодинамическая система– совокупность взаимодействующих веществ, имеющих видимые или воображаемые границы с окружающей средой.
Они бывают: Изолированные и неизолированные.
Изолированные не обмениваются с внешней средой ни массой, ни энергией. Неизолированные делят на: открытые и замкнутые.
Открытые обмениваются и массой и энергией, а замкнутые только энергией.
Они бывают: Гомогенные, гетерогенные.
Гомогенные системы – системы, в которых состав и свойства не меняются в пространстве и во времени.
Гетерогенные системы – обычно однофазные. Состоят из нескольких фаз, свойства которых на границе раздела меняются скачком (дискретно)
Фаза– совокупность гомогенных частей системы, отличающихся по составу и свойствам или только по свойствам. Состав однороден или непрерывно меняется от точки к точке.
Параметр– свойство системы, которое можно измерить. Изменение параметров – процесс.
Параметры бывают: Экстенсивные и интенсивные.
Экстенсивные – Т, молярная масса, теплоемкость – не зависят от количества вещества
Интенсивные – объем, масса.
Уравнение состояния системы– связь между параметрами.
Процессы бывают:Самопроизвольные, вынужденные.
Самопроизвольные – протекающие в одном направлении, в результате которых не наступают существенные изменения в окружающей среде и системе.
Вынужденные – протекают при существующем внешнем воздействии, в результате которых наступают изменения в системе и окружающей среде.
Процессы бывают: Равновесные (в прямом и обратном направлении), неравновесные (только в прямом)
Химическая термодинамика позволяет: 1) Оценить тепловые эффекты процессов 2) возможность и направление процессов 3) научиться управлять процессами и рассчитывать, до каких равновесных состояний процесс протекает 4) выход продукта реакции.
Химическая термодинамика базируется на 2 законах:
1 ЗАКОН: Энергия не возникает
и не исчезает, а превращается в другую,
в эквивалентных количествах.![]() .U– Энергия взаимодействия
всех частиц системы, куда не входит Еки Еп.W– затраченная
и полезная работа. Полезная, если меняется
состав системы.
.U– Энергия взаимодействия
всех частиц системы, куда не входит Еки Еп.W– затраченная
и полезная работа. Полезная, если меняется
состав системы.
Изобарный процесс.
![]() .
.![]() -энтальпия(полное теплосодержание
системы (внутренняя энергия и потенциальная
работа)).
-энтальпия(полное теплосодержание
системы (внутренняя энергия и потенциальная
работа)).
![]()
Изохорный процесс.
![]() .
Если не учитывать в реакции газо- и
парообразные вещества, то
.
Если не учитывать в реакции газо- и
парообразные вещества, то![]()
Основным законом термодинамикиявляется закон Гесса Г.Н. : Тепловой эффект химической реакции не зависит от пути процесса, а определяется видом и состоянием конечных и исходных веществ. Он справедлив приT=const.
Следствие:Тепловой эффект реакции равен сумме энтальпий образований конечных веществ минус сумма энтальпий начальных.
![]() -стандартное
Н образования, где 0-давление,f-образование,
298 – стандартная температура.
-стандартное
Н образования, где 0-давление,f-образование,
298 – стандартная температура.
![]() - это тепловой эффект реакции образования
сложных веществ из устойчивых модификаций
простых веществ, следовательно, для
простых веществ
- это тепловой эффект реакции образования
сложных веществ из устойчивых модификаций
простых веществ, следовательно, для
простых веществ![]() =0,
а для сложных – справочная величина
[кДж/моль]
=0,
а для сложных – справочная величина
[кДж/моль]
Эндотермический процесс
![]() >0
>0
Экзотермический процесс
![]() <0
<0
Знание теплового эффекта реакции не позволяет определить направленность, хотя большинство самопроизвольных процессов – экзо.
2 Закон термодинамики. Единственным результатом любой совокупности процессов не может быть только лишь переход энергии от менее нагретого тела к более нагретому (Клаузиус 1850 год)
Энтропия(превращение энергии) –
логарифмическая термодинамическая
вероятность.![]() [Дж/моль К].
[Дж/моль К].
Термодинамическая вероятность –
совокупность микросостояний, посредством
которой может быть реализовано данное
макросостояние.
![]() - стандартная энтропия. Абсолютную
величину можно измерить. Если
- стандартная энтропия. Абсолютную
величину можно измерить. Если![]() то
то![]() =0 – функция неупорядоченности системы.S– мера бесполезности
теплоты. Используется для определения
направления процесса в изолированных
системах. Процесс протекает самопроизвольно,
если
=0 – функция неупорядоченности системы.S– мера бесполезности
теплоты. Используется для определения
направления процесса в изолированных
системах. Процесс протекает самопроизвольно,
если![]() .
При достижении равновесного состояния
.
При достижении равновесного состояния![]() ,
а самоSдостигает
максимального значения (изолированная
система). Для определения направления
процесса неизвестной системы используют
энергию Гиббса.
,
а самоSдостигает
максимального значения (изолированная
система). Для определения направления
процесса неизвестной системы используют
энергию Гиббса.
![]() при стандартных условиях. В самопроизвольных
процессах
при стандартных условиях. В самопроизвольных
процессах![]() .
.
![]() (энтропийный фактор)
(энтропийный фактор)
![]() (энтальпийный фактор)
(энтальпийный фактор)
![]() >
>![]() обычно
обычно
![]() (изобарно-изотермический потенциал –
назвал Гиббс)
(изобарно-изотермический потенциал –
назвал Гиббс)
![]() - энергия Гиббса. Абсолютную величину
нельзя измерить.
- энергия Гиббса. Абсолютную величину
нельзя измерить.
![]() - можно измерить. Является также мерой
химического сродства – способность
взаимодействовать друг с другом.
- можно измерить. Является также мерой
химического сродства – способность
взаимодействовать друг с другом.
Если
 >
> ,
то
,
то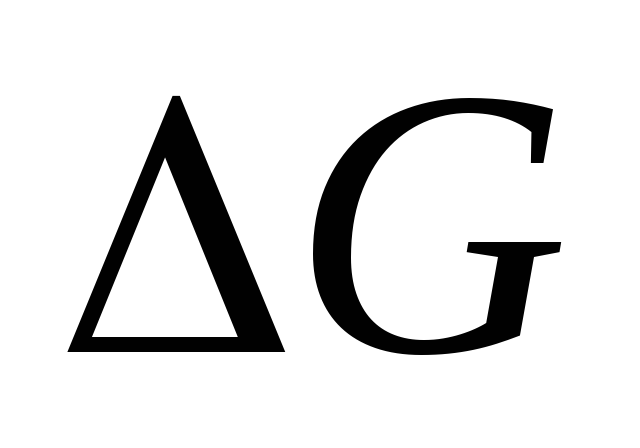 <0.
Вещества обладают химическим сродством.
Протекают в прямом направлении.
<0.
Вещества обладают химическим сродством.
Протекают в прямом направлении.Если
 <
< ,
то
,
то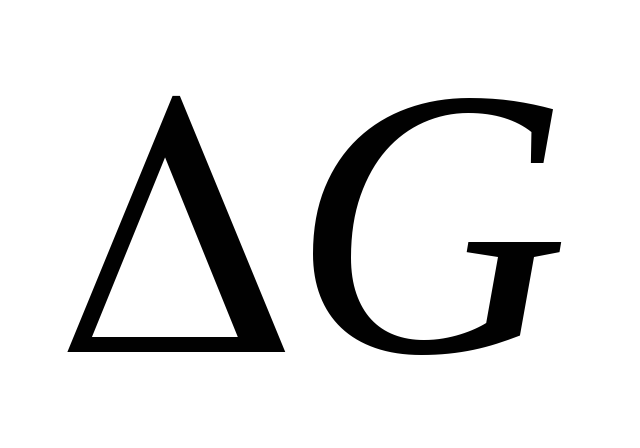 >0.
Реакция самопроизвольно протекает в
обратном направлении.
>0.
Реакция самопроизвольно протекает в
обратном направлении.Если
 =
= ,
то
,
то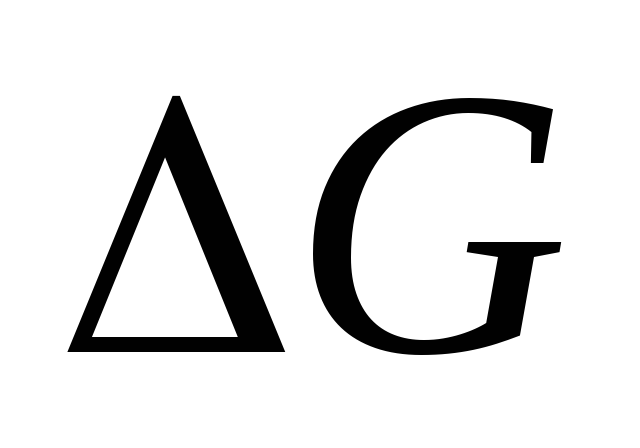 =0.
Система в состоянии равновесия. Протекает
в прямом и обратном направлениях с
постоянной скоростью.
=0.
Система в состоянии равновесия. Протекает
в прямом и обратном направлениях с
постоянной скоростью. <0,
<0,
 >0
– при любых
>0
– при любых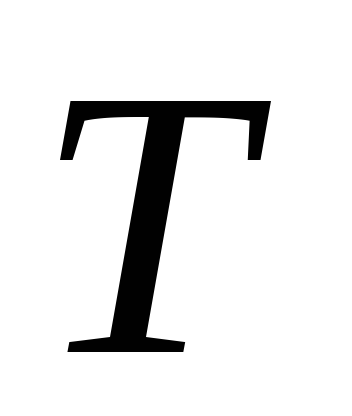 ,
то
,
то <0.
<0. >0,
>0,
 <0
-
<0
-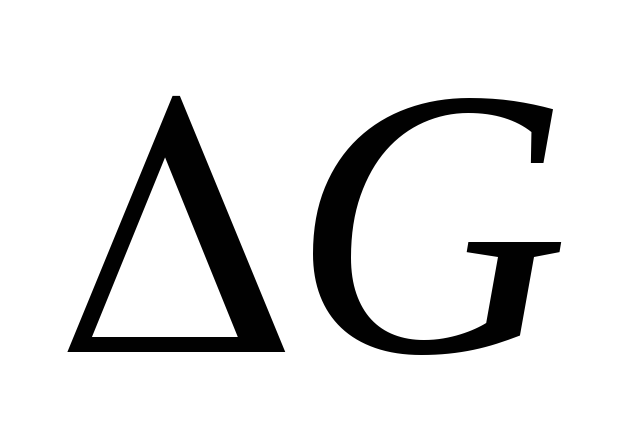 >0.
Процесс невозможен в прямом направлении.
>0.
Процесс невозможен в прямом направлении. >0,
>0,
 >0
– при достижении некоторойT
>0
– при достижении некоторойT >
> - процесс возможен
- процесс возможен <0,
<0,
 <0
– при достижении некоторойT,
процесс невозможен.
<0
– при достижении некоторойT,
процесс невозможен.
![]() связано сconstхимического
равновесия. Рассмотри реакция превращения
А в В.
связано сconstхимического
равновесия. Рассмотри реакция превращения
А в В.
![]() .
.![]() .
.![]() ,
где Рi-парциальное
давление.
,
где Рi-парциальное
давление.
![]() .
Если
.
Если![]() ,
то
,
то![]() .
.
В химической реакции
![]() .
Для простых веществ
.
Для простых веществ![]() =0.
=0.![]()
Химическая кинетика и химическое равновесие.
Химическая кинетика– учение о скорости и механизме протекания реакций.
Скорость реакции– изменение действующей массы (Д.М.) в единицу времени в единице объема для гомогенных и на единице поверхности для гетерогенных.
В качестве Д.М. можно использовать любую характеристику, связанную с количеством взаимодействующих веществ.
Механизм– последовательность протекания отдельных стадий. Если одна из стадий протекает с меньшей скоростью, то эта стадия называется лимитирующей.
На скорость реакции влияют: концентрация, температура, катализаторы. Предположим, что мы рассматриваем гомогенные, односторонние. Д.М. – молярная концентрация – С.
![]() .
.![]() =
=![]() .
.
Основным законом химической кинематики является закон Д.М. (ЗДМ), сформулированный в 1865-1867 годах Гульберном и Вааге: При постоянной температуре скорость химической реакций прямо пропорциональна произведению действующих масс реагирующих веществ.
![]() ,
где А и В – концентрации.k–constхимической реакции.
Если
,
где А и В – концентрации.k–constхимической реакции.
Если![]() ,
то
,
то![]() .
.
Физический смыслконстанты скорости реакции:k– равняется скорости реакции при единичных концентрациях веществ. Зависит от природы реагирующих веществ и Т.
![]() .
Это связано с тем, что реакция сложная,
протекает в несколько стадий, а записанное
уравнение отражает только результат,
а не отдельную стадию.
.
Это связано с тем, что реакция сложная,
протекает в несколько стадий, а записанное
уравнение отражает только результат,
а не отдельную стадию.
Обычно химические реакции классифицируютпо молекулярности и порядку.
Под молекулярностю понимаютчисло молекул, участвующих в элементарных химических взаимодействиях. Знание молекулярности еще недостаточно для записи уравнения ЗДМ.
Порядок реакции n. Различают 0-порядковые и более.
Порядок реакции – число молекул, участвующих в определяющей стадии.
Введение nпозволяет выполнять расчеты, но не вскрывает механизм реакции.
Закономерности реакций последних порядков.
