
- •Основные законы химии
- •Строение атома.
- •Химическая связь. Строение молекул.
- •Элементы химической термодинамики.
- •1 Порядок
- •2 Порядок
- •Химическое равновесие и закон действующих масс.
- •Растворы
- •Осмотическое давление.
- •Индикаторы
- •Гидролиз
- •Взаимно-усиливающий гидролиз
- •Окислительно-восстановительные реакции.
Гидролиз
Гидролиз– обменные разложения веществ воды.
Гидролизу могут подвергаться соли, образованные:
Сильным основанием и слабой кислотой: Na2CO3,K2CO3,KNO2;
Сильной кислотой и слабым основанием: NH4Cl,CuSO4,NiCl2;
Слабая кислота и слабое основание: NH4CN, (NH4)2CO3,Al(CH3COO)3(ацетатAl)
Гидролиз солей, образованных слабыми многоосновными кислотами и многоосновными основаниями, протекают ступенчато.
При гидролизе солей слабых оснований наблюдается образование донорно-акцепторных связей за счет свободных орбиталей катионов и неподеленной электронной пары анионов кислорода молекул воды.
Гидролиз тем сильнее, чем выше заряд катиона и ниже его радиус.
Гидролиз анионов происходит за счет возникновения водородных химических связей, посредством атомов Hмолекул воды и анионов.
Взаимно-усиливающий гидролиз
Гидролиз солей трехвалентных металлов (Al,Cl,Fe) в присутствииCO3, сульфидов и сульфитов щелочных металлов и сульфида аммония протекает до конца.
Гидролиз солей двухвалентных металлов (Zn,Cu,Cd, ртуть,Fe,Cr,Mn,Co,Pb,Cu) в присутствииCO3щелочных металлов, заканчивается на первой ступени с образованиемCO3гидроксометалла (II), выделениемCO2, и образованием соли щелочного металла.
Процесс гидролиза зависит от концентрации соли, природы электролита и температуры:
Концентрация. С уменьшением концентрации степень гидролиза возрастает, т.к. увеличивается число молекул воды, приходящихся на 1 гидрализующийся ион.
Природа электролита. Чем слабее электролит, образующий данную соль, тем выше степень гидролиза.
Температура. Процесс гидролиза – эндотермический. В соответствии с принципом Ле-Шателье с возрастанием температуры выход продукта эндотермических реакций возрастает.
Окислительно-восстановительные реакции.
ОВР– реакции, протекающие с изменением степеней окисления атомов элементов веществ, участвующих в реакции.
Вещества, атомы элементов которых отдают электроны, называются восстановителем.
Вещества, атомы элементов которых принимают электроны – окислители.
3 Типа ОВР:
1) Межмолекулярные реакции;
![]()
2) Внутримолекулярные реакции;
![]()
3) Реакции самовосстановления и
самоокисления.
![]() ;
;
Способ уравнивания ОВР – метод полуреакций, метод ионно-электронного баланса.
Метод ионно-электронного баланса.
Знать исходные и конечные вещества;
Расставить степени окисления атомов элементов веществ;
Исходя из степени окисления, найти окислитель и восстановитель;
Написать схемы электронного баланса. Исходя из равенства отданных и принятых элементов, определить коэффициенты уравнения;
Расставить коэффициенты перед оставшимися веществами;
Проверить правильность коэффициентов по одному из элементов.
Метод полуреакций.
Связывание кислорода окислителем в кислой определяется за счет протонов с образованием молекул воды, а в щелочной и нейтральной среде за счет гидроксидов с образованием молекул воды.
![]()
Присоединение кислорода восстановителем в кислой и нейтральной среде осуществляется за счет молекул воды с образованием протонов, а в щелочной среде за счет гидроксид ионов с получением молекул воды.
![]()
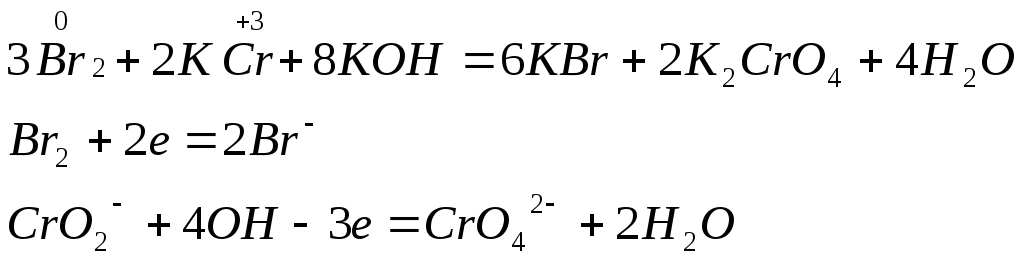
![]()
Метод ионно-электронного баланса применим к реакциям в водных растворах.
Метод электронного баланса – универсален.
Важнейшие окислители.
Простые вещества, находящиеся в периодической системе в 7 группе главной подгруппы – галогены: кислород, азот, сера, фосфор и др.
Г2+2e=2Г-
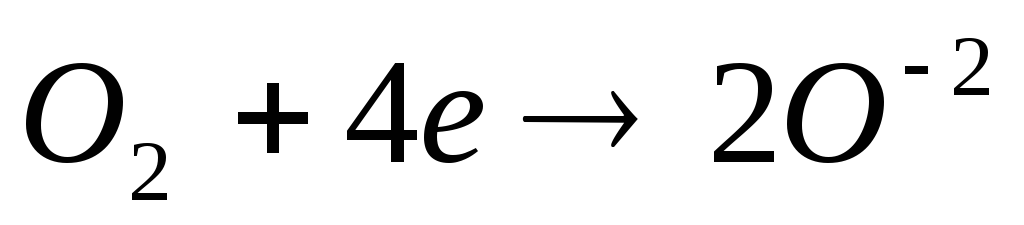
Ионоводороды в растворах разбавленных кислот при взаимодействии с активными металлами.
Ионы металлов в высшей степени окисления
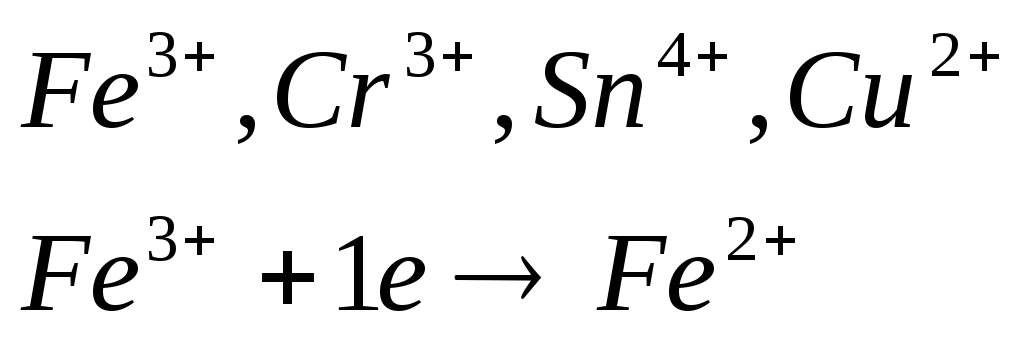
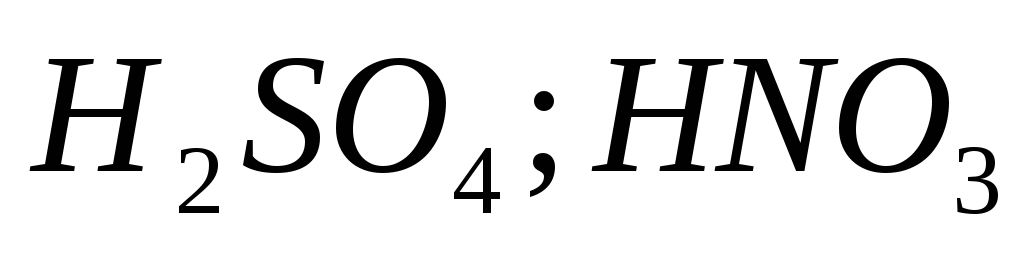 и её соли, кислород содержащие кислоты,
марганаты, хроматы,
и её соли, кислород содержащие кислоты,
марганаты, хроматы,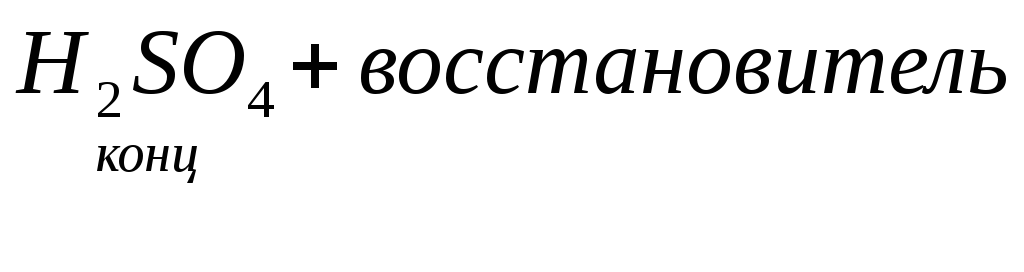 1) активные металлы:Zn,Mg,Ca…
1) активные металлы:Zn,Mg,Ca…
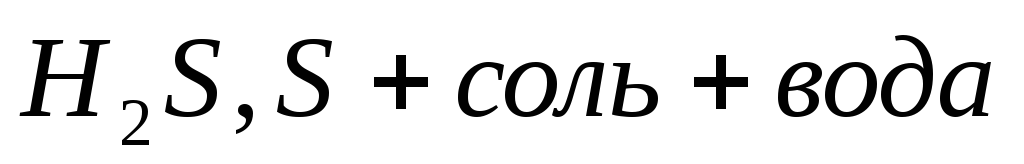
2) неактивные металлы
![]()
![]()
3) Al,Fe,Cr– пассивация
4) неметаллы
![]()
![]()
Азотсодержащая кислота: При взаимодействии А.К. с любым восстановителем никогда не выделяется кислород. !!!
![]()
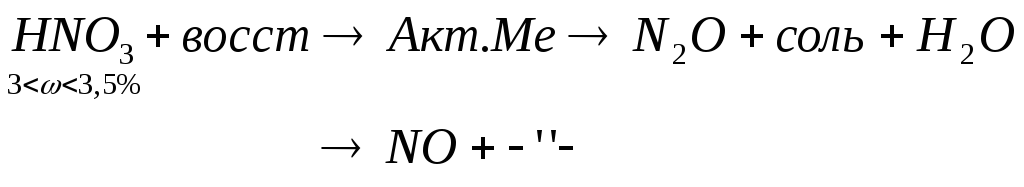

Результаты ОВР часто зависят от характера среды, рассмотрим на примере перманганатов (KMnO4)
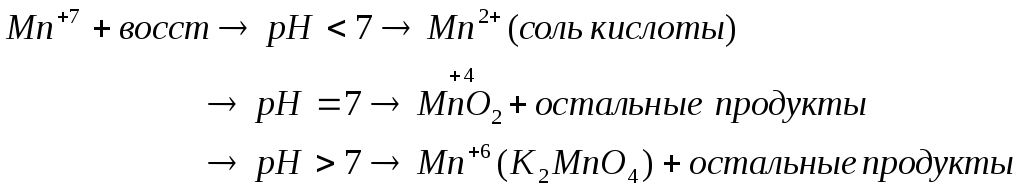
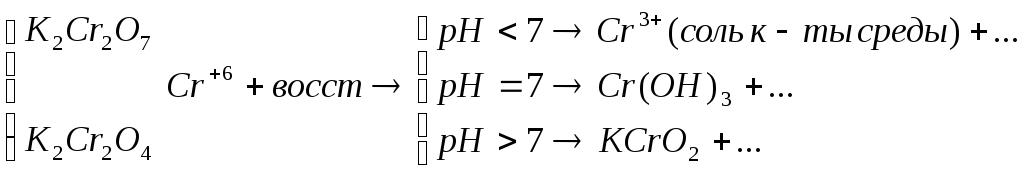
Если окислителем выступает кислородсодержащие
кислоты и соль CrиBr,
то восстановление галогенов идет до
степени окисления -1.![]()
В случае кислородсодержащих кислот йода и их солей, восстановление идет до 0-ой степени
![]()
Некоторые вещества, атомы которых
находятся в промежуточной степени
окисленности:
![]() и
другие вещества, могут проявлять
окислительно-восстановительную
двойственность:
и
другие вещества, могут проявлять
окислительно-восстановительную
двойственность:
В присутствии сильных окислителей проявляются свойства восстановителей и наоборот.
Пример двойственности:
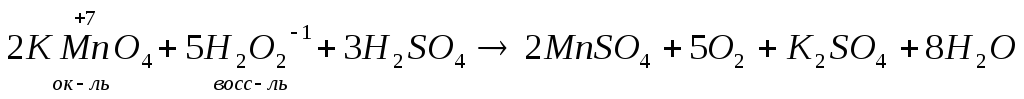

![]()
