
Uchebnoe_posobie
.pdfции), а потому записывается в недиссоциированной форме:
(NiOH)2SO4.
(NH4)2SO4 – хорошо растворимое соединение, являющееся одновременно сильным электролитом (т. к. является солью), а потому записывается в диссоциированной форме: 2NH4+ + SO42-.
Итого ионно-молекулярное уравнение записывается следующим образом:
2Ni2+ + 2SO42- + 2NH4OH (NiOH)2SO4 + 2NH4+ + SO42-
или, после сокращения одинаковых частиц в левой и правой частях уравнения (SO42-),
2Ni2+ + SO42- + 2NH4OH (NiOH)2SO4 + 2NH4+.
Пример 3. Написать ионно-молекулярное уравнение реакции
KI + AgI K[AgI2].
KI – хорошо растворимое соединение, являющееся одновременно сильным электролитом (т. к. является солью), а потому записывается в диссоциированной форме: K+ + I-.
AgI – практически нерастворимое соединение, а потому записывается в недиссоциированной (молекулярной) форме: AgI.
K[AgI2] – комплексное соединение, о чём свидетельствует наличие квадратных скобок в формуле соединения. Само соединение является солью, хорошо растворимой в воде (знак осадка не помечен), а потому оно должно диссоциировать на ионы K+ и [AgI2]-. При этом образующийся ион [AgI2]- является комплексным (устойчивым), т. е. практически не подвергается дальнейшей диссоциации. Таким образом, соединение записывается в виде: K+ + [AgI2] -.
Итого ионное уравнение записывается следующим образом:
K+ + I- + AgI = K+ + [AgI2] -
или, после сокращения одинаковых частиц в левой и правой частях уравнения (K+),
AgI + I- [AgI2]-.
43
Водородный показатель
Рассмотрим подробнее равновесие диссоциации воды:
H2O  H+ + OH-
H+ + OH-
В случае не слишком концентрированных растворов концентрация воды в растворе практически постоянна, и её значение включают в константу равновесия диссоциации воды:
K=[H+][OH-]/[H2O]; K[H2O]=Kw= [H+][OH-].
Величина Kw называется ионным произведением воды. При t = 250C оно равно 10-14.
Вследствие малой величины Kw концентрации ионов H+ и OH- обычно малы. Поэтому для характеристики концентрации H+ была введена специальная величина – водородный показатель pH:
pH = -lg[H+]
Аналогичным образом введён «гидроксильный показатель»
pOH:
pOH = -lg[OH-]
Запишем уравнение для Kw и прологарифмируем его:
Kw = 10-14 = [H+][OH-] lg10-14 = lg[H+] + lg[OH-] -pH-pOH = -14
pH + pOH = 14
Таким образом, если известен pOH, можно найти pH по фор-
муле:
pH = 14 – pOH.
Среда раствора называется кислой, если [H+] > [OH-]. Среда раствора называется щелочной, если [OH-] > [H+]. Среда раствора называется нейтральной, если [H+] = [OH-].
В нейтральной среде pH = pOH, и, таким образом, при 250С нейтральному раствору соответствует pH = 7, кислому раствору pH < 7, щелочному раствору pH > 7.
44

Всильнокислых растворах ([H+] > 1 моль/л) pH может быть отрицательным.
Величина pH является очень важной для протекания различных химических процессов. Рассмотрим методы расчёта pH в растворах кислот и оснований.
Вслучае сильных кислот HnA диссоциация кислоты идёт полностью, следовательно,
[H+] = nCM(HA),
pH = -lg[H+] = -lg nCM(HnA).
Аналогично в случае сильных оснований M(OH)n pOH = -lg nCM(M(OH)n),
следовательно,
pH = 14 + lg nCM(M(OH)n).
В случае слабой кислоты HA диссоциация идёт не полностью, потому расчёт [H+] ведётся иначе. Поскольку CM(HA) = [HA] + [A-], а из уравнения диссоциации HA следует, что [H+] = [A-],
|
[H ][A ] |
|
[H ]2 |
|
[H ]2 |
|
|
[H ]2 |
||||
Kd = |
|
= |
|
= |
|
|
|
= |
|
|
|
. |
[HA] |
[HA] |
c |
M |
(HA) [A ] |
c |
M |
(HA) [H ] |
|||||
|
|
|
|
|
|
|
|
|
|
|
||
Из этого уравнения можно выразить [H+]. Если степень диссоциации кислоты невелика (α < 15%), то [H+] << CM(HA), и данное уравнение упрощается:
[H ]2 Kd ≈ cM (HA) ,
откуда
[H ] 
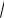 Kd CM (HA) .
Kd CM (HA) .
Аналогично для слабых оснований
[OH ] 
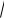 Kd CM (MOH) .
Kd CM (MOH) .
45
Слабые многоосновные кислоты (и слабые многокислотные основания) диссоциируют практически только по первой ступени. Поэтому формулы для расчёта pH для них не меняются, а константа диссоциации для расчёта соответствует первой ступени (Kd 1).
При расчёте pH растворов солей необходимо учитывать их гидролиз.
Гидролиз солей
При диссоциации соли в воде образующиеся ионы являются гидратированными, причём катион взаимодействует с атомом кислорода воды (Mn+ ←:OH2), а анион зачастую связан водородной связью с атомом водорода воды (A:→HOH). При очень сильном взаимодействии иона с водой молекулы воды разлагаются. Так, катион может присоединить к себе группу OH молекулы воды c отщеплением от последней частицы H+:
Mn+ + H2O  MOHn-1 + H+
MOHn-1 + H+
Анион, напротив, может отрывать от молекулы воды частицу H+ с образованием частицы OH-:
An- + H2O  HA1-n + OH-
HA1-n + OH-
Процесс взаимодействия ионов соли с водой, сопровождающийся разложением молекул воды, получил название гидролиза со-
ли.
Первая из указанных реакций также называется гидролизом по катиону, а вторая – гидролизом по аниону.
Ясно, что частицы MOHn-1 или HA1-n в растворе могут образоваться лишь в том случае, если они являются слабыми электролитами. Таким образом, гидролизуются лишь такие соли, которые образованы хотя бы одним слабым электролитом – основанием и (или) кислотой. Соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются. Если соль образована сильной кислотой и слабым основанием (например, CuSO4), протекает реакция гидролиза по катиону, выделяется ион H+, и среда раствора – кислая. Если соль образована сильным основанием и слабой кисло-
46

той (например, Na2CO3), то протекает реакция гидролиза по аниону, выделяется ион OH-, и среда раствора – щелочная.
Реакция гидролиза фактически является обратной реакции нейтрализации слабой кислоты (основания).
Если катион или анион имеют заряд (по модулю) больше 1, гидролиз проходит ступенчато. Реакция присоединения первого H+ (OH-) называется первой ступенью гидролиза, второго H+ (OH-) – второй ступенью гидролиза, и т. д. Например, в случае раствора CuSO4 гидролиз по катиону протекает следующим образом:
Cu2+ + H2O  CuOH+ + H+ (первая ступень гидролиза)
CuOH+ + H+ (первая ступень гидролиза)
CuOH+ + H2O  Cu(OH)2 + H+ (вторая ступень гидролиза)
Cu(OH)2 + H+ (вторая ступень гидролиза)
Аналогично в растворе Na2CO3 гидролиз по аниону проходит следующим образом:
CO32- + H2O  HCO3- + OH- (первая ступень гидролиза) HCO3- + H2O
HCO3- + OH- (первая ступень гидролиза) HCO3- + H2O  H2CO3 + OH- (вторая ступень гидролиза)
H2CO3 + OH- (вторая ступень гидролиза)
Данным равновесиям соответствуют константы гидролиза
Kh 1 и Kh 2, соответственно.
Найдём связь констант Kh и Kd. Поскольку концентрация воды в разбавленных растворах примерно постоянна, её вводят в величину Kh, например, для первой из указанных реакций:
[CuOH ][H ] K= [Cu 2 ][H2O] ;
Kh 1 = K[H2O] = [CuOH ][H ] .
Следовательно,
Kh 1= |
[CuOH |
][H ] |
= |
[CuOH ][H ][OH ] |
= |
[CuOH ]K |
w |
=Kw/Kd 2. |
|
[Cu 2 ] |
[Cu 2 ][OH ] |
[Cu 2 ][OH ] |
|||||||
|
|
|
|
||||||
Отсюда ясно, что константа гидролиза по первой ступени связана с константой диссоциации по последней ступени. В общем случае
Kh i = Kw/Kd (n+1-i),
47
где n – количество атомов водорода (или гидроксогрупп) в соответствующей слабой кислоте (основании). Отсюда вытекают 2 следствия:
1)Чем более слабой кислотой (основанием) образован анион
(катион), тем больше Kh i и, следовательно, тем в большей степени протекает гидролиз соли.
2)Поскольку Kd 1 > Kd 2 > Kd 3, то Kh 1 > Kh 2 > Kh 3. Таким образом, гидролиз обычно протекает в основном только по первой сту-
пени.
Степенью гидролиза β называют отношение числа прогидролизовавшихся ионов к общему начальному числу ионов соли.
Найдём соотношение между константой гидролиза, степенью гидролиза и pH раствора на примере соли CuSO4. Гидролиз протекает по схеме (рассматриваем только первую ступень):
Cu2+ + H2O  CuOH+ + H+
CuOH+ + H+
По уравнению реакции гидролиза [CuOH+] = [H+], а согласно уравнению материального баланса CM(Cu2+) = [Cu2+] + [CuOH+]. Таким образом,
|
|
β = |
[CuOH ] |
= |
|
[H ] |
; |
|
|
|
||||||||
|
|
|
|
|
С |
M |
(Cu 2 ) С |
M |
(Cu 2 ) |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
[CuOH ][H ] |
|
|
|
|
|
[H ]2 |
|
|
|
|
|
|
[H ]2 |
||||
Kh = |
|
|
= |
|
|
|
|
= |
|
|
|
. |
||||||
[Cu 2 ] |
|
С |
M |
(Cu 2 ) [CuOH ] |
С |
M |
(Cu 2 ) [H ] |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Разделим числитель и знаменатель полученного выражения на CM2(Cu2+), тогда
K |
|
|
|
2 |
C |
|
(Cu 2 ) |
||
h |
1 |
|
M |
||||||
|
|
|
|
||||||
|
|
|
|
|
|
||||
При β <<1 выражение упрощается: Kh= β2CM(Cu2+). Таким образом, при малой степени гидролиза для величины β будет справедливо выражение
48

|
Kh |
, |
|
CM |
|||
|
|
где CM – исходная концентрация гидролизующегося иона (например, в случае CuSO4 СM (Cu2+) = СM (CuSO4)). Отсюда ясно, что степень гидролиза возрастает при разбавлении раствора.
Величину [H+] также можно вычислить из полученного уравнения, связывающего Kh и [H+]. Однако при малой степени гидролиза [H+] << CM (Cu2+), и величиной [H+] в знаменателе дроби можно пренебречь. Таким образом, в этом случае
[H ] 
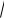 KhCM ,
KhCM ,
где CM – концентрация гидролизующегося иона.
Аналогично для солей, гидролизующихся по аниону, можно получить:
[OH ] 
 KhCM .
KhCM .
Полученные выражения для β и pH аналогичны выражениям для растворов слабых кислот и оснований, но с заменой Kd на Kh.
Как правило, константа и степень гидролиза усиливаются при увеличении заряда гидролизующегося иона. Поэтому катионы с зарядом +4 очень редко, а +5 и более – вовсе не существуют в водных растворах. Кроме того, константа и степень гидролиза заметно растут при повышении температуры.
Молекулярное уравнение гидролиза соли составляется путём добавления к ионно-молекулярному противоионов (т. е. противоположно заряженных ионов) и составлении электронейтральных форм, например при гидролизе CuSO4 – добавлением ионов SO42-:
Cu2+ + H2O  CuOH+ + H+
CuOH+ + H+
2CuSO4 + 2H2O  (CuOH)2SO4 + H2SO4
(CuOH)2SO4 + H2SO4
Если соль образована слабым основанием и слабой кислотой, реакции гидролиза по катиону и по аниону протекают одновременно. Среда раствора будет определяться тем, какая из этих двух реакций протекает в большей степени. Если Kd (кислоты) > Kd (основания), гидролиз по катиону проходит в большей степени, и среда рас-
49
твора – кислая. Если Kd (кислоты) < Kd (основания), гидролиз по аниону идёт в большей степени, и среда раствора – щелочная. При этом образующиеся в ходе реакций гидролиза ионы H+ и OH- взаимодействуют друг с другом с образованием воды. Согласно принципу Ле Шателье, это приводит к смещению обоих равновесий (гидролиза и по катиону, и по аниону) вправо. Таким образом, в случае соли, образованной слабой кислотой и слабым основанием, происходит взаимное усиление гидролиза по катиону и аниону, и степень гидролиза такой соли будет намного выше, чем в случае соли, образованной одним слабым электролитом.
Если соль образована слабым основанием и слабой кислотой, причём основание малорастворимо, а кислота может выделиться в виде газа (H2S) или распадается на газ (H2CO3, H2SO3), взаимное усиление гидролиза особенно сильно, и гидролиз протекает практически необратимо. Если соль при этом образована такими трёхзарядными катионами, как Al3+, Fe3+, Cr3+ (и некоторыми другими), гидролиз идёт по всем ступеням, например:
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
Таким образом, при смешивании растворов, содержащих соли указанных трёхвалентных катионов и соответствующих анионов (S2-, CO32-, SO32-), произойдёт реакция необратимого гидролиза:
Al2(SO4)3 + 3Na2S + 6H2O = 2Al(OH)3↓ + 3H2S↑ + 3Na2SO4 2Al3+ + 3S2- + 6H2O = 2Al(OH)3↓ + 3H2S↑
При смешении растворов солей двухвалентных катионов и сульфидов, как правило, образующиеся сульфиды выпадают в осадок и гидролизу практически не подвергаются, а карбонаты обычно гидролизуются до основных карбонатов и CO2:
2CuSO4 + 2Na2CO3 + H2O = (CuOH)2CO3↓ + CO2↑ + 2Na2SO4
Соли, подвергающиеся необратимому гидролизу, в таблицах растворимости зачастую обозначены знаком « – ».
50
Индикаторы
Некоторые органические вещества при диссоциации могут изменять свой цвет. При увеличении pH (добавлении OH-) слабая кислота будет реагировать следующим образом:
HM + OH- = M- + H2O
Таким образом, при добавлении щёлочи концентрация формы M- будет расти, а концентрация формы HM – уменьшаться. Если НМ и M- имеют разный цвет, при увеличении pH в какой-то момент произойдёт резкое изменение цвета индикатора (из-за резкой смены доминирования формы НМ на форму M-). Таким образом, по цвету раствора можно будет сделать вывод о pH этого раствора. Такие вещества, меняющие цвет в зависимости от величины pH, называют
кислотно-основными индикаторами. Интервал перехода окраски индикаторов составляет около 1,5 единиц pH. Так, индикатор фенолфталеин меняет окраску от бесцветной к малиновой при pH = 8,2
– 9,8, метиловый оранжевый – от красной к оранжево-жёлтой при pH = 3,1 – 4,4.
Буферные растворы
Рассмотрим раствор, содержащий соль слабой кислоты и саму эту кислоту, например: HClO и NaClO. В растворе установятся следующие равновесия:
HClO  H+ + ClO-
H+ + ClO-
NaClO → Na+ + ClO-
Если в такой раствор добавить избыток кислоты (H+), заметная его часть прореагирует с ClO- с образованием HClO, и pH изменится не так сильно. Если добавить щёлочь (OH-), заметная часть OH- прореагирует с HClO с образованием воды, и, таким образом, pH также изменится не очень сильно. Таким образом, pH исследуемого раствора будет слабо меняться при добавлении как кислот, так и щелочей. Такие растворы, слабо меняющие pH при добавлении щелочей или кислот, называют буферными. Буферные растворы используют-
51

ся в тех случаях, когда требуется создать определённое значение pH, слабо меняющееся при проведении в растворе различных химических реакций. Буферные растворы, как правило, содержат слабое основание и его соль (щелочной буферный раствор) или слабую кислоту и её соль (кислый буферный раствор).
Для расчёта pH буферных растворов учтём, что добавление NaClO приводит к увеличению концентрации ионов ClO-, и равновесие диссоциации HClO смещается влево. Фактически, равновесная концентрация HClO тогда будет примерно равна исходной концентрации кислоты HClO, концентрация свободных ионов ClO- будет примерно равна исходной концентрации NaClO. Отразим это в записи константы диссоциации HClO:
Kd = |
[H ][ClO ] |
= [H ] |
СM (NaClO) |
. |
|
|
|||
|
[HClO] |
|
CM (HClO) |
|
Таким образом,
[H+] = Kd CM (HClO) .
CM (NaClO)
Отсюда можно получить общую формулу расчёта pH буферных растворов:
для кислого буферного раствора:
[H+] = Kd CM (HA) . CM (MA)
для щелочного буферного раствора:
[OH-] = Kd CM (MOH) .
CM (MA)
Растворимость
Раствор, в котором установилось химическое равновесие между растворяемым веществом и раствором, называется насыщенным. Концентрация растворённого вещества в насыщенном растворе на-
зывается растворимостью.
52
