
- •2.2. Функциональные производные углеводородов. Галогенпроизводные углеводородов
- •Строение и номенклатура
- •Химические свойства
- •Особенности реакций ароматических галогенопроизводных с галогеном в ароматическом ядре
- •II. Реакции отщепления.
- •Физические свойства галогенопроизводных, их применение
- •Способы получения галогенопроизводных
- •Задания для выполнения кр № 2 по теме «функциональные производные углеводородов. Галогенопроизводные углеводородов» Галогенпроизводные углеводородов
- •2.3. Функциональные производные углеводородов. Кислородсодержащие производные углеводородов
- •2.3.1.Спирты
- •Химические свойства одноатомных спиртов
- •Способы получения одноатомных спиртов
- •Особенности многоатомных спиртов
- •Химические свойства
- •Физические и пожароопасные свойства многоатомных спиртов, их применение
- •Способы получения
- •Строение фенола
- •Химические свойства
- •Физические свойства и применение
- •Способы получения
- •Простые эфиры
- •Химические свойства
- •Физические и пожароопасные свойства простых эфиров
- •Способы получения простых эфиров
- •2.3.2. Альдегиды и кетоны
- •Номенклатура альдегидов и кетонов
- •Химические свойства
- •Физические и пожароопасные свойства альдегидов и кетонов, их применение
- •Способы получения альдегидов и кетонов
- •2.3.3. Карбоновые кислоты
- •Физические свойства.
- •Химические свойства
- •Особенности ненасыщенных карбоновых кислот.
- •Важнейшие представители карбоновых кислот и их производных.
Способы получения простых эфиров
Синтез диэтилового эфира из этанола.
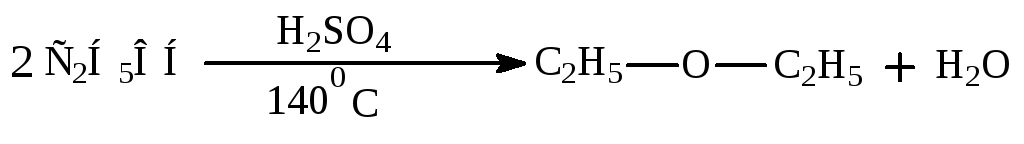
Из алкоголятов натрия или калия и галогенопроизводных.
Пример:
CH3-ONa + C2H5I CH3-O-C2H5 + NaI
2.3.2. Альдегиды и кетоны
Альдегиды и кетоны содержат функциональные группы:
-
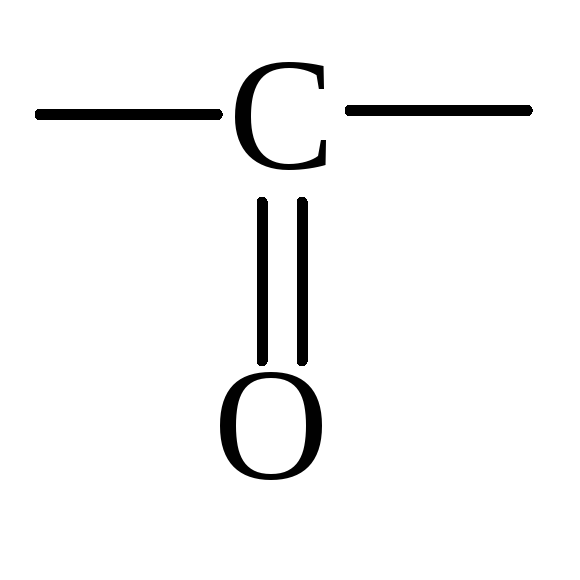
карбонильная группа
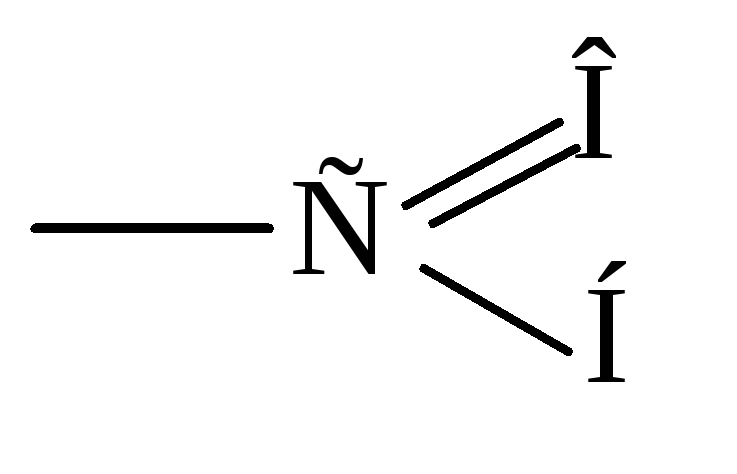
альдегидная или формильная группа
Номенклатура альдегидов и кетонов
![]()
Альдегиды:

Кетоны:

Строение карбонильной группы:
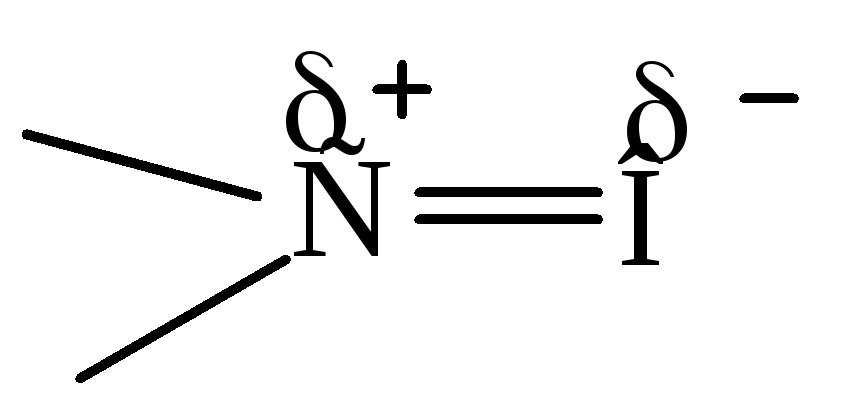 l
С=О=
0.120нм
l
С=О=
0.120нм 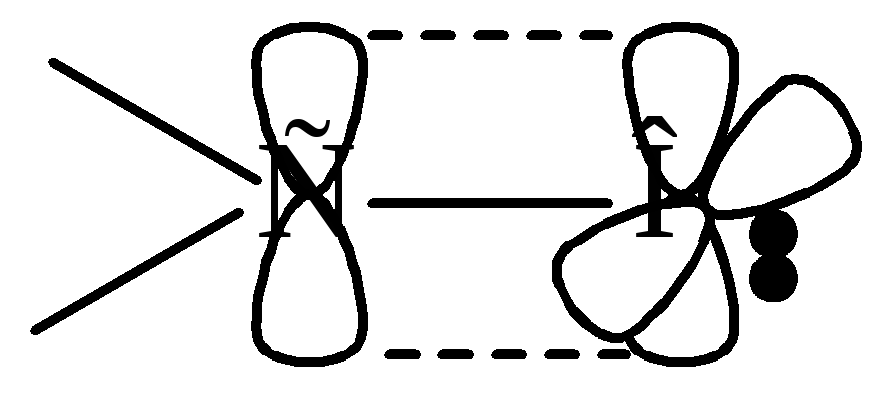
Атом углерода находится в sp2 состоянии гибридизации. Атом кислорода не гибридизован. Одна электронная пара атома кислорода находится на р-орбитали, а другая на s – орбитали. Группа полярная ( = 2.5 - 2.6D для альдегидов и = 2.7 – 2.8D для кетонов).
Химические свойства
Реакции нуклеофильного присоединения по карбонильной группе.
Важнейшей стадией этих реакций является образование связи нуклеофильного реагента с электронодефицитным атомом углерода.
Общий механизм:
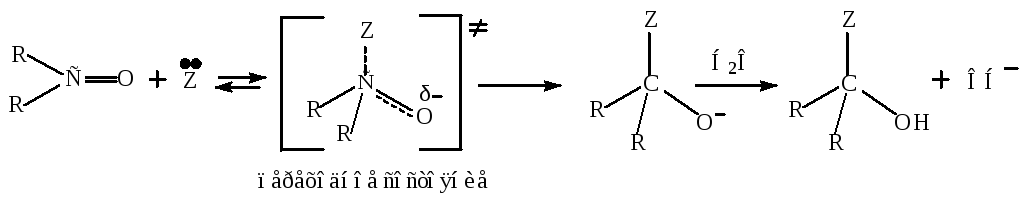
Альдегиды более реакционноспособны, чем кетоны т.к. реакционный центр кетонов пространственно более затруднен и несет меньший положительный заряд.
Реакции присоединения:
Присоединение синильной кислоты.
Пример:
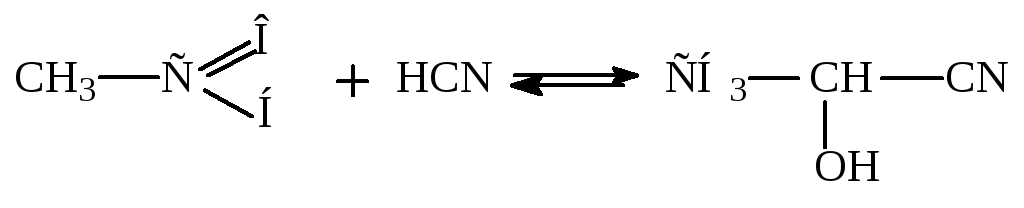
Присоединение бисульфита натрия.
Пример:
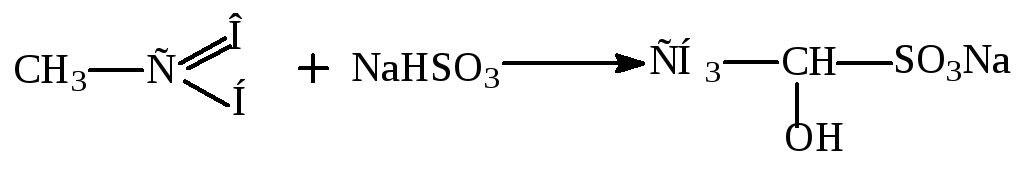
Бисульфитные соединения гидролизуются в кислых и щелочных средах.
В избытке насыщенного раствора бисульфита натрия бисульфитные соединения осаждаются. Реакция используется для выделения альдегидов из реакционной смеси.
Присоединение воды.
Пример:
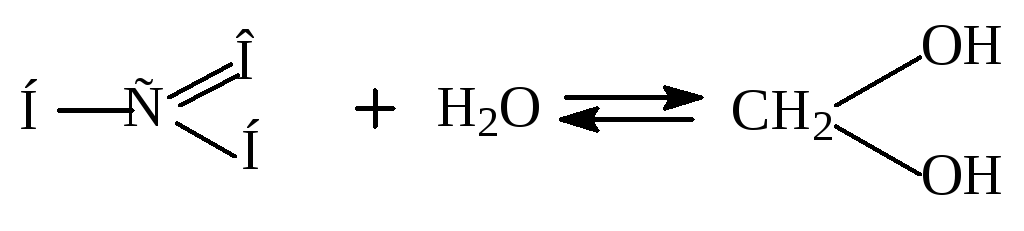
гидрат формальдегида
40% -ный водный раствор формальдегида – формалин
Присоединение спиртов.
Пример:
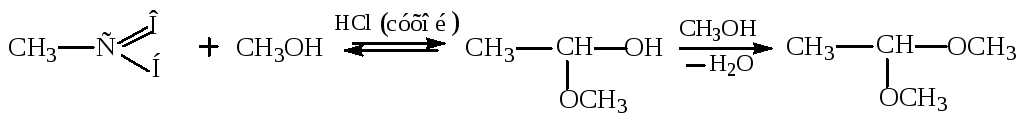
полуацеталь ацеталь
Присоединение аммиака.
Пример: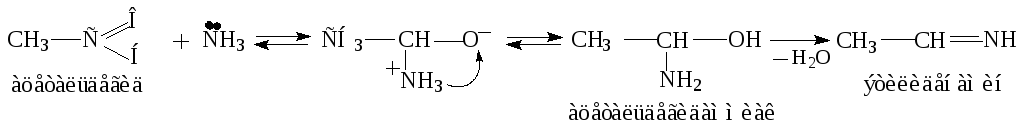
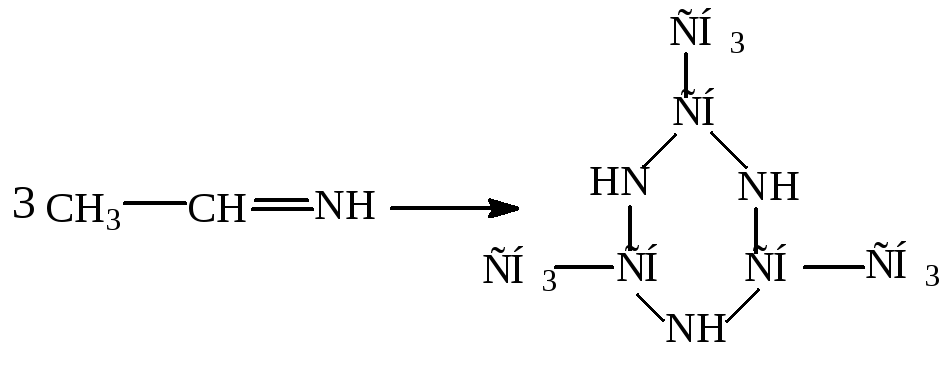
производное гексагидро-1,3,5-триазина
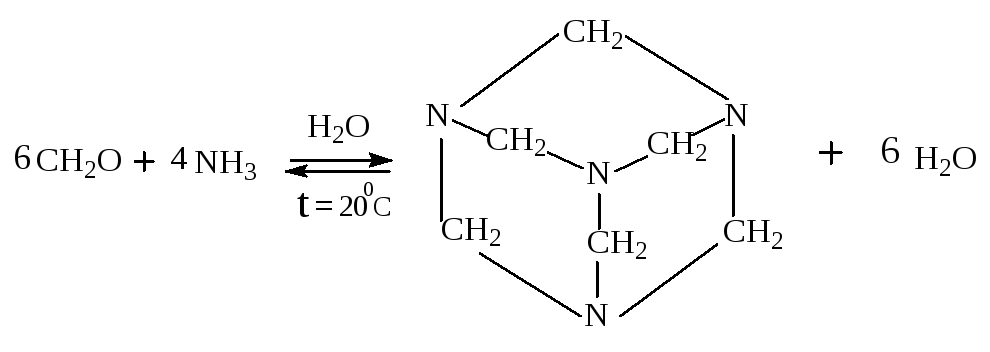
гексаметилентетрамин
(уротропин)
При нитровании уротропина получают мощное бризантное взрывчатое вещество – гексоген.
Галогенирование.
Пример:
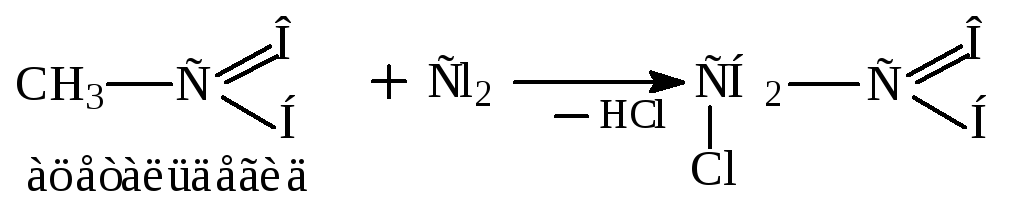
Восстановление альдегидов и кетонов.
Пример:
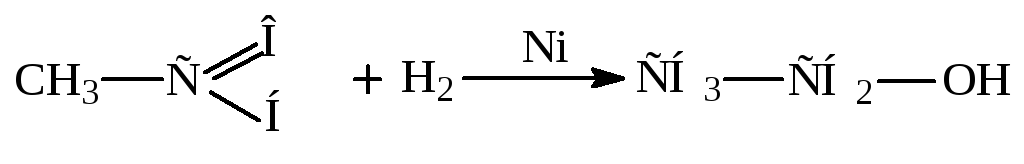
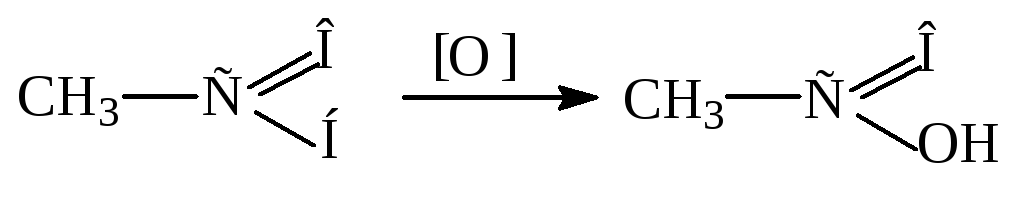
Окисление альдегидов и кетонов.
Окислители: KMnO4, Cr2O3, HNO3, HCrO4 и др.)
Пример:
Альдегиды окисляются очень легко, даже такими мягкими окислителями, как аммиачный раствор оксида серебра (качественная реакция на альдегиды).
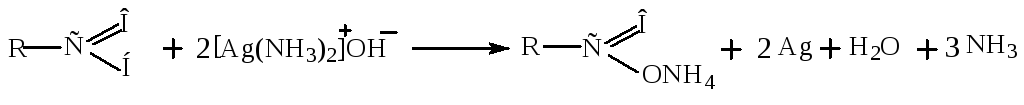
Кетоны окисляются сильными окислителями (HNO3 при нагревании или горячим щелочным раствором KMnO4).
Пример:
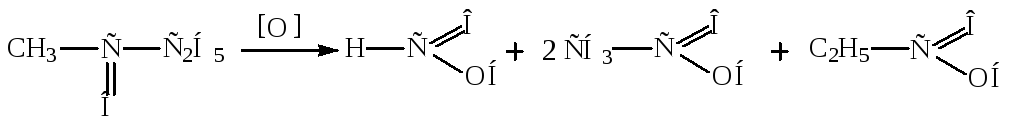
Реакции полимеризации.
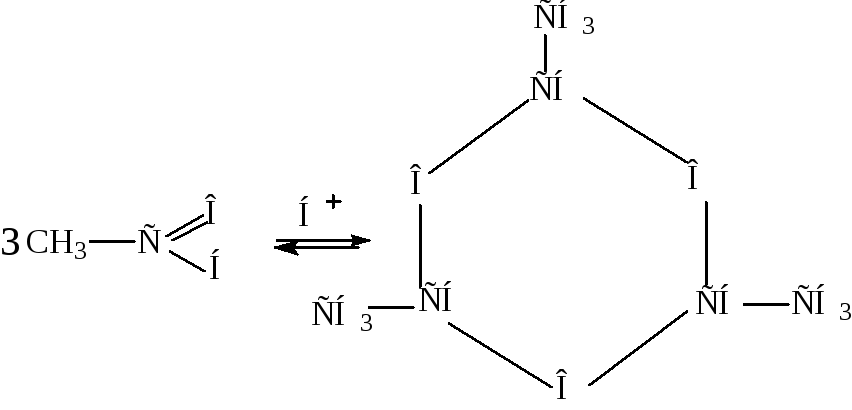
паральдегид
При упаривании водных растворов формальдегида в вакууме образуется полимер параформ. При нагревании параформ деполимеризуется. Его удобно использовать в синтезах вместо формальдегида.
nCH2O + H2O HO-(-CH2O-CH2-)nOH, (n = 8-100)
Физические и пожароопасные свойства альдегидов и кетонов, их применение
Уксусный альдегид (ацетальдегид). Это очень летучая, легко воспламеняющаяся жидкость с резким запахом, хорошо растворимая в воде, спирте и многих органических растворителях. Острое отравление приводит к воспалению легких и плевры. Предельно допустимая концентрация паров уксусного альдегида в воздухе производственных помещений 5мг/м3.
Ацетальдегид используют для получения уксусной кислоты, бутадиена и других важных соединений.
Муравьиный альдегид (формальдегид). Формальдегид – бесцветный газ с острым запахом, хорошо растворимый в воде и в органических растворителях. Он широко используется для получения различных полимеров (фенолформальдегидные смолы, карбамидные смолы). При полимеризации безводного формальдегида в инертных растворителях получают высокомолекулярный полиформальдегид (СН2О)n. Полимер размягчается при 170-1800С, его используют для получения волокон, пленок и конструкционных деталей.
Ацетон. Ацетон - бесцветная, легко воспламеняющаяся жидкость с характерным запахом. Ацетон хорошо растворяется в воде, спиртах, эфирах, маслах и сам является растворителем смол, жиров и др. Пары ацетона ядовиты, в 2 раза тяжелее воздуха и образуют с ним взрывчатые смеси. Концентрационные пределы воспламенения: НПВ-2,2%, ВПВ-13%. Температурные пределы воспламенения ацетона: НПВ -200С, ВПВ + 60С.
При горении ацетон прогревается в глубину, образуя гомотермический слой. Температура прогретого слоя достигает 560С. Скорость выгорания ацетона со свободной поверхности составляет 20см/ч. Определенную пожарную опасность представляют водные растворы ацетона. Водный раствор, содержащий только 10% (масс.) ацетона, является легко воспламеняющейся жидкостью с температурой вспышки 110С. Ацетон самовозгорается при контакте с сильными окислителями. Температура самовоспламенения ацетона 4650С. При действии ультрафиолетовых лучей ацетон разлагается на этан и оксид углерода. В присутствии щелочи он реагирует с хлором, бромом и иодом, образуя соответственно хлороформ, бромоформ и иодоформ.
СН3СОСН3 + 4NaOH + 3I2 CHI3 + CH3COONa +3NaI + 3H2O
Ацетон – широко используемый растворитель. Его применяют в производстве лаков, хлороформа, иодоформа, красок, кинопленок. Он является сырьем для получения синтетического каучука, красителя индиго, в производстве кож, при экстрагировании пищевых продуктов, лекарственных веществ. Он используется для растворения нитроцеллюлозы, ацетилцеллюлозы.
